 2017年6月20日付けの田辺三菱製薬のプレスリリースによると、2017年6月9日、米国デラウェア連邦地方裁判所は、「製品名「ジレニア®(Gilenya®)」の有効成分であるフィンゴリモド塩酸塩(Fingolimod hydrochloride)を保護する米国特許(US5,604,229)は有効であり、本件特許が満了する2019年2月18日(小児臨床試験実施に基づく6か月間の排他期間の追加の可能性あり)より早く、米国において後発品は承認されない」との判決を下したとのことです。この判決は、被告である後発品会社6社が、後発品をFDAに簡略申請するに当たり、本件特許の無効を主張してきたものの、本件特許は有効であり、原告3社(田辺三菱製薬、ノバルティス社(米国新薬申請ホルダー)および三井製糖(共有特許権者))の権利行使が可能であると認めたものであるとのことです。
2017年6月20日付けの田辺三菱製薬のプレスリリースによると、2017年6月9日、米国デラウェア連邦地方裁判所は、「製品名「ジレニア®(Gilenya®)」の有効成分であるフィンゴリモド塩酸塩(Fingolimod hydrochloride)を保護する米国特許(US5,604,229)は有効であり、本件特許が満了する2019年2月18日(小児臨床試験実施に基づく6か月間の排他期間の追加の可能性あり)より早く、米国において後発品は承認されない」との判決を下したとのことです。この判決は、被告である後発品会社6社が、後発品をFDAに簡略申請するに当たり、本件特許の無効を主張してきたものの、本件特許は有効であり、原告3社(田辺三菱製薬、ノバルティス社(米国新薬申請ホルダー)および三井製糖(共有特許権者))の権利行使が可能であると認めたものであるとのことです。
ジレニア®:
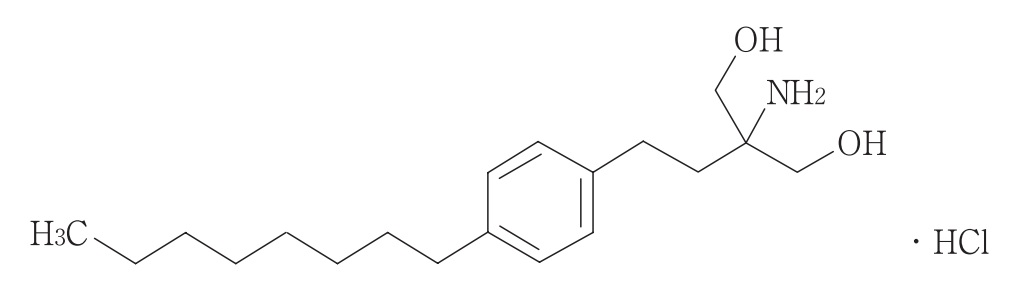
フィンゴリモド塩酸塩を有効成分とする1日1回経口投与カプセル剤。フィンゴリモド塩酸塩は、スフィンゴシン 1-リン酸(S1P)受容体を標的とする多発性硬化症治療剤であり、田辺三菱製薬による開発着手の後、ノバルティス社に導出。米国においては、2010年9月21日に承認、日本(製品名「イムセラ®/ジレニア®」)をはじめ、欧州、カナダ等80か国以上で承認されている。
ジレニア®のOrangebookによると、リストされている特許は4つ。
- 5,604,229 (Patent Expiration: Feb 18, 2019)
- 6,004,565 (Patent Expiration: Sep 23, 2017)
- 8,324,283 (Patent Expiration: Mar 29, 2026)
- 9,187,405 (Patent Expiration: Jun 25, 2027)
US8,324,283は製剤特許。IPRでの無効判断がCAFCでも容認された(Novartis AG v. Torrent Pharmaceuticals. Ltd., No. 2016-1352 (Fed. Cir. Apr. 12, 2017))。
US9,187,405は用途特許。2015年11月17日に成立した。Apotexが2017年2月3日、Argentumが2017年6月9日に、IPRをfileしたようである(IPR2017-00854; IPR2017-01550)。
参考:
- 2017.06.20 田辺三菱製薬プレスリリース: 「米国におけるフィンゴリモド塩酸塩 特許侵害訴訟の地裁勝訴について」


コメント
【追加情報】
US Patent No. 9,187,405について
2022.01.03 NOVARTIS PHARMACEUTICALS v. ACCORD HEALTHCARE INC. CAFC 21-1070
https://cafc.uscourts.gov/opinions-orders/21-1070.OPINION.1-3-2022_1887614.pdf
Novartis announces U.S. Court of Appeals for the Federal Circuit (CAFC) upholds validity of Gilenya® (fingolimod) dosage regimen patent (Jan 04, 2022)
https://www.novartis.com/news/media-releases/novartis-announces-us-court-appeals-federal-circuit-cafc-upholds-validity-gilenya-fingolimod-dosage-regimen-patent
(地裁判決について)
Novartis announces US District Court for the District of Delaware upholds validity of Gilenya® (fingolimod) dosage regimen patent (Aug 17, 2020)
https://www.novartis.com/news/media-releases/novartis-announces-us-district-court-district-delaware-upholds-validity-gilenya-fingolimod-dosage-regimen-patent
(日本ファミリー)
特許第6931019号は2021年8月16日に登録となった。存続期間満了日は2027年6月25日。
ジレニア®カプセル0.5mgの効能・効果は「多発性硬化症の再発予防及び身体的障害の進行抑制」、用法・用量は「通常、成人にはフィンゴリモドとして 1 日 1 回 0.5mg を経口投与する。」である。 再審査期間は10 年(2011年9月26日~2021年9月25日)。
【請求項1】
2-アミノ-2-[2-(4-オクチルフェニル)エチル]プロパン-1,3-ジオールまたは薬学的に許容されるその塩であるS1P受容体モジュレーターを含む、再発-寛解型多発性硬化症(RR-MS)を治療するための医薬組成物であって、
前記S1P受容体モジュレーターが0.5mgの1日用量で再発-寛解型多発性硬化症の患者に経口投与される、医薬組成物。
【請求項2】
前記S1P受容体モジュレーターが2-アミノ-2-[2-(4-オクチルフェニル)エチル]プロパン-1,3-ジオール塩酸塩である、請求項1に記載の医薬組成物。
(仲裁手続き)
Novartisに導出したGilenya®のロイヤリティ収入についての仲裁手続きはまだ継続しているようだ(2022年3月期 第2四半期決算短信より)。
NovartisによるGilenya®2020売上は$3 billion・・・。