Summary
週1回皮下投与の骨粗鬆症治療剤「テリボン®皮下注用56.5μg」(テリパラチド酢酸塩)を製造販売する旭化成ファーマが特許権者であるPTH週1回投与に関する特許第6522715号に対して日医工が請求した無効審判事件において、請求は成り立たないとの特許庁審決を受け、日医工がその取消しを求めて知財高裁に提起した訴訟。
知財高裁(第4部)は、日医工が主張する取消事由(甲7発明に基づく進歩性判断の誤り)には理由があるから、その他の点について判断するまでもなく、本件審決を取り消すとの判決をした。
- 甲7発明との相違点B(投与対象患者を本件3条件を全て満たす骨粗鬆症患者とすること及び甲7発明の骨粗鬆症治療剤を骨折抑制のためのものとすること)に係る本件発明1の構成を想到することは容易と認められ、本件発明1の効果も当業者において予測できない顕著なものとは認められないから、相違点Bが容易に想到できないと認定して本件発明1の進歩性を認めた本件審決の判断には誤りがある。
- そうすると、本件発明2が本件発明1を限定した発明であることを理由に、本件発明1と同様の理由により直ちに本件発明2の進歩性を認めた本件審決の判断にも誤りがある。
本特許を含む旭化成ファーマのPTH週1回投与に関する7つの特許全てについて、知財高裁が進歩性を否定したという状況となった。

1.はじめに
旭化成ファーマは、ヒト副甲状腺ホルモン(PTH)の活性部分であるN端側の1-34ペプチド断片であるテリパラチド(Teriparatide)酢酸塩を有効成分とする週1回皮下投与の骨粗鬆症治療剤「テリボン®皮下注用56.5μg」を製造販売している(再審査期間は終了、2011年9月26日~2017年9月25日(6年))。
そのジェネリック参入障壁となっている(いた)と考えられるのが、PTH週1回投与を特徴とする医薬用途発明に係る特許群(存続期間満了は2030年9月8日)である。
参考:
- 旭化成ファーマは、2021年6月21日付の「【謹告】テリパラチド酢酸塩に関する特許権について」(日刊薬業)において、テリパラチド酢酸塩を有効成分とする骨粗鬆症治療剤ないし予防剤に関する特許権7件(日本特許第6522715号、同第6150846号、同第6043008号、同第6198346号、同第6275900号、同第6274634号、同第6301524号)を保有していると発信している(テリパラチド酢酸塩に関する特許権について(3))。

これらPTH週1回投与に関する7つの医薬用途特許いずれに対してもジェネリックメーカー(沢井製薬または日医工)が無効審判を請求し、それらいずれの事件も審決の取消しを求めて知財高裁での訴訟にまで発展した。
昨年8月から、それら判決が次々と出てており、7つの特許のうち残る特許第6522715号についての判決が待たれていた。

本記事では、これまでの6つの記事:
- 特許第6274634号についての記事「2021.08.31 「旭化成ファーマ v. 沢井製薬」 知財高裁令和2年(行ケ)10004 骨粗鬆症治療剤テリボン®(テリパラチド酢酸塩)の週1回投与特許を巡る裁判①」
- 特許第6043008号についての記事「2021.08.31 「沢井製薬 v. 旭化成ファーマ」 知財高裁令和2年(行ケ)10056 骨粗鬆症治療剤テリボン®(テリパラチド酢酸塩)の週1回投与特許を巡る裁判②」
- 特許第6275900号についての記事「2021.08.31 「沢井製薬 v. 旭化成ファーマ」 知財高裁令和2年(行ケ)10132 骨粗鬆症治療剤テリボン®(テリパラチド酢酸塩)の週1回投与特許を巡る裁判③」
- 特許第6301524号についての記事「2021.09.28 「沢井製薬 v. 旭化成ファーマ」 知財高裁令和2年(行ケ)10038 骨粗鬆症治療剤テリボン®(テリパラチド酢酸塩)の週1回投与特許を巡る裁判④」
- 特許第6198346号についての記事「2021.12.09 「沢井製薬 v. 旭化成ファーマ」 知財高裁令和2年(行ケ)10069 骨粗鬆症治療剤テリボン®(テリパラチド酢酸塩)の週1回投与特許を巡る裁判⑤」
- 特許第6150846号についての記事「2022.02.02 「沢井製薬 v. 旭化成ファーマ」 知財高裁令和2年(行ケ)10071 骨粗鬆症治療剤テリボン®(テリパラチド酢酸塩)の週1回投与特許を巡る裁判⑥」
に続く7回目として、特許第6522715号の無効審判請求事件を判断した知財高裁判決(知財高裁令和3年(行ケ)10069)について紹介する。
この事件は、旭化成ファーマの7つの特許の無効審判請求のうち、特許発明の進歩性を認めた審決の取消しを求めて日医工が提訴したものである。
これまでの他の特許に対する知財高裁判断と同様に、進歩性を肯定した審決が取消されるという結果となった。
2.背景
本件(知財高裁令和3年(行ケ)10069)は、旭化成ファーマ(被告)が特許権者であって発明の名称を「1回当たり100~200単位のPTHが週1回投与されることを特徴とする,PTH含有骨粗鬆症治療/予防剤」とする特許第6522715号に対して日医工が請求した無効審判事件(無効2019-800075号)において、特許庁が訂正を認めて本件審判の請求は成り立たないとの審決をしたことを不服として、日医工(原告)が本件審決の取消しを求めて提起した訴訟である。
本件訂正後の本件発明1及び2に係る特許請求の範囲の記載は、次のとおりである。
本件発明1:
PTH(1-34)又はその塩を有効成分として含有する、骨粗鬆症治療剤ないし予防剤であって、下記(1)~(3)の全ての条件を満たす骨粗鬆症患者を対象とし、皮下注射投与であることを特徴とする、骨折抑制のための骨粗鬆症治療剤ないし予防剤;
(1)年齢が65歳以上である
(2)既存の骨折がある
(3)骨密度が若年成人平均値の80%未満である、および/または、骨萎縮度が萎縮度I度以上である。
本件発明2:
ヒトPTH(1-34)酢酸塩を有効成分として含有する、骨粗鬆症治療剤ないし予防剤であって、下記(1)~(4)の全ての条件を満たす骨粗鬆症患者を対象とし、皮下注射投与であることを特徴とする、骨折抑制のための骨粗鬆症治療剤ないし予防剤;
(1)年齢が65歳以上である
(2)既存の骨折がある
(3)骨密度が若年成人平均値の80%未満である、および/または、骨萎縮度が萎縮度I度以上である
(4)クレアチニンクリアランスが30以上80未満ml/minである腎機能障害を有する。
本件審決は、本件訂正は訂正の要件を全て満たすとした上で、本件審判の請求は成り立たないとの審決をした。
特に、「ヒト副甲状腺ホルモン(1-34)の骨粗鬆症に対する間欠毎週投与の効果:3種類の投与量を用いた無作為化二重盲検前向き試験」(Osteoporosis International vol. 9, p296–306 (1999))(以下「甲7文献」という。)に記載された発明(以下「甲7発明」という。)に基づく進歩性欠如(無効理由1)の有無については、以下のとおり判断した。
ア 甲7発明の認定
hPTH(1-34)の200単位を毎週皮下注射する、hPTH(1-34)を有効成分として含有する骨粗鬆症治療剤であって、厚生省による委員会が提唱した診断基準で骨粗鬆症と定義された、年齢範囲が45歳から95歳の被験者のうち、複数の因子をスコア化することによって評価して骨粗鬆症を定義し、スコアの合計が4より高い患者に投与する、骨粗鬆症治療剤。
イ 本件発明1と甲7発明との一致点
1回当たり200単位のPTH(1-34)が週1回投与され、PTH(1-34)を有効成分として含有する、骨粗鬆症治療剤ないし予防剤であって、骨粗鬆症患者を対象とし、皮下注射投与であることを特徴とする、骨粗鬆症治療剤ないし予防剤。
ウ 本件発明1と甲7発明との相違点(相違点B)
本件発明1は、骨粗鬆症治療剤ないし予防剤が
「下記(1)~(3)の全ての条件を満たす骨粗鬆症患者を対象」
「(1)年齢が65歳以上である
(2)既存の骨折がある
(3)骨密度が若年成人平均値の80%未満である、および/または、骨萎縮度が萎縮度I度以上である」とする「骨折抑制のための」ものであることが特定されているのに対し、甲7発明では、骨粗鬆症治療剤が
「厚生省による委員会が提唱した診断基準で骨粗鬆症と定義された、年齢範囲が45歳から95歳の被験者のうち、複数の因子をスコア化することによって評価して骨粗鬆症を定義し、スコアの合計が4より高い場合の患者に対し投与された際に腰椎骨密度(BMD)の増加が確認されている」ことが記載されているものの、(1)~(3)の全ての条件((以下「本件3条件」という。)を満たす対象者における「骨折抑制のための」ものであることは特定されていない点。
エ 相違点Bの容易想到性
甲7発明の骨粗鬆症治療剤が、骨折抑制効果の期待されていた薬剤であったことや、本件3条件の個々の条件が骨折の危険因子であることが認められるとしても、先行技術文献のいずれにも、本件3条件を全て選択し、3条件充足患者に対して、骨折抑制のためにPTHを200単位週1回投与する動機付けに関する記載や示唆もされておらず、また、・・・3条件充足患者に投与することにより、非3条件充足患者に投与するのに比して、当業者が予測し得ない優れた効果を奏するものであると認められるから、本件発明1は、甲7発明及び本件特許の優先日当時の技術常識に基いて当業者が容易に発明をすることができたものとはいえない。
3.裁判所の判断
裁判所は、日医工(原告)が主張する取消事由1(甲7発明に基づく進歩性判断の誤り)には理由があるから、その他の点について判断するまでもなく、本件審決を取り消すとの判決をした。
- 相違点B(投与対象患者を本件3条件を全て満たす骨粗鬆症患者とすること及び甲7発明の骨粗鬆症治療剤を骨折抑制のためのものとすること)に係る本件発明1の構成を想到することは容易と認められ、本件発明1の効果も当業者において予測できない顕著なものとは認められないから、相違点Bが容易に想到できないと認定して本件発明1の進歩性を認めた本件審決の判断には誤りがある。
- そうすると、本件発明2が本件発明1を限定した発明であることを理由に、本件発明1と同様の理由により直ちに本件発明2の進歩性を認めた本件審決の判断にも誤りがある。
以下に、(1)相違点Bの構成の容易想到性及び(2)発明の効果について、知財高裁が判示した部分を抜粋する。
(1)相違点Bの構成の容易想到性について
ア 「本件3条件」について
甲7発明と本件発明1とは、「1回当たり200単位のPTH(1-34)又はその塩が週1回投与されることを特徴とする」との用量の点において一致するが、その投与の対象となる骨粗鬆症患者の範囲を一応異にする。
・・・より新しい基準を参酌しながらその患者を選別することは、当業者がごく普通に行うことであるから、甲7発明に接した当業者が、甲7発明のPTH200単位週1回投与の骨粗鬆症治療剤を投与する対象患者を選択するのであれば、甲8診断基準とともに、より新しい、甲5診断基準又は甲9診断基準を参酌するといえる。そして・・・当業者が甲7発明の200単位週1回投与の骨粗鬆症治療剤を投与する骨粗鬆症患者を本件条件(2)及び本件条件(3)で選別するのには何ら困難を要しない。
また、・・・高齢者として65歳以上の者を選択するのは常識的なことであり、・・・骨粗鬆症による骨折の複数の危険因子として、低骨密度及び既存骨折に並んで年齢が掲げられていることに着目して投与する骨粗鬆症患者を65歳以上として、本件条件(2)及び本件条件(3)に加えて本件条件(1)のように設定することはごく自然な選択であって、何ら困難を要しない。
そうすると、甲7発明に接した当業者が、投与対象患者を本件3条件を全て満たす患者と特定することは、当業者に格別の困難を要することではない。
イ 「骨折の抑制のための」ものとすることについて
骨粗鬆症は、骨強度の低下を特徴とし、骨折の危険性が増大した骨疾患であり、骨粗鬆症の治療の目的は骨折を予防することであり、「骨強度」は骨密度と骨質の2つの要因からなり、骨密度は骨強度のほぼ70%を説明するとの技術常識があったのであるから、当業者は、骨密度の増加は骨折の予防に寄与すると理解するというべきである。
そうすると、甲7文献には、「ここに挙げた薬剤を投与することによって骨密度(BMD)が増加するため、骨折予防は飛躍的に進歩した」・・・と骨密度の増加が骨折予防に寄与することが記載され、その上で、48週で骨密度を8.1%増大させたことが開示されているのであるから・・・、甲7発明の骨粗鬆症治療剤を骨折抑制のためのものとすることは、当業者が容易に想到できたものである。
ウ 相違点Bについて
前記・・・のとおり、甲7発明の骨粗鬆症治療剤を投与対象患者を本件3条件を全て満たす骨粗鬆症患者とすること、及び甲7発明の骨粗鬆症治療剤を骨折抑制のためのものとすることはいずれも容易であるところ、骨折の危険因子を多く持つ骨粗鬆症患者に骨折抑制のために骨粗鬆症治療剤を投与しようとすることは当然のことであるから、上記各改変は同時に行うことができ、結局、相違点Bに係る本件発明1の構成は、被告主張の基準日においても容易に想到できるというべきである。
(2)発明の効果について
ア 予測できない顕著な効果について
発明の効果が予測できない顕著なものであるかについては、当該発明の特許要件判断の基準日当時、当該発明の構成が奏するものとして当業者が予測することのできなかったものか否か、当該構成から当業者が予測することのできた範囲の効果を超える顕著なものであるか否かという観点から検討する必要がある(最高裁判所平成30年(行ヒ)第69号令和元年8月27日第三小法廷判決・集民262号51頁参照)。もっとも、当該発明の構成のみから、予測できない顕著な効果が認められるか否かを判断することは困難であるから、当該発明の構成に近い構成を有するものとして選択された引用発明の奏する効果や技術水準において達成されていた同種の効果を参酌することは許されると解される。なお、予測できない顕著な効果の立証責任は特許権者にあるから、当該発明の構成から奏する効果が不明であるからといって、直ちに予測できない顕著な効果があるとすることはできない。
参考: 2019.08.27 「アルコン・協和キリン v. X」 最高裁平成30年(行ヒ)69・・・化合物の医薬用途に係る特許発明の進歩性の有無に関し当該特許発明の効果が予測できない顕著なものであることを否定した原審の判断に違法があるとされた事例
イ 本件発明の効果について
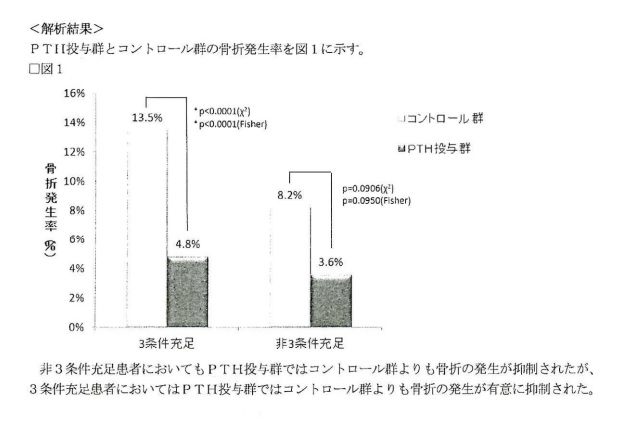
前示のとおり、相違点Bの構成は容易想到であるが、これに対し、被告は、・・・本件発明1は、1回当たり200単位のPTHを3条件充足患者に投与することで、高い骨折抑制効果が達成されること(以下「効果A」という。)を、当業者が予測をすることができなかった顕著な効果である旨主張するから、以下、この効果について検討する。
・・・被告は、発明の効果が予測できない顕著なものであるか否かを当該発明の構成に基づいて判断すべきであるとすると、本件においては、本件発明1の構成である3条件充足患者に対して奏される骨折抑制効果について検討すればよく、3条件充足患者に対する骨折抑制効果と非3条件充足患者に対する骨折抑制効果とを対比する必要はなく、本件明細書に記載されている必要もない旨主張する。
しかしながら、本件発明1は、被告主張の基準日当時においてはPTHが骨粗鬆症治療剤として周知であるとの前提の下に、PTH投与群の中で特に優れた効果を奏する患者群に投与することに進歩性を見出したとするものであるから、本件3条件の全てを満たす患者について骨折抑制効果を確認するためには、高リスク患者に対する骨折抑制効果と低リスク患者(高リスク患者以外の患者)に対する骨折抑制効果とを対比する必要がある。単に本件発明の骨粗鬆症治療剤を投与された高リスク患者とプラセボ投与患者を対比して上記高リスク患者に対する骨折抑制効果があることを示しただけでは、それはPTH投与群に含まれる一群がプラセボ投与群に対して骨折抑制効果が優れることを示しただけであり、高リスク患者群がそれ以外の患者群に比較して、PTH投与群の中で特に効果を奏する患者群であることを明らかにしたことにはならず、PTH投与群の骨折抑制効果を確認したことになるにすぎない。
・・・本件明細書の記載からでは、本件3条件の全てを満たす患者と定義付けられる高リスク患者に対する骨折抑制効果が、本件3条件の全部又は一部を欠く者と定義付けられる低リスク患者に対する骨折抑制効果よりも高いということを理解することはできない。
・・・被告は、3条件充足患者における骨折抑制効果がプラセボに対する関係で有意差があり、非3条件充足患者における骨折抑制効果がプラセボに対する関係で有意差が無ければ、直ちに、本件発明1の骨粗鬆症治療剤が3条件充足患者に対して優れた効果を有するといえる旨主張する。
しかしながら、有意差が無いということは効果が優れているかどうか不明であるということにすぎず、効果が優れていないということを直ちに意味するものではないし、有意差が無かったことが症例数が不足していることによることも否定できない(甲30、35)から、上記のような結論の導出は適当でない。
したがって、実施例1をみても、高リスク患者に対するPTHの骨折抑制効果が、低リスク患者に対するPTHの骨折抑制効果よりも高いということを理解することはできない。
・・・さらに、本件明細書のその他の部分をみても、単に、「高リスク患者に対しては低リスク患者よりも高い骨折抑制効果を奏する」旨の結論のみを提示する記載はあるが、これらは薬理試験のデータに基づくものではなく、このような記載から、高リスク患者(3条件充足患者)に対するPTHの骨折抑制効果が、低リスク患者(非3条件充足患者)に対するPTHの骨折抑制効果よりも高いということを合理的に理解することはできないから、結局、効果Aは、本件明細書の記載に基づかないものというべきである。
被告は、甲4証明書及び甲59証明書により効果Aは明らかである旨主張する。
しかしながら、本件明細書の記載から、高リスク患者に対するPTHの骨折抑制効果が、低リスク患者に対するPTHの骨折抑制効果よりも高いということを理解することができず、また、これを推認することもできない以上、効果Aは対外的に開示されていないものであるから、上記各実験成績証明書を採用して、効果Aを認めることは相当ではない。
仮に、上記各実験成績証明書を参酌するにしても、これら証明書は、・・・本件3条件の全てを満たす患者(高リスク患者)のグループと、本件3条件の全部又は一部を満たさない患者(低リスク患者)のグループのうちごく一部のグループとを比較しているものにすぎないから、およそ、本件3条件の全てを満たす患者の骨折発生の抑制の程度が本件3条件を満たさない患者に対する骨折発生の抑制の程度より優れていると結論付けることに適するものではない。そうすると、上記各実験成績証明書をみても、本件3条件を全て満たす患者に対するPTHの骨折抑制効果が、本件3条件を満たさない患者に対するPTHの骨折抑制効果よりも高いということを理解することはできない。
以上によれば、いずれにしても効果Aを認めることはできないから、効果Aが存することを前提とするその他の点について判断するまでもなく、本件発明1に予測することのできない顕著な効果があると認める余地はない。
(3)本件発明1について(小括)及び本件発明2について
以上のとおりであるから被告主張の基準日を前提にしても、相違点Bに係る本件発明1の構成を想到することは容易と認められ、本件発明1の効果も当業者において予測できない顕著なものとは認められないから、結局、その他の点について判断するまでもなく、相違点Bは当業者が容易に想到し得たものというべきであり、相違点Bが容易に想到できないと認定した本件審決の判断には誤りがある。そうすると、本件発明1の進歩性を認めた本件審決の判断には誤りがある。
・・・そうすると、本件発明2が本件発明1を限定した発明であることを理由に、本件発明1と同様の理由により直ちに本件発明2の進歩性を認めた本件審決の判断にも誤りがある。
4.コメント
(1)PTH週1回投与に関する7つの特許全て、旭化成ファーマの全敗
本事件で争われた特許第6522715号は元をたどると特願2011-530844(出願日2010年9月8日; 再表2011/030774; WO2011/030774)を原出願とするものであり、PTH週1回投与を特徴とする発明に係る7つの特許により構成される特許ファミリーのうちのひとつである。
既に以下の6つの特許についての知財高裁判決が出されており、いずれも進歩性を否定したという点で本事件と共通し、7つの特許全てにおいて旭化成の敗訴となった。それら6つの事件いずれについても最高裁に上告受理申立がされているが順次却下され、いくつかの特許は審決の取消しの判決が確定したことにより特許庁での審理が再開されている。
- 特許第6274634号についての記事「2021.08.31 「旭化成ファーマ v. 沢井製薬」 知財高裁令和2年(行ケ)10004 骨粗鬆症治療剤テリボン®(テリパラチド酢酸塩)の週1回投与特許を巡る裁判①」・・・無効審判の確定により抹消
- 特許第6043008号についての記事「2021.08.31 「沢井製薬 v. 旭化成ファーマ」 知財高裁令和2年(行ケ)10056 骨粗鬆症治療剤テリボン®(テリパラチド酢酸塩)の週1回投与特許を巡る裁判②」・・・審決の取消しの判決が確定したため、審判事件の審理を再開
- 特許第6275900号についての記事「2021.08.31 「沢井製薬 v. 旭化成ファーマ」 知財高裁令和2年(行ケ)10132 骨粗鬆症治療剤テリボン®(テリパラチド酢酸塩)の週1回投与特許を巡る裁判③」・・・審決の取消しの判決が確定したため、審判事件の審理を再開
- 特許第6301524号についての記事「2021.09.28 「沢井製薬 v. 旭化成ファーマ」 知財高裁令和2年(行ケ)10038 骨粗鬆症治療剤テリボン®(テリパラチド酢酸塩)の週1回投与特許を巡る裁判④」・・・審決の取消しの判決が確定したため、審判事件の審理を再開
- 特許第6198346号についての記事「2021.12.09 「沢井製薬 v. 旭化成ファーマ」 知財高裁令和2年(行ケ)10069 骨粗鬆症治療剤テリボン®(テリパラチド酢酸塩)の週1回投与特許を巡る裁判⑤」・・・審決の取消しの判決が確定したため、審判事件の審理を再開
- 特許第6150846号についての記事「2022.02.02 「沢井製薬 v. 旭化成ファーマ」 知財高裁令和2年(行ケ)10071 骨粗鬆症治療剤テリボン®(テリパラチド酢酸塩)の週1回投与特許を巡る裁判⑥」・・・上告受理申立日(2022.02.15)
本事件での知財高裁の判断は、ほとんど上記判決内容と同じ争点・観点と結論で共通するため、上記記事のコメントを参照してほしい。コメントの主な点は以下のとおり。
- 旭化成ファーマの敗因
- 効果の程度についての判断に参酌できる観点
- 進歩性のための明細書記載要件
- 特許庁は進歩性を認めていた
- 主張立証責任を負う出願人は比較試験の妥当性を慎重に検討すべき
- 欧州特許庁での審査
- 被告製品(対象患者)の一部が発明の技術的範囲に属する場合の問題点
- 沢井製薬がジェネリックの承認を取得。パテントリンケージは?
本事件も含めた7つの特許について、旭化成ファーマの敗因を敢えて総括するとすれば、本件特許発明の効果が予測できない顕著なものであることを理解できるように明細書に示すことができなかったことであろう。
これまでの記事にコメントしたように、その背後には、(特定の患者に対して優れた効果を有すると主張したい発明の)進歩性を主張するためには何と何を比較する準備が必要だったのか、そのために臨床データを揃えることが可能なのか、公表前に出願するために明細書にどこまで記載できるのか、技術常識は何か、出願後の審査で後出しデータによる説明が可能且つ許容されうるか、最悪どの国での権利化を死守するか、パテントリンケージに有効な特許か、ジェネリックメーカーへの権利行使(製造販売の差止め)が可能かなど・・・様々なポイントや教訓があるように思う。
本件発明が生まれた時に遡ったとしても、旭化成ファーマにこれ以上の最善の指し手があったのか、対局後の感想戦をいつかしてほしいものである。
(2)テリボン®は凍結乾燥剤からオートインジェクターへシフト
旭化成(株)の2021年度決算説明資料(2022年5月13日)によるとテリボン®の国内売上高2020年度実績は310億円、2021年度実績は382億円であると大幅に伸長している(皮下注用56.5μgだけでなく、皮下注28.2µgオートインジェクターも含むと思われる)。
「テリボンⓇ皮下注用56.5µg」の投与には週1回の通院が必要であることから、旭化成ファーマは、患者の通院負担を軽減するとともに通院が困難な一部の患者に対して新たな治療の選択肢を提供することを目的に、在宅自己投与が可能なオートインジェクター製剤を開発し、「骨折の危険性の高い骨粗鬆症」を効能・効果とし、テリパラチドとして28.2µgを週2回皮下注射を用法・用量とする、「テリボンⓇ皮下注28.2µgオートインジェクター」の製造販売承認を2019年9月20日に取得した(再審査期間なし)(2019.11.27 旭化成ファーマ press release: 「テリボン皮下注28.2μgオートインジェクター」の薬価収載および新発売のお知らせ)。
2022年3月期決算説明会(2022.05.13)において、「テリボン」が好調な背景等を問われた旭化成ファーマ・柏木経営統括総部長は、以下のようにコメントしている。
「テリボン」のオートインジェクターは、COVID-19 影響下において通院せずに自宅で自己投与でき、頻度も週2回という点が高く評価されている。凍結乾燥剤からオートインジェクターへのシフトも含め拡大を続けており、好調に推移している。
・・・
「テリボン」に関しては、2021年度の売上高は 380 億円を超える水準となったが、2022 年度は従来目標としている 400 億円を目指す計画だ。
このオートインジェクター製剤がテリボン®製品の競争力の維持にどれだけ貢献するのかについては、今後のジェネリックメーカーの動きやテリボン®のこれからの売上推移をさらに注視していく必要があるだろう。
(3)沢井製薬との係争は高純度PTH凍結乾燥製剤発明に係る特許権へ
本事件における特許第6522715号についての有効審決を取消す知財高裁判決が言い渡される4カ月前、2022年2月15日、沢井製薬は、他のジェネリックメーカーに先駆けて、「テリボン®皮下注用56.5μg」のジェネリックである「テリパラチド皮下注用56.5μg『サワイ』」の製造販売承認を取得し、同製品は6月17日に薬価基準収載された(現時点で未発売)。
- 沢井製薬 press release: 2022.02.15 「ジェネリック医薬品7成分14品目の製造販売承認を取得」
2019年2月に、旭化成シンメッドが「テリボン®皮下注用56.5μg」のオーソライズド・ジェネリック(AG)の承認を得ているが(薬価未収載)、AG以外でのジェネリックの承認は、沢井製薬が単独一番手となった。
「テリボン®皮下注用56.5μg」は旭化成ファーマの主力品である。そのジェネリックの市場参入は、その売上に極めて大きなインパクトを与えることになると考えられる。
沢井製薬のジェネリック「テリパラチド皮下注用56.5μg『サワイ』」の製造販売承認取得を受けて、旭化成ファーマは、旭化成ファーマの「テリボン®皮下注用56.5μg」に関する特許権(特許第6025881号)に基づき、沢井製薬の「テリパラチド皮下注用56.5μg『サワイ』」の製造販売の差止等を求めて、2022年4月21日付で、沢井製薬に対して大阪地方裁判所に特許権侵害訴訟を提起している(プレスリリース(2022年4月28日))。
- 参考: 2022.04.29記事「テリボン®皮下注用56.5μgに関する特許権侵害訴訟の提起について」
特許第6025881号は、高純度PTH含有凍結乾燥製剤およびその製造方法に関するもので、本事件で争われたPTH週1回投与に関する医薬用途特許ファミリーとは異なる。
5.おわりに
「テリボン®」のジェネリック参入に対抗する旭化成ファーマとジェネリックメーカーとの特許的攻防は、上記の高純度PTH含有凍結乾燥剤特許を巡る戦いへと移る。
旭化成ファーマは、「テリボン®」のパテントクリフという断崖絶壁ギリギリのところで、残る特許障壁の活用だけでなくオートインジェクター製剤への早期シフトも含め、押し寄せるジェネリックの荒波に耐え、押し返すことができるだろうか。


コメント