*Case2017
*Case2017 2017.10.13 「アーシャ ニュートリション サイエンシーズ v. 特許庁長官」 知財高裁平成28年(行ケ)10216
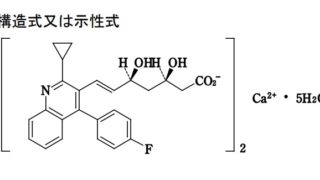
医薬の用途発明の実施可能要件: 知財高裁平成28年(行ケ)10216【背景】「脂質含有組成物およびその使用方法」に関する特許出願(特願2011-506377; WO2009/131939; 特表2011-518223)の拒絶審決(不服2014-8788)取消訴訟。サポート要件及び実施可能要件を満たしていないことが審決の理由。本願発明:「対象における,更年期,加齢,筋骨格障害,気分変動,認知機能低下...