Summary
骨粗鬆症治療剤エディロール®カプセルの有効成分エルデカルシトールの結晶特許に係る延長された特許権を保有する中外製薬が、被告ら(沢井製薬、日医工、日産化学)がその後発医薬品を製造・販売するために本件発明に係る結晶を製造・使用している行為は侵害に当たると主張して、その差止・廃棄を求めた事件。
日産化学が納品するエルデカルシトールは溶液の状態になっており、エルデカルシトールは結晶状態で存在していないことから、日産化学がエルデカルシトールの原薬を製造する過程で本件発明に係る結晶を製造しているか否かが問題となった。
裁判所(東京地裁・民事第46部)は、
- 日産化学が本件発明に係る結晶を直接使用して原薬を製造していることをうかがわせる事情が全くないことを考慮すると、日産化学は、日産化学明細書記載の異なる結晶を用いて原薬を製造しているものと一応推認することが合理的である
- 日産化学が、否認するのみで原薬製造方法の開示を拒んでいるといった事情を考慮しても、本件発明に係る結晶を製造していると認めるに足りる証拠もない
から、日産化学が本件発明に係る結晶を製造しているとは認められないとして、延長された特許権の効力についての争点等について判断するまでもなく、中外製薬の請求を棄却した。
本事件では、侵害の成否には日産化学による原薬の製造方法の開示が重要な証拠となるところ、査証制度は利用されなかった。
裁判所が判断しなかった「延長された特許権の効力についての争点」は、医薬品の承認処分に関してどの発明が延長登録対象となるのか、さらに延長された特許権の効力はどの実施範囲まで及ぶのか、という日本の特許延長制度における基本的な論点につながるものであった。
しかし、中外製薬は控訴を断念したようである。
1.事件の背景
(1)本件訴訟に至るまでの経緯
 2020年2月17日、沢井製薬及び日医工が、骨粗鬆症治療剤(活性型ビタミンD3製剤)エディロール®カプセル(有効成分:エルデカルシトール(eldecalcitol))の後発医薬品(『エルデカルシトールカプセル0.5μg・0.75μg「サワイ」』、『エルデカルシトールカプセル 0.5μg、0.75μg「日医工」』)の製造販売承認をそれぞれ取得し、沢井製薬及び日医工が、当該後発医薬品の販売を開始した。
2020年2月17日、沢井製薬及び日医工が、骨粗鬆症治療剤(活性型ビタミンD3製剤)エディロール®カプセル(有効成分:エルデカルシトール(eldecalcitol))の後発医薬品(『エルデカルシトールカプセル0.5μg・0.75μg「サワイ」』、『エルデカルシトールカプセル 0.5μg、0.75μg「日医工」』)の製造販売承認をそれぞれ取得し、沢井製薬及び日医工が、当該後発医薬品の販売を開始した。
これを受け、2020年11月27日、中外製薬は、当該後発医薬品に関し、中外製薬が保有する発明の名称を「ビタミンD誘導体結晶およびその製造方法」とする特許(第3429432号)に基づいて、日産化学に対し、後発医薬品のエルデカルシトール原薬の原料の生産及び使用の差止め並びにその廃棄を求めるとともに、日産化学、沢井製薬及び日医工に対し、損害賠償を求めて、東京地裁に特許権侵害訴訟を提起、また、日産化学に対しては、同時に、特許権侵害差止仮処分の申立てを行った(2020.11.27 記事「中外 エディロール特許侵害で日産化学・沢井・日医工を提訴」)。
しかし、2021年1月15日、中外製薬は、これら訴訟(令和2年(ワ)第30047号特許権侵害差止等請求事件、令和2年(ヨ)第22123号特許権侵害差止仮処分命令申立事件)を、「訴訟戦略上の理由」により、取下げた。
中外製薬が訴訟を取下げた理由として、本件特許発明に係る特許権の侵害の立証ができなかったことが可能性のひとつとして考えられた(2021.01.27 記事「中外製薬 エルデカルシトールに関する特許権侵害訴訟を取下げへ」)。
ところが、上記訴訟取下げからわずか1か月後の2021年2月17日、中外製薬は、上記3社に対して、東京地裁に再度訴訟提起をするに至った。
中外製薬が一旦取下げた訴訟を再提起したということや、中外製薬のプレスリリースに記された以下の内容:
の記載ぶりから、上記3社が本件特許発明に係る結晶を生産及び使用していると認識し得る証拠を中外製薬が得るに至ったことを意味していると考えられた(2021.02.17 記事「中外製薬 エディロール®カプセル(エルデカルシトール)に関する特許権侵害訴訟を再提起」)。

本事件(東京地裁令和3年(ワ)3816)は、本件特許(第3429432号)に係る特許権者である中外製薬が、沢井製薬及び日医工がそれぞれ日産化学に製造を委託した当該後発医薬品の原薬を日産化学が製造する過程で、特許発明の技術的範囲に属する結晶を製造しているとして、上記3社に対して、当該結晶の製造及び使用の差止め、廃棄、並びに損害賠償を求めた特許権侵害差止請求事件である。
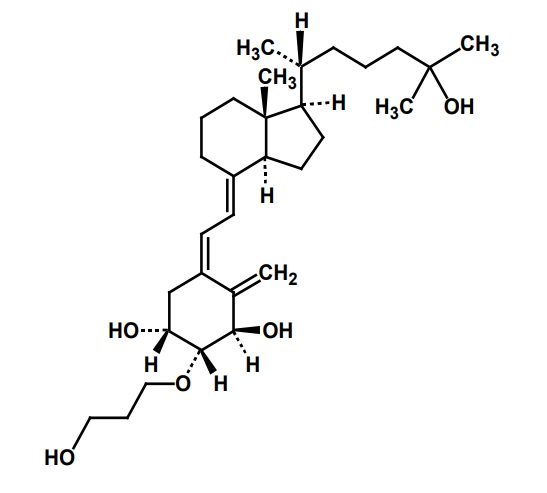
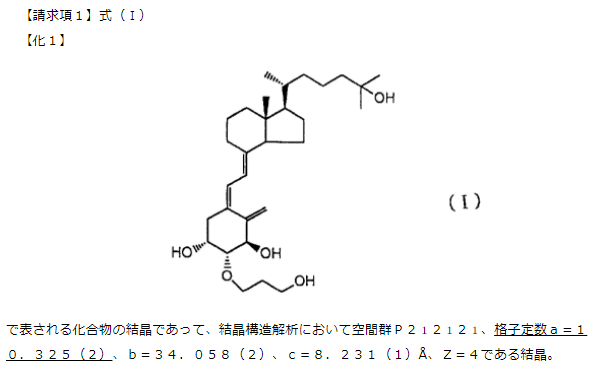
(2)本件特許第3429432号の請求項1
本件特許(第3429432号)の請求項1(訂正2012-390042により訂正):
(3)本事件のポイント
本事件のポイントは、以下のア及びイの2点である。
ア 後発医薬品製造のために日産化学が納品したエルデカルシトールは溶液
日産化学は、溶液の状態になっているエルデカルシトールを日医工に販売、納品し、沢井製薬は、日医工からエルデカルシトールの溶液が充填された軟カプセルの納品を受けている(以下、日産化学が日医工に納品しているエルデカルシトールの原薬※1(溶液の状態になっている)を「本件原薬」という。)
沢井製薬及び日医工は、それぞれ「本件原薬」を原料として被告カプセル(エディロール®カプセルの後発医薬品)を製造、販売している。
被告カプセルの内容物は液体であり、エルデカルシトールは同液体に溶けて存在しており、結晶の状態では存在していない。
なお、中外製薬のエディロール®カプセルも内容物は液体であり、エルデカルシトールは同液体に溶けて存在しており、結晶の状態では存在していない。
そこで、日産化学による「本件原薬」製造過程で本件発明に係る結晶が製造されているか否かが問題となった。
中外製薬は、日産化学の行為が侵害であると主張立証することがきたのか。
※1 判決文における「原薬」または「本件原薬」は、固体であるはずの有効成分エルデカルシトールに、有効成分以外の溶剤を添加することで溶液状態とした混合物を指しているようであり、薬機法下での課長通知で定義されている医薬品の「原薬」の定義と必ずしも同義ではないことに注意が必要である。平成13年11月2日医薬発第1200号厚生労働省医薬局長通知において、「原薬」とは、「医薬品の生産に使用することを目的とする物質又は物質の混合物で、医薬品の製造に使用された時に医薬品の有効成分となるもの。」と定義されている。裁判所、原告、被告らの「原薬」の定義の捉え方も、一致しているかどうかは明らかでない。
イ 延長された特許権に基づく侵害事件であること
本件特許(第3429432号)の存続期間満了日(20年)は2017年6月12日であったところ、2件の延長登録(5年の延長期間)が認められ、延長登録後の特許満了日は2022年6月12日となっていた。
中外製薬が主張するように、仮に、本件発明に係る結晶が「本件原薬」を製造する過程で製造及び使用されている場合に、本件延長された特許権は、「本件原薬」を製造する過程で本件発明に係る結晶を製造・使用する行為に及ぶのか。後発医薬品(被告カプセル)には当該結晶が存在しない。
2.裁判所の判断
裁判所(東京地裁・民事第46部)は、
- 日産化学が本件発明に係る結晶(A型)を直接使用して「本件原薬」を製造していることをうかがわせる事情が全くないことを考慮すると、日産化学は、日産化学明細書記載の結晶(B型又はC型)を用いて「本件原薬」を製造しているものと一応推認することが合理的である
- 日産化学が、否認するのみで製造方法の開示を拒んでいるといった事情等を考慮しても、本件発明に係る結晶を製造していると認めるに足りる証拠もない
から、日産化学が本件発明の技術的範囲に属する結晶を製造しているとは認められないとして、延長された特許権の効力についての争点等について判断するまでもなく、中外製薬の請求を棄却した。
以下に、争点1(日産化学が「本件原薬」を製造する過程で、本件発明の技術的範囲に属する結晶を製造しているか)についての裁判所の判断を一部抜粋する。
(1)日産化学明細書の記載について
「エルデカルシトール・・・の形態としては、非晶質及び本件発明に係る結晶(日産化学明細書で「A型結晶」と呼ばれているもの。)が知られていたが、・・・日産化学明細書※2 記載の発明は、エルデカルシトールの新規な結晶であり、粉末X線解析測定における特徴的なピークにより特定されるB型結晶と呼ばれる結晶(以下「B型結晶」という。)と、XRPD、示差走査熱量測定の特徴的なピーク及び結晶格子定数により特定されるC型結晶と呼ばれる結晶(以下「C型結晶」という。)である。」
※2 日産化学は、本件特許に係る結晶(A型)とは異なるエルデカルシトールの結晶形2種(B型、C型)及びその製造方法に関する特許を出願している(特開2018-30839号)。
(2)日産化学による本件原薬の製造について
「被告日産化学が、本件発明に係る結晶を直接使用して本件原薬を製造していることをうかがわせる事情が全くないことも考慮すると、被告日産化学は、B型結晶又はC型結晶を製造し、これを用いて本件原薬を製造しているものと一応推認することが合理的である。なお、B型結晶及びC型結晶が、いずれも本件発明の技術的範囲に属さないことについては争いがない。」
(3)中外製薬の主張について
「原告は、・・・日産化学明細書に参考合成例2として記載されているエルデカルシトールの製造方法(日産化学明細書【0037】)の方法。以下「参考合成例方法」という。)に基づいてエルデカルシトールを合成して得られた白色固体をXRPDで分析したところ、同固体の主要な成分が本件発明に係る結晶であったと主張し、このことを根拠に、被告日産化学は、B型結晶又はC型結晶を製造するに当たって、本件発明に係る結晶を中間物質として製造していると主張している。
しかし、被告日産化学が、B型結晶又はC型結晶を製造するに当たって、参考合成例方法によってエルデカルシトールを合成し、これを原料にB型結晶又はC型結晶を製造していることを直接裏付ける証拠はない。日産化学明細書の記載によれば、参考合成例方法を用いて合成されたエルデカルシトールを原料にしてB型結晶、C型結晶を製造することができることは認められるものの、参考合成例方法以外の方法で製造したエルデカルシトールでは、B型結晶、C型結晶を製造することができない又は著しくこれが困難であることをうかがわせる事情はない。
・・・そうすると、被告日産化学が、原告が主張する本件原薬の製造方法を否認するのみで、参考合成例原料の製造方法の開示を拒んでいるといった事情等を考慮しても、被告日産化学が本件原薬を製造する過程において、参考合成例原料を製造していると認めるに足りないというべきである。その他、被告日産化学が本件発明の技術的範囲に属する結晶を製造していることを認めるに足りる証拠はない。」
(4)結論
「よって、被告日産化学が本件発明の技術的範囲に属する結晶を製造しているとは認められないため、その余の点について判断するまでもなく、原告の請求にはいずれも理由がないからいずれも棄却することとし、主文のとおり判決する。」
主 文
1 原告の請求をいずれも棄却する。
2 訴訟費用は原告の負担とする。
3.コメント
(1)証拠不十分・・・査証制度は活用せず
日産化学が「本件原薬」を製造する過程で本件発明の技術的範囲に属する結晶を製造しているか否かが争点となった。
中外製薬が訴訟の再提起に踏み切ったことから、侵害の証拠を掴んだか、証拠収集を巡って、文書提出命令の申立て、さらには近年導入された査証制度(2020年10月1日施行)が活用されるかどうかという期待も膨らんだ。
しかし、判決文を見る限り、中外製薬は、「被告日産化学は、本件原薬の合成プロセスを開示するようにとの求釈明に対して、特許法104条の2に違反して応じない。」と主張した程度で、侵害証拠を得るために、文書提出命令の申立てや査証の申立てをした様子はない。
裁判所は、日産化学が本件発明に係る結晶を製造しているとの証拠はないと判断した。
査証は被疑侵害者にとって負担の大きいものであることから、特許権を侵害したことを疑うに足りる相当な理由が、査証の要件の一つとして規定されている(特許法105条の2第1項)。
本件では、この「侵害の蓋然性」を満たせるほどの証拠が結局のところ揃っておらず、中外製薬が査証を申立てたとしても、裁判所が認める可能性は低かったと考えられる。
<参考: 査証制度>
令和元年特許法改正(令和元年5月17日法律第3号)により、査証人による法的拘束力を有する証拠収集手続である査証制度が創設された(特許法105条の2から105条の2の10)。2020年10月1日施行。
制度導入時には、産業界からの意見や議論も深めずに結論ありきの審議と思えるような早急な法案提出に強い批判もあった中(2019.02.08 経団連知的財産委員会企画部会: 「実効的な権利保護に向けた知財紛争処理システムの在り方」(案)への意見; 2019.02.08 日本知的財産協会: 実効的な権利保護に向けた知財紛争処理システムの在り方(案)への意見)、国会答弁で、当時の特許庁長官は、厳格な要件のもと本当に必要な場合に限って発令されるという意味で査証制度は「伝家の宝刀」であるとした。
「査証制度につきましては、四つの厳格な要件を満たした場合に限って発令されることとしておりますけれども、この伝家の宝刀という表現でございますけれども、これは、査証の命令が、これらの厳格な要件のもと、本当に必要な場合に限って発令される特別に強力な手段だということを意味しておりまして、他方で、抜かずの宝刀ということではありません。」
– 第198回通常国会・衆議院経済産業委員会審議(2019年4月12日議事録)より
(2)延長された特許権の効力はどの実施範囲まで及ぶのか
「本件延長登録の効果が、被告日産化学が本件原薬を製造する過程で製造する物質に及ぶか」(争点2)について、裁判所は判断しなかったが、延長された特許権の効力が争点となった貴重なケースであるため、以下に、中外製薬(原告)及び日産化学(被告)の主張の一部を抜粋し、雑感を書き留めておく。
この争点での議論は、延長された特許権の効力はどの実施範囲まで及ぶのか、その裏返しとして、医薬品の承認処分に関してどの発明が延長登録の対象となるのか、という日本の特許延長制度の基本的な論点につながるものである。
ア 中外製薬の主張
「ア 特許権の存続期間の延長登録の制度は、政令処分を受けることが必要であったために特許発明の実施をすることができなかった期間を回復することを目的としているのであるから、政令処分の対象となった物についての特許発明の実施行為とは、政令処分の対象となった物について、政令処分を受けるまで禁止されていた特許発明の実施行為全てを意味すると解するべきである。
・・・医薬品の製造販売承認の審査は、「品質、有効性及び安全性に関する事項」をも対象とし(医薬品医療機器等法14条2項3号柱書)、承認申請書には、原薬の製造方法の記載が求められ、製造方法に関しては出発物質及び中間体も示す必要があり、出発物質の管理基準及び試験法、重要中間体及び最終中間体の管理基準及び管理方法も記載する必要がある。
製造方法欄に記載された事項は、既存の製造販売承認の下では変更することができず、その変更には一部変更承認申請又は軽微変更届出が必要である。そうすると、原告カプセルを製造するための中間物質として本件発明に係る結晶の製造及び使用には、原告カプセルの製造販売承認が必要であり、同製造販売承認によって初めて原告カプセルについての本件発明の実施が解除されたといえる。したがって、本件延長により延長された特許権の効力は、原告カプセル及びそれと実質的に同一の物についての本件発明に係る結晶の製造及び使用に及ぶ。
被告らの主張は、延長された特許権の効力が政令処分対象物そのもの実施行為にしか及ばないことを前提にしているが、特許法68条の2は、「延長された特許権の効力は政令処分対象物「についての」当該特許発明の実施に及ぶ」としており、延長された特許権の効力は、政令処分対象物そのものの実施行為に限定されるものではない。
イ 以上をふまえると、薬事法の製造販売承認の審査において、特許発明に関して「成分、分量、用法、用量、効能及び効果」以外の事項が審査された場合、特許法68条の2の「当該用途に使用される物」の特定には①「成分、分量、用法、用量、効能及び効果」を用いるとの解釈(オキサリラティヌム事件大合議判決参照)及び②上記に加え、特許発明に関して審査された事項を用いるとの解釈があり得る。」
イ 日産化学の主張
「被告日産化学は、本件発明の技術的範囲に属する物を製造していないから、本件延長登録の効力が及ぶ余地はない。
また、延長登録によって効果が及ぶのは、「処分の対象となった物(その処分においてその物の使用される特定の用途が定められている場合にあっては、当該用途に使用されるその物)についての当該特許発明の実施以外の行為には及ばない」のであるから、本件延長登録が効果を及ぼす物は、構成要件A、Bに加えて、次の要件を満たす必要がある。
C 用途が骨粗鬆症であること
D 有効成分がエルデカルシトールであること
E 原告カプセルであること
一方、原告は、参考合成例原料を製造するための中間物質に本件延長の効力が及ぶかを問題にしているところ、中間物質がC、Eを満たさないことは明らかである。
原告は、「当該用途に使用される物の実施」に当たるか否かについて、「使用される」という語を「骨粗鬆症薬の生産に使用される」の意味にすり替えて論じようとしているが、明らかな誤りである。」
ウ 中間物質としての結晶の製造行為に本件延長された特許権の効力は及ぶか
特許法68条の2は、
「・・・存続期間が延長された・・・特許権の効力は、その延長登録の理由となつた第六十七条第四項の政令で定める処分の対象となつた物(その処分においてその物の使用される特定の用途が定められている場合にあつては、当該用途に使用されるその物)についての当該特許発明の実施以外の行為には、及ばない。」
と規定している。
では、エルデカルシトールの一つの形態である本件結晶発明に係る延長された特許権の効力は、被告後発医薬品についての原薬製造過程での当該発明の実施(製造・使用)行為に及ぶのだろうか。
これを肯定したい中外製薬は、
- 政令処分を受けるまで禁止されていた特許発明の実施行為全てを意味すると解するべき
- 承認申請書には、原薬の製造方法の記載が求められ、製造方法に関しては出発物質及び中間体も示す必要があり、それらの管理基準及び管理方法も記載する必要がある
- 中間物質として本件発明に係る結晶の製造及び使用には、原告カプセルの製造販売承認によって初めて原告カプセルについての本件発明の実施が解除されたといえる
- 特許法68条の2は、「延長された特許権の効力は政令処分対象物「についての」当該特許発明の実施に及ぶ」としており、延長された特許権の効力は、政令処分対象物そのものの実施行為に限定されるものではない
などの理由を挙げて、本件延長された特許権の効力は、被告後発医薬品についての原薬製造過程での本件結晶の製造・使用行為に及ぶと主張した。
ところで、延長登録された特許権の効力に関するオキサリプラチン事件知財高裁大合議判決によれば、原薬製造過程における中間物質としての結晶は、各要素によって特定された「物」(医薬品)には該当せず、医薬品としての実質的同一性に直接関わらない審査事項であるから、その製造・使用行為は延長された特許権の効力が及ぶ範囲内であると解釈するには適切でないように考えられる(2017.01.20 「デビオファーム v. 東和薬品」 知財高裁平成28年(ネ)10046)。
「医薬品の承認に必要な審査の対象となる事項は,「名称,成分,分量,用法,用量,効能,効果,副作用その他の品質,有効性及び安全性に関する事項」であり,これらの各要素によって特定された「品目」ごとに承認を受けるものであるから,形式的にはこれらの各要素が「物」及び「用途」を画する基準となる。
もっとも,特許権の存続期間の延長登録の制度趣旨からすると,医薬品としての実質的同一性に直接関わらない審査事項につき相違がある場合にまで,特許権の効力が制限されるのは相当でなく,本件のように医薬品の成分を対象とする物の特許発明について,医薬品としての実質的同一性に直接関わる審査事項は,医薬品の「成分,分量,用法,用量,効能及び効果」である(ベバシズマブ事件最判)ことからすると,これらの範囲で「物」及び「用途」を特定し,延長された特許権の効力範囲を画するのが相当である。」
また、特許法68条の2は、
「・・・存続期間が延長された・・・特許権の効力は、その延長登録の理由となつた第六十七条第四項の政令で定める処分の対象となつた物(その処分においてその物の使用される特定の用途が定められている場合にあつては、当該用途に使用されるその物)についての当該特許発明の実施以外の行為には、及ばない。」
と規定する。
中外製薬は、「についての」の意味について、延長された特許権の効力が政令処分対象物「の承認取得のために必要な記載事項についての」特許発明の実施を意図していると指摘するが、むしろ、政令処分対象物「そのものについての」特許発明の実施を意図していると読む方が素直であるように感じられ、オキサリプラチン事件知財高裁大合議判決も踏まえると、原薬製造過程における「中間物質」である結晶の製造・使用に対してまで本件延長された特許権の効力が及ぶ、という中外製薬の主張には無理があるように思われる。
ところで、被告後発医薬品の医薬品インタビューフォームの「有効成分に関する項目 物理化学的性質」の「外観・性状」の欄には、先発医薬品エディロール®カプセルと同じく、「白色~淡黄色の粉末」と記載されている(融点の記載はない)。
| 中外製薬 | 沢井製薬 | 日医工 | |
|---|---|---|---|
| 有効成分に関する項目 物理化学的性質 (1)外観・性状 | 白色~淡黄色の粉末 | 白色~淡黄色の粉末 | 白色~淡黄色の粉末 |
| (4)融点(分解点)、沸点、凝固点 | 融点:約 132℃ | 該当資料なし | 該当資料なし |
| 製剤に関する項目 (4)製剤の物性 | 無色澄明のわずかに粘稠な液をカプセルに充てんした軟カプセル | 無色澄明のわずかに粘稠な液をカプセルに充てんした軟カプセル | 無色澄明のわずかに粘稠な液をカプセルに充てんした軟カプセル |
このことから、「被告後発医薬品の有効成分として記載されている『白色~淡黄色の粉末』が、本件結晶に該当するのではないか?」と中外製薬が推測し、本件延長された特許権に基づいて侵害訴訟に踏み切ったのも理解はできる。
しかし、中外製薬にとっては残念ながら、被告らが原薬製造に用いたものは本件発明に係る結晶と異なる結晶であるものと一応推定することが合理的であると裁判所に判断されてしまったわけである。
仮に、被告後発医薬品の有効成分として記載されている『白色~淡黄色の粉末』が、本件発明に係る結晶であった場合には、延長された特許権の効力については、「中間物質」の製造・使用に及ぶのか否かというよりも、「原薬」の製造・使用に及ぶのか否か(最終的な医薬品カプセルの内容物は液体であり、結晶は存在しないという特殊事情もある)、という論点に踏みこむことになっただろう。
(3)医薬品の承認処分に関してどの発明が延長登録対象か
ア 中間物質(中間体)の発明は延長登録対象か
特許・実用新案審査基準 第IX部 特許権の存続期間の延長 第2章 医薬品等の特許権の存続期間の延長(特許法第67条第4項)には、以下のとおり、医薬品の製造に使用される中間物質(「中間体」ともいう。)に係る特許権は延長の対象にならないと規定されている。
医薬品類又は農薬の製造に使用される、中間体、触媒及び製造装置に係る特許権は、延長の対象にならない。
中間体、触媒及び製造装置は、いずれも最終製品である医薬品類又は農薬に含まれるものではない。そして、医薬品医療機器等法、農薬取締法は、それぞれ、最終製品である医薬品類の製造販売、最終製品である農薬の製造・輸入を規制するものであって、中間体、触媒及び製造装置を使用する行為自体を規制するものではない。よって、上記のように取り扱う。
しかし、この審査基準を直接裏付ける判決例はなさそうである。
延長登録要件について判示したパシーフ事件知財高裁判決(2009.05.29 「武田薬品 v. 特許庁長官」 知財高裁平成20年(行ケ)10458)は、以下のとおり判示している。
「特許権の存続期間の延長登録の制度は,特許発明を実施する意思及び能力があってもなお,特許発明を実施することができなかった特許権者に対して,「政令で定める処分」を受けることによって禁止が解除されることとなった特許発明の実施行為について,当該「政令で定める処分」を受けるために必要であった期間,特許権の存続期間を延長するという方法を講じることによって,特許発明を実施することができなかった不利益の解消を図った制度であるということができる。
そうとすると,「その特許発明の実施に政令で定める処分を受けることが必要であった」との事実が存在するといえるためには,①「政令で定める処分」を受けたことによって禁止が解除されたこと,及び②「政令で定める処分」によって禁止が解除された当該行為が「その特許発明の実施」に該当する行為(例えば,物の発明にあっては,その物を生産等する行為)に含まれることが前提となり,その両者が成立することが必要であるといえる。」

この判決では、政令で定める処分(医薬品の製造販売承認)によって初めて実施が解除された特許発明が延長登録の対象となることを判示したものであって、原薬の製造過程で使用される「中間物質(中間体)」を延長登録の対象から除外することを具体的に示しているわけではない。
そこで、この「政令で定める処分によって初めて特許発明の実施が解除された」という点が、中外製薬による「本件延長登録の効果が、被告日産化学が本件原薬を製造する過程で製造する物質に及ぶ」との主張内容につながっている。
中間物質(中間体)の特許発明も延長登録の対象になる可能性は残されている・・・のだろうか。
イ 原薬の発明は延長登録対象か
① エディロール®カプセルの結晶特許の例
中外製薬のエディロール®カプセルも内容物は液体であることから、最終製品であるカプセルの中に本件発明に係る結晶は存在しない。
では、中外製薬の本件結晶発明に係る特許権の延長登録はそもそも登録要件を満たすものだったのだろうかという疑問が出てくる。
中外製薬のエディロール®カプセルの医薬品インタビューフォーム(2020年6月改訂(第10版))によると、「有効成分に関する項目 物理化学的性質」の欄に、外観・性状は「白色~淡黄色の粉末」、融点は「約 132℃」と記載されている。
おそらく、本件発明に係る結晶は、この粉末に該当するものであると思われる。
薬機法のもとでは、「原薬」は、「医薬品の生産に使用することを目的とする物質又は物質の混合物で、医薬品の製造に使用された時に医薬品の有効成分となるもの。」(平成13年11月2日医薬発第1200号厚生労働省医薬局長通知)と定義されており、「原薬」の品質や製造に関する事項は承認申請の必須審査項目である。
エディロール®カプセルの審査報告書には、「原薬は、白色~淡黄色の粉末」と記載されており、機構は「原薬」であるエルデカルシトールの品質や製造方法について妥当であると判断した旨が記載されている。
そして、同報告書には、製剤の項において、「申請製剤は、原薬であるエルデカルシトールを 0.5 μg 又は 0.75 μg 含有する軟カプセル剤であり、薬液(原薬、・・・、溶剤)及び剤皮(基剤、可塑剤、・・・)により構成される。」と記載されている。
特許延長制度は、政令処分(医薬品の製造販売承認)を受けることが必要であったために特許発明の実施をすることができなかった期間を回復することを目的とするものであり、本件発明に係る結晶は、エディロール®カプセルの承認のための重要な要素「有効成分」の「原薬」に関するものである。
また、上記審査報告書の内容のとおり、「原薬」も審査されていることは、「原薬」としての本件発明に係る結晶の実施も政令処分を受けることが必要であったために実施することができなかったことを意味し得るだろうから、その実施することができなかった期間を回復することは特許延長制度の趣旨に合致しそうである。
従って、本件発明に係る結晶は、最終的な「医薬品」であるエディロール®カプセル中では液体となって存在しないという特殊事情があるにしても、「原薬」を保護する本件結晶発明に係る特許権は、延長登録要件を満たしていると考えることは可能と考えられる。
J-PlatPatで確認したところ、本件特許(第3429432号)に基づく延長登録(特願2011-700107; 特願2011-700108)についての「政令で定める処分の内容」は以下のとおりである。
薬事法第14条第1項に規定する医薬品に係る同項の承認
(2)処分を特定する番号
承認番号 22300AMX00416000
(3)処分の対象となった物
エディロールカプセル0.5μg(販売名)
エルデカルシトール(有効成分)
(4)処分の対象となった物について特定された用途
骨粗鬆症
薬事法第14条第1項に規定する医薬品に係る同項の承認
(2)処分を特定する番号
承認番号 22300AMX00417000
(3)処分の対象となった物
エディロールカプセル0.75μg(販売名)
エルデカルシトール(有効成分)
(4)処分の対象となった物について特定された用途
骨粗鬆症
本件延長された特許権のように、「原薬」は結晶、しかし、カプセル内は溶液、という医薬品で、結晶に関する特許権が延長された事例があるかどうかをJ-PlatPatで調べたが、本件特許(第3429432号)以外に見つけることはできなかった(検索キーワード=延長登録出願情報「カプセル」x請求の範囲「晶 X線」、結果40件、検索日2022.04.25)。
さて、「原薬」の特許発明は、最終的な「医薬品」中での形態の相違に関わらず延長登録対象になるのだろうか。
② ベルケイド®注射用の物質特許の例
「原薬」が最終的な「医薬品」中では異なる物質となっている例として、抗悪性腫瘍剤ベルケイド®注射用3mgを紹介する。
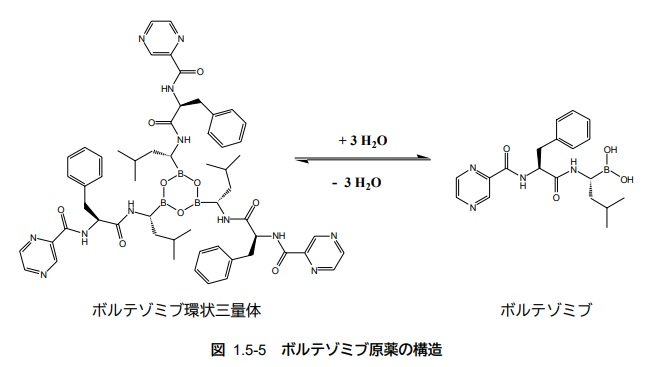
抗悪性腫瘍剤ベルケイド®注射用3mg(一般名: ボルテゾミブ(Bortezomib))の申請資料概要や審査報告書(2006年10月20日)によると、「原薬」であるボルテゾミブは、固体状態では環状三量体無水物構造をとり、水に溶解すると加水分解してボロン酸型のボルテゾミブになる。
最終的な「医薬品」であるベルケイド®注射用3mgは、「原薬」であるボルテゾミブをマンニトールエステルとすることにより室温における安定性の向上を図った凍結乾燥注射剤であり、「医薬品」中では固体状態のボルテゾミブのマンニトールエステルとして存在し、用時、生理食塩液で溶解することにより効能効果を生ぜしめる活性本体のボルテゾミブとなる。
さて、延長登録の対象として、最終的な「医薬品」であるベルケイド®注射用3mgに存在するボルテゾミブ マンニトールエステルの物質発明が重要だろうか、それとも「医薬品」中に存在しない「原薬」であるボルテゾミブの物質発明が重要だろうか。
ベルケイド®注射用3mgの承認に基づいて延長登録の対象となった特許第3717934号について、興味深い点は、ボルテゾミブ等のボロン酸化合物のクレームだけでなく、それらのボロン酸エステルもクレームしていることである(マンニトールエステルの記載はない)。
このクレーム構成により、「医薬品」中に存在するボルテゾミブ マンニトールエステルもクレームで保護することとなり、「原薬」及び「医薬品」の両観点で延長登録対象を満たすクレーム構成となっていることがうかがえる。
実際の延長登録出願の審査で、特許庁はどちらのクレームを延長登録の対象として認定したのだろうか。
参考:
- ボロン酸(ボルテゾミブ)又はボロン酸エステルに関する特許第3717934号・・・ベルケイド®注射用3mgの各承認に基づいて延長登録の対象となった(特願2007-700012; 特願2011-700282; 特願2013-700031)。
- 凍結乾燥粉末の形態のボルテゾミブ マンニトールエステルに関する特許第4162491号・・・2008年8月1日に登録されたため、最初の承認(2006.10.20)では延長登録出願はできなかったわけだが、その後の効能効果追加承認においても延長登録出願はされなかった。
- 2020.07.02 「アメリカ合衆国 v. 高田製薬」 知財高裁平成30年(行ケ)10158 (A事件); 10113 (B事件)
上記例のような、最終的な「医薬品」中に存在する物質(形態)と「原薬」としての有効成分としての物質(形態)が異なる場合に、特許権の延長登録可能性に懸念を抱く特許権者は、最終的な「医薬品」への権利行使も志向して、「医薬品」中に存在する物質(形態)そのものの発明での権利化もしておくことはもちろん、「原薬」としての物質(形態)の発明に係る特許に、その物質(形態)そのもののクレームだけなく、「医薬品を製造するための当該物質(形態)の使用」といった所謂スイスタイプクレームや「その物質(形態)を用いて医薬品を製造する方法」といった製造方法クレーム等を加えておくことを検討するのも一案かもしれない。
ウ 用時調製前後で異なることになる発明は延長登録対象か
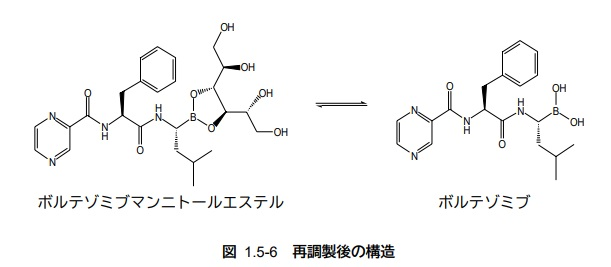
前記のベルケイド®注射用3mgの例では、「医薬品」中で凍結乾燥粉末形態のボルテゾミブ マンニトールエステルは、用時、生理食塩液で溶解することにより活性本体のボルテゾミブとなることを踏まえると、「用時調製後」に生じる物質の発明に係る特許権が延長登録の対象として認められたと理解することもできるかもしれない。
ベルケイド®注射用3mgは、生理食塩液で溶解して使用、溶解後は8時間以内に使用することとされているため、この「用時調製」(加水分解)によりボルテゾミブ マンニトールエステルからボルテゾミブを製造する行為は、当該医薬品の販売業者の手を離れ、医療現場で実施される行為となる。
さて、ボルテゾミブのように、「用時調製後に生じる物質」の発明は、「医薬品」中では異なる物質(形態)であっても延長登録対象になるのだろうか。
逆に、ボルテゾミブ マンニトールエステルのように、用時調製前の「医薬品」中に存在している発明は、用時調製後(患者に投与されるとき)に存在しなくなる発明だとしても延長登録対象になるのだろうか。
① 用時調製後に生じる発明の例
 カンサイダス®点滴静注用50mg/70mg(一般名:カスポファンギン酢酸塩(Caspofungin Acetate))は、点滴静脈内注射用抗真菌薬であり、凍結乾燥前のpHを最適化した凍結乾燥製剤である。
カンサイダス®点滴静注用50mg/70mg(一般名:カスポファンギン酢酸塩(Caspofungin Acetate))は、点滴静脈内注射用抗真菌薬であり、凍結乾燥前のpHを最適化した凍結乾燥製剤である。
カンサイダス®点滴静注用50mg/70mgについて、医薬組成物の発明に関する特許第3258672号に係る特許権は延長登録され(特願2012-700042; 特願2012-700043; 特願2015-700023; 特願2015-700024、いずれも5年の延長期間)、2022年4月15日に満了日を迎えた。
特許第3258672号について興味深い点は、2012年4月16日に最初の延長登録出願がされた時点での特許請求の範囲は、一見すると「用時調製後」の溶液となった組成物の発明を保護するように解釈される記載となっていたが、2013年5月8日に訂正審判が請求され、誤記又は誤訳の訂正を目的とするものであるとして、特許請求の範囲の記載等における「酢酸緩衝液」は「酢酸緩衝剤」と訂正されたことにより(審決日: 同年6月11日)、「用時調製前」の固体状態の組成物の発明を保護するものとなり、その後、延長登録された(登録日: 同年9月25日)という経緯である。
この延長登録出願の審査において、特許庁が、訂正前の特許発明は「医薬品」としてのカンサイダス®点滴静注用50mg/70mgを保護していないと判断して、拒絶理由通知を発したかどうかは定かではない。
しかし、特許権者が、「用時調製後」に生じる発明(溶液の組成物)を保護する発明では延長登録の対象とならないと懸念して、この訂正が行われたことは容易に想像できる。
「医薬品」中では存在しないが「用時調製後」に生じる発明は、延長登録の対象とはなり得ないのだろうか。
配合剤ではなく、医療現場で複数の有効成分が併用される医薬品の組合せ(組合せ医薬)についての発明は、「医薬品」中では共に存在しないが、患者に投与されるときに初めて実施される「物」の発明という点で、上記議論における「用時調製後」に生じる発明と類似しており、そのような組合せ医薬発明に係る特許権の延長登録の存在は、「用時調製後」に生じる発明が延長登録の対象になり得ることを肯定するかもしれない。
2 型糖尿病治療剤アクトス®(一般名: ピオグリタゾン塩酸塩(Pioglitazone Hydrochloride))について、「ピオグリタゾンとα-グルコシダーゼ阻害剤とを組み合わせてなる医薬」に関する特許権(特許第3148973号)や「ピオグリタゾンとビグアナイド剤とを組み合わせてなる医薬」に関する特許権(特許第3973280号)は、それぞれ延長登録された(特願2002-700098; 特願2002-700099; 特願2009-700021; 特願2009-700022)。
 これら発明は、2つの有効成分を組み合わせてなる医薬の発明であるが、政令で定める処分(医薬品の製造販売承認)の対象であるアクトス®の製剤中にはピオグリタゾン塩酸塩の組み合わせ相手も配合されているわけではない。
これら発明は、2つの有効成分を組み合わせてなる医薬の発明であるが、政令で定める処分(医薬品の製造販売承認)の対象であるアクトス®の製剤中にはピオグリタゾン塩酸塩の組み合わせ相手も配合されているわけではない。
医師の処方、薬剤師から患者への受け渡し、患者自身が服用するときに2剤を組合せるという発明の実施行為が発生する。
「組み合わせ医薬」という物の発明に関する特許権の効力については以下の判決において指摘されたとおり、その効力が及ぶ実施範囲についての論点が存在する。
参考:

② 用時調製後(患者に投与されるとき)に存在しなくなる発明の例
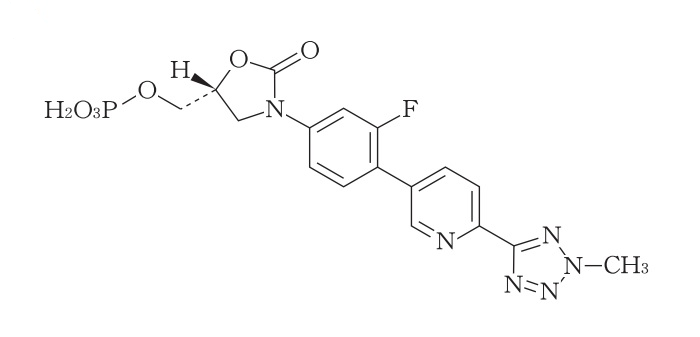
シベクトロ®点滴静注用200mg(一般名:テジゾリドリン酸エステル(Tedizolid Phosphate))は、抗メチシリン耐性黄色ブドウ球菌(MRSA)薬であり、1バイアル中にテジゾリドリン酸エステル 200mgを含有する用時溶解凍結乾燥注射剤である。
テジゾリドリン酸エステルの結晶の発明(特許第5584705号)は、「医薬品」としてのシベクトロ®点滴静注用200mgの凍結乾燥粉末中には存在するが、用時調製後には液体となって存在しなくなる、すなわち患者に投与されるときには存在しない発明であるが、延長登録の対象として認められている(特願2018-700174)。3年7月25日の延長期間が認められ、存続期間満了日は2033年9月28日である。
政令で定める処分(医薬品の製造販売承認)の対象が「医薬品」であることを踏まえると、「医薬品」中に存在している発明は、延長登録の対象として認められると考えるのは自然である。
用時調製後(患者に投与されるとき)に存在しなくなる発明だとしても、「医薬品」中に存在している発明は、延長登録対象として認めるというのが実務としても定着していると思われる。
ところで、テジゾリドリン酸エステルは、オキサゾリジン系抗菌活性を持つテジゾリドをリン酸エステルとすることによって溶解性を向上させたプロドラッグであり、速やかに体内で活性本体であるテジゾリドに変換される。「活性本体」の物質の発明は、プロドラッグ「医薬品」についての延長登録対象とはなり得ないのだろうか(後述)。
エ 効能効果を生ぜしめる物質の発明は延長登録対象か
医薬品の「有効成分」の発明に係る特許権が延長登録対象であることについて疑いはないだろう。
では、前記ベルケイド®注射用3mgの例のように、「医薬品」中に「効能効果を生ぜしめる物質」としてのボルテゾミブそのものが存在しない場合や、シベクトロ®点滴静注用200mgの例のように、「医薬品」中に「活性本体」としてのテジゾリドそのものが存在しない場合、「効能効果を生ぜしめる物質(活性本体)」の発明は延長登録対象となり得るのかについて、どう考えればよいのだろうか。
「医薬品」中に存在しない「効能効果を生ぜしめる物質」又は「活性本体」の発明は、延長登録対象として認められないのだろうか。
「効能効果を生ぜしめる物質」又は「活性本体」が延長登録の対象となるかどうかについて、参考となる判決例が、延長登録において有効成分の意義を判示したナルフラフィン事件知財高裁判決(2021.03.25 「東レ v. 特許庁長官」 知財高裁令和2年(行ケ)10063)である。
レミッチ®OD錠2.5μg(一般名: ナルフラフィン塩酸塩(Nalfurafine Hydrochloride))は、そう痒症改善剤であり、 1錠中ナルフラフィン塩酸塩 2.5μgを含有する口腔内崩壊錠である。
当該事件で、知財高裁は、処分の対象となった医薬品の有効成分は、①本件医薬品の効能効果を生ぜしめる成分と②医薬品に配合されているその原薬、の双方であると認めるのが相当であると判示している。
「特許権の存続期間の延長登録の制度は,政令処分を受けることが必要であったために特許発明の実施をすることができなかった期間を回復することを目的とするものであるから,本件発明の実施に本件処分を受けることが必要であったかどうかは,このような特許法の存続期間延長の制度が設けられている趣旨に照らして判断されるべきであり,その場合における本件処分の内容の認定についても,このような観点から実質的に判断されるべきであって,本件承認書の「有効成分」の記載内容のみから形式的に判断すべきではない。このように解することは,最高裁平成26年(行ヒ)第356号同27年11月17日第三小法廷判決・民集69巻7号1912頁の趣旨にも沿うものということができる。
・・・
本件処分の対象となった本件医薬品の有効成分は,本件承認書に記載された「ナルフラフィン塩酸塩」と形式的に決するのではなく,実質的には,本件医薬品の承認審査において,効能,効果を生ぜしめる成分として着目されていたフリー体の「ナルフラフィン」と,本件医薬品に配合されている,その原薬形態の「ナルフラフィン塩酸塩」の双方であると認めるのが相当である。」
この事件は個別事情もあり一般化できない部分があるかもしれないが、この判決の考え方に沿えば、上述のベルケイド®注射用3mg及びシベクトロ®点滴静注用200mgの例についても、それぞれ以下のように解釈される可能性があるのではないだろうか。
- ベルケイド®注射用3mgの例について、①「効能効果を生ぜしめる」ボルテゾミブの物質発明も、②「医薬品」中に配合されているボルテゾミブマンニトールエステルの物質発明も、双方とも、延長登録対象になる。
- シベクトロ®点滴静注用200mgの例について、①「活性本体」であるテジゾリドの物質発明も、②「医薬品」中に配合されているテジゾリドリン酸エステルの物質発明も、双方とも、延長登録対象になる。
「効能効果を生ぜしめる」物質の発明が延長登録の対象になるのであれば、それ自身には活性がなく生体内で活性本体に変換して初めて薬効を示すプロドラッグの承認についても、活性本体の発明は延長登録の対象となる、さらには活性代謝物の発明も・・・。そして、生体内での化学変化という現象に対して権利行使可能となるのか(誰が?発明を実施?)・・・などと考えてしまうのは行き過ぎた議論であろうか。
オ 医薬品の承認処分に関してどの発明が延長登録対象か
本事件の事情と中外製薬の主張を起点として、医薬品の承認に関するどの発明が延長登録対象になるのかについて、他の医薬品の例を取り上げながら述べてきた。
以下のような有効成分が辿る態様の変化において、「原薬」以降は「有効成分」として捉えることが可能な場合があり、上述のとおり、有効成分に関する発明についての延長登録の対象は、「医薬品」を軸としているが、「医薬品」中に存在している発明でなければ認められないというわけでもない。
有効成分に関する発明についての延長登録の対象に関しては、実質的には、「原薬」の態様、「医薬品」中での態様、「用時調製後」の態様、または「生体内で効果を発揮する」態様が、有効成分として捉えることのできる発明であるか否かを検討して、延長登録の適否を判断しているのが数少ない過去の判決又は特許庁の運用であると思われる。
医薬品の承認に関して、中間物質(中間体)からプロドラッグの活性本体までの有効成分の態様変化の中で、どの発明が延長登録対象となるのか、については依然として不透明な部分が残されており、その不透明さが、延長された特許権の効力が及ぶ範囲もさらに不透明にさせ、日本の特許延長制度の法的安定性と予測可能性を害することになっているのかもしれない。
(4)中外製薬は控訴を断念
前記のとおり新たに導入された査証制度が活用されるのではとの期待が膨らんだが・・・
中外製薬の先発医薬品カプセル内では結晶は存在しなかったという事情は延長登録要件に対する疑義も潜在的には孕んでおり、前述のとおり、延長された特許権の効力についての判断も、中外製薬にとっては厳しいことが予想されること、また、被告から証拠を得ることができず、特許発明とは異なる他の結晶を実施しているとの一応の推認も働いていたことを踏まえると、これ以上、証拠収集を追求しても、中外製薬にとって勝訴するには相当なハードルがあったと思われる。
また、査証制度の事例を作ってしまえば、今後の訴訟では、それが査証申立てを認める基準となり、前述のとおり、本制度創設にもともと反対の立場である産業界全体に与えるインパクトは大きい。
中外製薬は、査証を申立てることなしで、入手可能な証拠のみに基づいて主張することによって勝訴を模索する、という訴訟戦略をとったのではないかとも想像できる。
延長された特許存続期間も、6月には満了する。
差止仮処分命令を得るのは難しいことや、原薬の中間物質の製造に対する損害賠償はおそらく高額とはならないことも踏まえれば、現時点をもって、中外製薬が本件の控訴を断念した(らしい)決断は妥当であろう(2022.03.11 日刊薬業: 「エディロール」物質特許訴訟、控訴を断念 中外製薬)。
本件特許(第3429432号)に対しては、日医工・沢井製薬が無効審判を請求(無効2021-800008)しており、2022年3月8日には、「特許第3429432号の請求項1ないし7、請求項12ないし16、請求項19及び請求項20に係る発明についての特許を無効とする。」との審決の予告がなされたところであり、特許自体の有効性もぐらついている。
(5)エディロール®用途特許を巡る攻防
2020年5月29日付の中外製薬のプレスリリース(エディロール®カプセルに関する特許権侵害訴訟の提起について)によると、2020年5月29日、中外製薬は、エディロール®カプセルの後発医薬品の製造販売承認取得者である沢井製薬及び日医工に対し、中外製薬及び大正製薬が保有する用途特許第5969161号を侵害するとして、当該後発医薬品の生産等の差止め、ならびに廃棄を求め、東京地裁に特許権侵害訴訟を提起するとともに、特許権侵害差止仮処分の申し立てを行っている。
沢井製薬及び日医工は、本件用途特許に対して、2019年12月23日に無効審判を請求(無効2019-800112)、無効審決に対する審決取消訴訟が知財高裁に係属している(令和3年(行ケ)10066; 出訴日2021年5月21日) 。
存続期間満了日は2030年4月28日(期間延長なし)。
こちらはまだ決着していない。
参考:
- 2020.05.29 記事「中外 エディロール用途特許侵害で沢井・日医工を提訴」)。
エディロール®カプセルは、2011年1月21日に国内承認され、その国内売上高は2019年には367億円に達した。しかし、2020年度は後発医薬品の市場参入の影響により278億円、そして、2021年度は223億円に減少した。
2021年12月、中外製薬は、東和薬品にオーソライズド・ジェネリックの製造販売を許諾し、東和薬品が厚生労働省より承認を取得、中外製薬が製剤化まで実施し、今後は東和薬品へ供給していくと発表した(2021.12.03 中外製薬 press release: 骨粗鬆症治療剤「エディロール」、東和薬品によるオーソライズド・ジェネリック品の承認取得について; 2021.12.03 東和薬品 press release: エルデカルシトールカプセル0.5μg/0.75μg「トーワ」オーソライズド・ジェネリックの製造販売に関するお知らせ)。
なお、中外製薬は引き続きエディロールを販売していくとしており、2022年度の国内売上高は108億円と予想している(中外製薬2021年12月期通期決算短信補足資料より)。


コメント