Summary
ブリストル・マイヤーズ スクイブ(BMS)が製造販売するスプリセル®錠の有効成分(ダサチニブ)に関する特許発明の延長された特許権について、沢井製薬による後発医薬品の製造等行為にその効力が及ぶか否か争われた特許権侵害訴訟で、2025年5月15日、東京地裁は、スプリセル®錠と沢井製薬の後発医薬品は医薬品として実質的に同一とは認められず、延長された特許権の効力は及ばないと判断した。
本判決は、延長された特許権の効力が及ぶ範囲の判断にあたり、「政令処分に係る医薬品に加えて、医薬品として実質同一なものにも効力が及ぶ」との大前提を一応は掲げたものの、その適用において極めて不十分かつ形式的な検討にとどまり、重大な問題を含む判断である。
1.背景
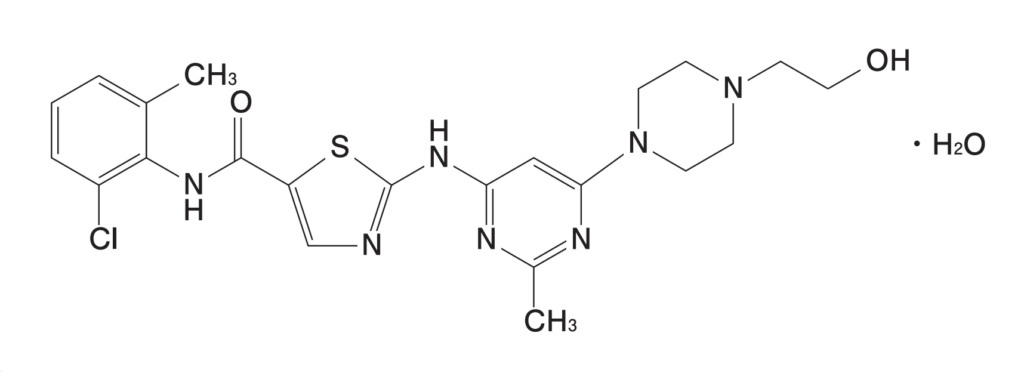 本件本訴(令和5年(ワ)第70527号 消極的確認請求事件)は、「ダサニチブ錠 20mg サワイ」及び「ダサニチブ錠 50mg サワイ」(以下併せて「原告製品」)を製造販売する沢井製薬株式会社(以下「沢井」又は「原告」)が、発明の名称を「環状タンパク質チロシンキナーゼ阻害剤」とする発明に係る特許第3989175号(以下「本件特許」、その特許権を「本件特許権」という)の特許権者であるブリストル-マイヤーズ スクイブ ホールディングス アイルランド アンリミテッド カンパニー(以下「BMS」又は「被告」)に対し、存続期間が延長された本件特許権の効力は、原告による原告製品の生産、譲渡及び譲渡の申出に及ばない旨の確認を主位的に求め、予備的に、被告が本件特許権に基づく差止請求権及び損害賠償請求権をいずれも有しないことの確認を求めた事案である。
本件本訴(令和5年(ワ)第70527号 消極的確認請求事件)は、「ダサニチブ錠 20mg サワイ」及び「ダサニチブ錠 50mg サワイ」(以下併せて「原告製品」)を製造販売する沢井製薬株式会社(以下「沢井」又は「原告」)が、発明の名称を「環状タンパク質チロシンキナーゼ阻害剤」とする発明に係る特許第3989175号(以下「本件特許」、その特許権を「本件特許権」という)の特許権者であるブリストル-マイヤーズ スクイブ ホールディングス アイルランド アンリミテッド カンパニー(以下「BMS」又は「被告」)に対し、存続期間が延長された本件特許権の効力は、原告による原告製品の生産、譲渡及び譲渡の申出に及ばない旨の確認を主位的に求め、予備的に、被告が本件特許権に基づく差止請求権及び損害賠償請求権をいずれも有しないことの確認を求めた事案である。
これに対し、被告が提起した本件反訴(令和6年(ワ)第70016号 損害賠償請求反訴事件)は、原告製品が本件特許の請求項 9 に係る発明(以下「本件発明」)の技術的範囲に属し、延長後の本件特許権の効力は原告製品の生産等に及ぶと主張して、原告に対し、本件特許権侵害の不法行為に基づき、1 億円の損害賠償等を求めたものである。
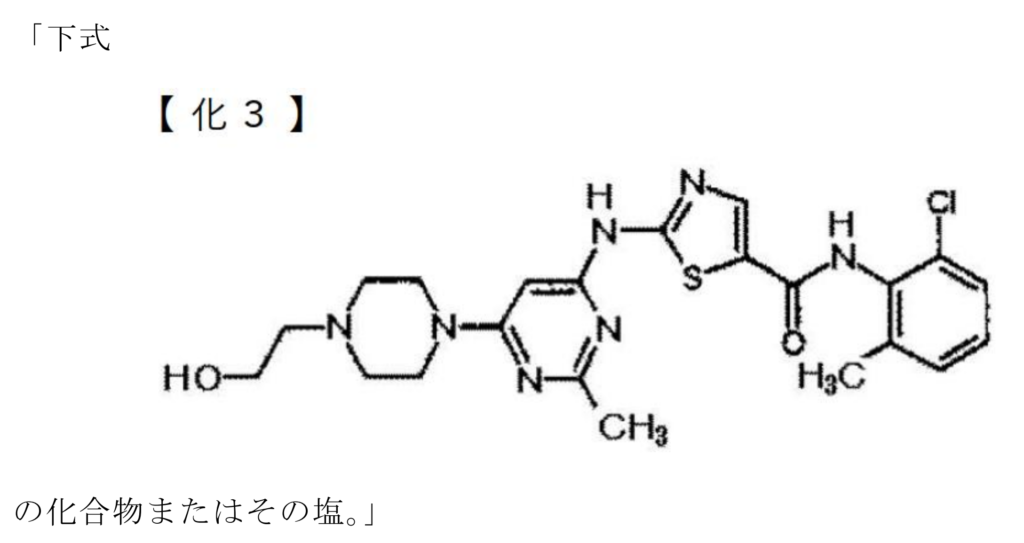
本件発明(請求項9):
原告は、2023年10月4日、被告がダサチニブの製剤として製造販売する「スプリセル®錠 20mg」及び「スプリセル®錠 50mg」(以下併せて「スプリセル錠」)の後発医薬品として、原告製品に関する効能・効果(慢性骨髄性白血病)及び用法・用量の追加承認(以下「本件一変承認」)を取得した。これに伴い、原告製品の添付文書も変更され、本件一変承認により追加された効能・効果及び用法・用量に基づく製造・販売が開始された。
なお、原告製品が本件発明の技術的範囲に属する化合物を含有すること自体は、当事者間に争いがない。
これまでの経緯については、以下のブログ記事を参照されたい。当初は、有効成分の無水物と水和物という原薬形態の違いが主たる争点と見られていたが、実際には、有効成分に係る延長特許権の効力が製剤の異なる後発医薬品に及ぶかどうかという問題が主要な争点であったことが、判決文の公開により明らかとなった。
- 2023.10.17ブログ記事「ブリストル・マイヤーズ スクイブが沢井製薬ダサチニブ錠の効能追加販売に対し特許権侵害の差止仮処分命令申立て」参照。
- 2023.11.29ブログ記事「BMS スプリセル®錠(一般名:ダサチニブ水和物)の後発品を巡る特許権侵害訴訟で東京地裁が沢井製薬のダサチニブ錠の製造販売行為を禁止する仮処分命令を発出 ― 本当の問題点 ―」参照。
- 2025.05.16ブログ記事「沢井製薬、BMSとのダサチニブ特許訴訟で勝訴判決 ― 延長特許権の効力及ばずと東京地裁が判断か?」参照。
2.裁判所の判断
東京地方裁判所民事第47部(以下「裁判所」)は、被告(BMS)による反訴請求について、原告製品は、「成分、分量、用法、用量、効能及び効果」によって特定された「物」たるスプリセル錠と医薬品として実質的に同一とは認められないとして、延長された本件特許権の効力は原告製品の製造等には及ばず、差止請求権及び損害賠償請求権は認められないと判断した。したがって、被告の反訴請求は理由がないから棄却するとして、主文のとおり判決した。
なお、「被告による本件特許権侵害に基づく損害賠償請求権の不存在確認」等を主張する原告(沢井)の本訴請求については、上記反訴請求と訴訟物を同一とするものである等、確認の利益を欠くから不適法であるとして却下した(本稿では紹介しない)。
1 本件本訴に係る訴えをいずれも却下する。
2 本件反訴に係る被告の請求を棄却する。
3 訴訟費用は、本訴反訴を通じ、被告の負担とする。
裁判所は、まず、 「政令で定める処分の対象となった物」に係る特許発明の実施行為の範囲について、以下のように述べた(判決文の一部を抜粋)。
「存続期間が延長された特許権に係る特許発明の効力は、政令処分で定められた「成分、分量、用法、用量、効能及び効果」によって特定された「物」(医薬品)のみならず、これと医薬品として実質同一なものにも及ぶというべきであり、第三者はこれを予期すべきである。」

「のみならず、実質同一なものに及ぶ」という判断基準は大前提ですね。
「したがって、政令処分で定められた上記構成中に対象製品と異なる部分が存する場合であっても、当該部分が僅かな差異又は全体的にみて形式的な差異に過ぎないときは、対象製品は、医薬品として政令処分の対象となった物と実質同一なものに含まれ、存続期間が延長された特許権の効力の及ぶ範囲に属するものと解される。」

ここでいう「実質同一なもの」には、少なくとも「僅かな差異又は全体的にみて形式的な差異に過ぎない」対象製品にも及ぶことになりますね。
「ここで、医薬品の成分を対象とする物の特許発明において、政令処分で定められた「成分」に関する差異、「分量」の数量的差異又は「用法、用量」の数量的差異のいずれか 1 つないし複数があり、他の差異が存在しない場合に限定してみれば、僅かな差異又は全体的にみて形式的な差異かどうかは、特許発明の内容(当該特許発明が、医薬品の有効成分のみを特徴とする発明であるか、医薬品の有効成分の存在を前提として、その安定性ないし剤型等に関する発明であるか、又は、その技術的特徴及び作用効果はどのような内容であるかなどを含む。以下同じ。)に基づき、その内容との関連で、政令処分において定められた「成分、分量、用法、用量、効能及び効果」によって特定された「物」と対象製品との技術的特徴及び作用効果の同一性を比較検討して、当業者の技術的常識を踏まえて判断すべきである。」

ここまでは、オキサリプラティヌム事件(知財高裁大合議)※で示された基準とおおむね一致しています。本判決を検討するうえでカギとなるのは、結論が「特許発明の内容に基づき、その内容との関連で、技術的特徴及び作用効果の同一性を比較検討して判断する」との基準に忠実かどうかです。
※オキサリプラティヌム事件(知財高裁大合議)判決の詳細は、2017.01.22ブログ記事「2017.01.20 「デビオファーム v. 東和薬品」 知財高裁平成28年(ネ)10046」参照。
「上記場合において、対象製品が政令処分で定められた「成分、分量、用法、用量、効能及び効果」によって特定された「物」と医薬品として実質同一なものに含まれる類型の 1 つとして、「医薬品の有効成分のみを特徴とする特許発明に関する延長登録された特許発明において、有効成分ではない「成分」に関し、対象製品が、政令処分申請時における周知・慣用技術に基づき、一部において異なる成分を付加、転換等しているような場合」を挙げることができる。この場合、その差異は上記「僅かな差異又は全体的にみて形式的な差異」に当たり、対象製品は、医薬品として政令処分の対象となった物と実質同一なものに含まれるというべきである。」

この場合は、オキサリプラティヌム事件でも、「実質同一に含まれると推認される」例として言及されていましたね。あの事件は、製剤発明が対象でした。
裁判所は、上記の考え方及び認定事実を踏まえ、原告製品が、政令処分たる本件各処分の対象となった物であるスプリセル錠と実質同一なものとして、存続期間が延長された本件特許権の効力の及ぶ範囲に属するか否かを以下のように検討した。
「本件発明は、専ら医薬品の有効成分となる新規化合物を対象とした発明であり、医薬品の有効成分のみを特徴とする特許発明と理解される。前記のとおり、医薬品の有効成分のみを特徴とする特許発明に関する延長登録された特許発明において、有効成分ではない「成分」に関し、対象製品が、政令処分申請時における周知・慣用技術に基づき、一部において異なる成分を付加、転換等しているような場合、対象製品は、医薬品として政令処分の対象となった物と実質同一なものに含まれると解すべきである。」

「有効成分のみを特徴とする発明」ということは、本来、「有効成分との関連で、技術的特徴及び作用効果の同一性を比較検討して判断する」というアプローチが不可欠なはずです。
「本件における「対象製品」たる原告製品は、政令処分で定められた「成分、分量、用法、用量、効能及び効果」によって特定された「物」であるスプリセル錠との比較において、有効成分ではない「成分」に関し、スプリセル錠が添加剤として PEG400を添加するのに対し、原告製品ではこれを添加しておらず、コーティング剤としてカルナウバロウが添加されている。このような差異について、ダサチニブ水和物を有効成分とするスプリセル錠は、安定性試験でコーティング剤中に生じた分解物の生成を抑えるために PEG を添加したものとみられる。他方、原告製品は、吸湿性や安定性においてダサチニブ水和物に劣るダサチニブ無水物を有効成分とするところ、安定性につき、PEG を含む場合よりも HPC を混合した方が優れることを確認し、PEG を HPC に転換したものとみられる。これに加え、原告は、ダサチニブ無水物はダサチニブ水和物に比して平衡溶解度ないし溶出性が高い性質を有すると考えられるところ、結晶セルロース及び HPC のグレードを検討した結果を踏まえ、スプリセル錠に溶出挙動が近いものを選択したとみられる。さらに、安定性においてダサチニブ無水物がダサチニブ水和物に劣る点については、証拠(甲 18、29)及び弁論の全趣旨によれば、原告製品の酸化チタンの含有量を 20%とし、コーティング剤の厚みを 20mg 錠については素錠の 4.0%w/w、50mg 錠については 3.5%w/w とすると共に、光安定性を高めるために多量の酸化チタンが含まれることなどを原因として錠剤の滑り性が劣ることから、スプリセル錠に含まれない成分であるカルナウバロウを添加したとみられる。
以上のとおり、本件における「対象製品」たる原告製品は、政令処分で定められた「成分、分量、用法、用量、効能及び効果」によって特定された「物」であるスプリセル錠と対比すると、有効成分ではない「成分」である PEG を転換すると共に、カルナウバロウを添加しており、スプリセル錠(ダサチニブ水和物)と原告製品(ダサチニブ無水物)との有効成分の違い等に起因する課題を踏まえ、上記添加剤の付加ないし転換を行っているものとみられる。このような添加剤の付加ないし転換が周知・慣用技術に基づくものと認めるに足りる的確な証拠はなく、むしろ、原告が自己の技術等に基づき、原告製品の溶出挙動をスプリセル錠のそれに近付け、又はスプリセル錠との生物学的同等性を得るために、これらの添加剤の付加ないし転換を行ったことがうかがわれる。
したがって、原告製品は、医薬品としてスプリセル錠と実質同一なものに含まれるということはできない。」

え? ここでその“有効成分との関連での技術的特徴・作用効果の同一性の比較検討”を経ずに、いきなり“周知・慣用技術による付加・転換ではない”から実質同一でない、という結論に飛躍していませんか? 判断枠組みがすり替わってしまっていますよね。
以上のとおり、裁判所は、対象製品である原告製品は、「成分、分量、用法、用量、効能及び効果」によって特定された「物」たるスプリセル錠と医薬品として実質同一であると認めることはできないから、延長された本件特許権の効力が原告製品の製造等に及ぶとはいえないとして、その余の点につき検討するまでもなく、被告は、延長後の本件特許権に基づく差止請求権及び本件特許権侵害の不法行為に基づく損害賠償請求権を有しないと判断した。
3.コメント
本判決は、延長された特許権の効力が及ぶ範囲の判断にあたり、「政令処分に係る医薬品に加えて、医薬品として実質同一なものにも効力が及ぶ」との大前提を一応は掲げたものの、その適用において極めて不十分かつ形式的な検討にとどまり、重大な問題を含む判断である。
本件の特許発明は、「有効成分のみを特徴とする発明」であると裁判所自身が明確に認定している。これは、知財高裁大合議判決(いわゆるオキサリプラティヌム事件)が示した判断枠組みに従えば、「当該特許発明の内容に基づいて、その技術的特徴及び作用効果について、政令処分に係る製品と対象製品とを比較検討し、医薬品として実質的に同一か否かを当業者の技術常識に基づいて判断する」という評価がなされるべき場面である。
ところが本判決は、「有効成分のみを特徴とする発明」に関して、「対象製品が、政令処分申請時における周知・慣用技術に基づき、成分の一部を付加・転換しているような場合」には「実質同一なものに含まれる」とする一例を挙げただけで、その例示に該当しなければ含まれないという限定的・形式的な反対解釈に終始し、それ以外の観点からの実質同一性の検討を事実上放棄している。
加えて、本判決は、
- 原告製品の添加剤の付加や転換が、周知・慣用技術に基づくものと認めるに足りる証拠がないこと
- 原告が自己の技術的知見に基づき、生物学的同等性を得るために添加剤の変更を行ったこと
の2点のみを根拠に、対象製品が政令処分に係る製品と実質的に同一でないと断定している。しかし、これらの点は、まさに「有効成分のみを特徴とする発明」であるという本件特許発明の技術的性質と、そこから導かれる「技術的特徴及び作用効果の同一性」という本質的観点からの検討を避け、一例として示された類型への形式的な当てはめだけで判断を終えてしまっている。
これは、大合議判決があれほど強調した「特許発明の内容に基づいた技術的特徴及び作用効果の同一性の比較検討」の視点を欠いたものであり、延長制度の法目的及びその機能の正確な理解に基づいた判断とは到底いえない。判決文中では確かに「特許発明の内容に基づき、その内容との関連で、技術的特徴及び作用効果の同一性を、当業者の技術的常識に基づいて判断すべき」との一般論が掲げられているが、その実体的適用はなされておらず、口先だけの枠組提示に終わっている。
何度も繰り返すが、本件の特許発明は「有効成分のみを特徴とする発明」である。
本件において、有効成分のみを特徴とする「発明の内容に基づいた技術的特徴及び作用効果」とは、その有効成分たるダサチニブ及びその効能・効果(治療効果)を意味するのであり、それら点について政令処分に係る製品と対象製品(原告製品)とを比較すれば、両者が医薬品として実質的に同一であるとの帰結に至ることは明らかであろう。
日本薬局方において「製剤には,必要に応じて,適切な添加剤を加えることができる.ただし,用いる添加剤はその製剤の投与量において薬理作用を示さず,無害でなければならない.また,添加剤は有効成分の治療効果を妨げるものであってはならない.」と記されているように、「添加剤」 は有効成分の作用効果(治療効果)を妨げるものであってはならない。この前提を踏まえれば、有効成分たるダサチニブ及びその効能・効果(治療効果)についての比較には「添加剤」の差異が入り込む余地はない。
そもそも、添加剤の違いが問題となるのは、製剤技術に特徴を有する発明においてである。本件のように、有効成分そのものを対象とした物質発明においては、特段の製剤上の工夫が延長登録の根拠になっているわけではない以上、「有効成分及びその効能・効果(治療効果)について、政令処分に係る製品と対象製品とを比較検討し、医薬品として実質的に同一か否かを当業者の技術常識に基づいて判断する」ことをせずに製剤的な微差に過度に着目するのは本末転倒である。にもかかわらず、本判決は、実質的に物質特許の延長として評価すべき本件において、製剤発明的な視点を過度に強調し、「同一性」の認定を狭く解釈した点で、法的にも実務的にも妥当性を欠く。
このように、本判決は、裁判所自らが示した判断枠組みを実質的に用いることなく、単一の例示類型に固執し、それ以外の可能性を正面から検討しないという、非常に形式主義的かつ安易な推論によって結論を導いている。これは、技術と法の両面において誤ったメッセージを与えかねないものであり、今後の実務においても大きな混乱を招くおそれがある。
延長登録された特許発明の技術的本質を見極め、その内容に即して実質的な同一性を丁寧に検討するという、オキサリプラティヌム事件が築いた判断の本質に立ち返る必要がある。本判決は、その根本を看過したまま、拙速に結論を導いたものであり、厳しく批判されるべきである。



コメント
原告製品は、吸湿性や安定性の点でダサチニブ水和物に劣る無水物を有効成分として採用していることからすると、本来は課題とならなかった問題を、あえて劣る原薬の選択によって作り出したに過ぎないように見える。本当はそうでないのかもしれないが、あえて課題を作り出したことによって、添加剤等により問題を補い、「製剤上の工夫」があったかのように主張することが可能となるように思える。このように、意図的に劣る原薬を選定し、その不都合を補う工夫を「製剤上の工夫」として認めるのであれば、「製剤上の工夫」は意図的に作出可能なものとなってしまう。結果として、特許権の延長による効力は空洞化し、制度の実効性は失われかねない。
いや、従来技術と比較し劣る課題から比較例を設定し効果があるように見せるのは、先発の特許戦略にもよく見られる。
そこを批判するなら、課題自由設定を許可し課題を重視する現状の全て蒔き直しすべきなのでは。
現状はどんなに低い課題を設定しても良い状況であり、それが技術的思想のゴールなのでそうしたいのだろうと思っている。
なお心の底からそのようなことを許すべきでないとは思っている。また技術思想考慮が弱まっているのはそのような流れがあるのだと認識している。
ご指摘ありがとうございます。
課題の自由設定や、従来技術と比較して劣る課題を出発点としつつ効果を主張するという戦略が、先発側を含め広く用いられているという点、まさにそのとおりだと受け止めています。特許実務上は、発明の課題の自由設定やその記載の工夫が出願人側の裁量に委ねられている現状があり、そこを否定するのであれば、制度全体を蒔き直すべきではないか、というご指摘はごもっともだと思います。
その上で、私が今回問題視しているのは、あくまで延長制度の適用範囲に関する技術的判断のあり方であり、「課題設定の自由」という出発点自体を否定するものではありません。
つまり、本件で私が懸念しているのは・・・
本来であれば課題とならなかった問題を、意図的に不利な選択(劣る原薬)によって「課題化」し、
その課題を補うための製剤的工夫を「差異」として浮かび上がらせ、
その差異によって「実質同一ではない」とする結論を導くという、
いわば、延長効力から逃れるための構成的ロジックが裁判所に容認されてしまった点
にあります。
これは、延長制度の本来の趣旨、すなわち、「承認に要する時間のために失われた独占期間を回復する」ための補償制度であり、その効力が“医薬品として政令処分の対象となった物”と実質的に同一なものにも及ぶべき、という前提からすれば、本末転倒な結果を招きかねません。
ご指摘のとおり、特許法全体の制度として課題設定の自由が広く認められているのは事実ですし、それを全面的に否定することにはなりません。ただ、延長制度においては、「課題設定」ではなく「効力の及ぶ範囲の客観的・技術的判断」こそが本質であり、そこでは「課題の巧拙」や「補った工夫の創意工夫の程度」に基づいて延長効力の有無を左右することは制度趣旨に反すると考えます。
制度の実効性を維持するためには、むしろ裁判所が「製剤的工夫があったかどうか」ではなく、「その製品が先発品と実質同一といえるかどうか」を、有効成分やその効能効果といった本質的要素から判断すべきであるというのが、私の立場です。
その意味で、今回のブログ記事への上記追加のコメント内容は、課題設定の自由という制度全体の話とは一線を画し、「延長効力の範囲認定における実質的判断のあり方」への問いかけと受け止めていただければ幸いです。
より詳細を検討してゆく訴訟手続きにおいて、課題の自由設定と同じ考え方が流用されるまでは自然に思えます。
一方確かに、延長制度の本来の趣旨からいえば本末転倒とは、同感です。製剤工夫も物質特許の延長において考慮するはやりすぎと認識しています。
このような詳細化は、採用すべきでなかった、と思います。
ただ、課題の自由設定のゆきすぎという状況さえなければ、製剤工夫の価値はもう少し低く見積もられ、本来の趣旨をより強く考慮したのかな、と思えています。
本記事のAI(NotebokkLM)によるプレゼンドラフト
https://www.tokkyoteki.com/2025-05-15-r5-wa-70527-r6-wa-70016_sprycel_case