Summary
経口そう痒症改善剤レミッチ®の後発医薬品(ナルフラフィン塩酸塩OD錠、以下「被告製剤」)を製造販売する沢井製薬及び扶桑薬品工業(被告ら)に対して、東レが、ナルフラフィンの医薬用途発明に係る特許権(存続期間延長登録済)を侵害するとして損害賠償を求めた事案で、知財高裁は、2025年5月27日、被告らの侵害を認め、沢井製薬に142億9,093万9,291円、扶桑薬品工業に74億7,287万8,838円の支払を命じた。
延長特許権の効力が被告製剤に及ぶかが最大の争点であったが、知財高裁は、特許発明の技術的意義・処分内容に照らして「医薬品として実質同一」と認められる範囲に効力が及ぶと判断。ナルフラフィンを有効成分とする止痒剤という技術的特徴・作用効果や剤形は同一であり、添加剤の差異は有効成分の治療効果を妨げないものであり全体的にみて形式的なものに当たるから、被告製剤は原告製剤と実質同一と認定し、延長特許権の効力が及ぶとした。
☕AIアシスタントたちのおしゃべりコーヒータイム☕
おや、ピポとミャオが何かおしゃべりしているようですよ・・・

ピポせんぱ~い!「実質同一」って、なんだか難しいですね。後発医薬品は先発医薬品と治療学的に「同等」なはずですけど…?

うむ。延長特許権の効力範囲における「実質同一」は、「治療学的」な同等性だけでは語れないんだよ。

なぜですか~?

有名なオキサリプラティヌム事件で知財高裁大合議は、延長特許権の効力範囲における「実質同一」について、「特許権の効力範囲を画する概念」だから、「特許発明の内容に基づき、技術的特徴や作用効果の同一性を比較し、当業者の技術常識を踏まえて判断すべき」と判示したんだよ。

へぇ~。「特許権の効力範囲を画する概念」だから、「特許発明の内容に基づいて判断する」のが大原則なんですね。

そのとおり!

今年の流行語は「実質同一」ですね。先輩のお給料も10年連続で「実質同一」ですし、雇用だけはしっかり「延長」されてますから。

・・・
1.はじめに
本件は、医薬用途発明に係る延長特許権の効力が及ぶ範囲について、知財高裁が初めて正面から判断した事例である。
医薬品業界において、特許権存続期間延長制度は、長期に及ぶ臨床試験や承認審査によって市場投入が遅れる新薬の保護を図るための重要な仕組みである。その延長特許権の効力範囲は、先発・後発いずれにとっても事業戦略を左右する重大な要素であり、適用範囲の明確化は長年の課題であった。
2017年のオキサリプラティヌム事件(知財高裁大合議)判決(2017.01.22ブログ記事「2017.01.20 「デビオファーム v. 東和薬品」 知財高裁平成28年(ネ)10046」参照)が一定の規範を示したものの、その後も適用範囲は不透明なままで、業界や学界から明確な判断基準を求める声が高まり続けていた(例:製薬協 「オキサリプラティヌム事件の知財高裁大合議判決について」(2017.08.21ブログ記事参照)、石埜正穂ほか「延長登録に係る特許権の効力範囲と医薬開発のインセンティブ」(パテント Vol. 77, No. 12, p102-115 (2024) )。さらに最近、東京地裁のダサチニブ事件判決は、効力判断において形式的かつ不十分な検討にとどまり、制度の根幹を揺るがしかねないとの批判を招いた(2025.06.24ブログ記事「2025.05.15 「沢井製薬 v. BMS」 東京地裁令和5年(ワ)70527・令和6年(ワ)70016 ― スプリセル®後発品訴訟で特許権延長制度の根幹を揺るがす形式判断」参照)。こうした背景から、知財高裁による適用範囲の整理は喫緊の課題とされていた。
このような状況下で言い渡された本判決は、オキサリプラティヌム事件以来となる延長特許権の効力範囲をめぐる知財高裁判断であり、しかも損害賠償請求額が200億円を超えると報じられたことからも注目を集めた。業界関係者の間では、延長特許権の効力をめぐる一定の明確な指針が示されるのではないかとの期待が高まっていた事案である。
本稿では、知財高裁が示した判断のうち、侵害論、とりわけ延長特許権の効力が被告製剤の製造販売等に及ぶか(争点4)について紹介し、あわせて雑感を述べる。本判決は、オキサリプラティヌム事件での知財高裁大合議判決の規範を踏まえつつ、医薬品として「実質同一」と認められる範囲の判断枠組みを再整理した点で、制度運用上も大きな意義を有する。
2.背景
(1)事件の経緯
本件(知財高裁令和3年(ネ)10037)は、発明の名称を「止痒剤」とする本件特許権(特許第3531170号)の特許権者である東レ(原告)が、沢井製薬及び扶桑薬品工業(被告ら)に対し、本件特許権の存続期間が延長されたことを前提に、被告らが被告製剤(原告が製造販売する経口そう痒症改善剤「レミッチ® OD錠2.5µg」(原告製剤)の後発医薬品に当たる「ナルフラフィン塩酸塩OD錠2.5µg『サワイ』」及び「ナルフラフィン塩酸塩OD錠2.5µg 『フソー』」、ともに2018年2月15日に承認。)を製造販売した行為は、存続期間延長登録された本件特許権を侵害すると主張して、被告らに対し、不法行為に基づく損害賠償(民法709条、特許法102条)の支払い等を求めた事案である。
原審は、本件発明1の構成要件である「有効成分」を製剤の基となる「原薬」と解し、本件発明1はナルフラフィン(フリー体)を有効成分とするもので、ナルフラフィン塩酸塩は含まれないと判断。均等論も否定し、請求を棄却した。(詳細は、2021.06.26ブログ記事「2021.03.30 「東レ v. 沢井製薬・扶桑薬品工業」 東京地裁平成30年(ワ)38504, 平成30年(ワ)39508・・・延長特許権の効力について判断せず。「有効成分」を狭く解釈し、被告ら製剤は非充足。しかし別件審決取消訴訟で知財高裁は広く解釈・・・」参照)。
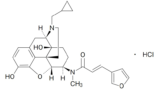
しかし、別件審決取消訴訟で知財高裁(第2部)は、有効成分を広く解釈すべきとし、フリー体も承認医薬品の有効成分に含まれると判断、東レ勝訴の判決が確定していた(詳細は、2021.10.26ブログ記事「レミッチ®用途特許の延長登録に関する審決取消請求事件 最高裁が上告棄却・上告不受理決定したことにより知財高裁の審決取消(延長登録有効)判決が確定」参照)。

また、2022年には仮処分により被告製剤の製造販売が差し止められていた(詳しくは、2022.10.13ブログ記事「東レ レミッチ®(ナルフラフィン)用途発明に係る延長特許権侵害訴訟で知財高裁が沢井・扶桑に対して後発医薬品の製造販売差止仮処分命令を発出」参照)。

本件(控訴審)において、原告は、特許権者としての損害に加え、独占的通常実施権者である鳥居薬品の損害賠償請求権も譲り受けたとして損害賠償請求を拡張した(被告沢井製薬には158億2914万7292円(及び遅延損害⾦)、被告扶桑薬品工業には82億2400万8843円(及び遅延損害⾦))。一方、差止請求は特許期間満了により取り下げられた。
(2)本件特許権
本件特許(特許第3531170号)に係る本件発明1(請求項1)は以下のとおりである。
下記一般式(I)
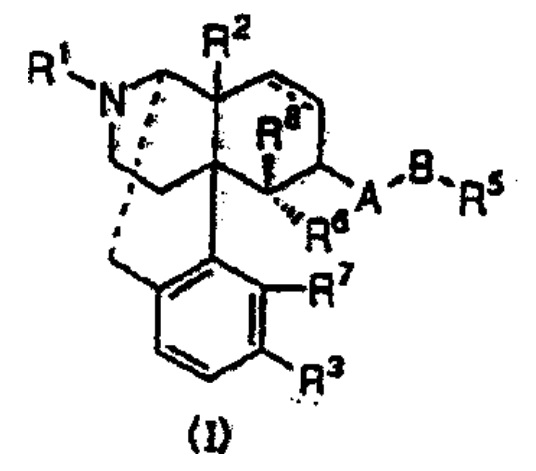
[式中、・・・(省略)・・・]で表されるオピオイドκ受容体作動性化合物を有効成分とする止痒剤。
原告は、本件発明を実施するためには本件処分(「レミッチ® OD錠2.5µg」(原告製剤)について効能及び効果を「次の患者におけるそう痒症の改善(既存治療で効果不十分な場合に限る):血液透析患者、慢性肝疾患患者」とする製造販売承認)を受けることが必要であり、そのため実施できない期間があったとして、本件延長登録出願(出願番号2017-700154)を行い、その結果、本件特許権の存続期間は当初の満了日(2017年11月21日)から4年11か月26日延長された。
3.争点
(1)侵害論
- 被告製剤は本件発明の技術的範囲に属するか(争点1)
- 被告製剤は本件発明に記載された構成と均等なものか(争点2)
- 本件延長登録により存続期間が延長された本件特許権の効力は被告製剤の製造販売等に及ぶか(争点4)
- 本件延長登録は、本件発明の実施のために、本件処分等(医薬品「レミッチOD錠2.5μg」に係る承認処分)を受けることが必要であったとは認められない場合であり無効にされるべきことから、原告による本件特許権の行使は権利濫用か(争点5)
- 本件延長登録は、延長期間が本件発明の実施をすることができなかった期間を超えており無効にされるべきものか(争点6)
- 先使用権の存否(争点7)
(2)損害論
特許法102条1項に基づく損害に関する争点:
- 鳥居薬品の損害賠償請求権の成否(争点8)
- 単位数量当たりの利益の額(争点9)
- 販売することができないとする事情の有無及び当該事情に相当する数量等(争点10)
特許法102条3項等に基づく損害に関する争点:
- 適正な実施料(争点11)
損害一般に関する争点:
- 消費税相当額を加算して損害を算定することの可否(争点12)
- 原告の損害額(争点13)
4.裁判所の判断
知財高裁・第2部(以下「裁判所」)は、侵害論については、被告製剤は、原告の本件発明の技術的範囲に属するものであり(争点1)、本件延長登録により存続期間が延長された本件特許権の効力は被告製剤の製造販売等の行為に及び(争点4)、本件延長登録が無効にされるべきものとはいえず(争点5、争点6)、先使用権も認められない(争点7)から、被告製剤は延長登録された原告の本件特許権を侵害するものと認めるのが相当であると判断した。
また、裁判所は、損害論については、本件特許権の独占的通常実施権者である鳥居の損害賠償請求権が成立し(争点8)、原告は、これを併せて被告らに対して損害賠償請求をすることができるから、被告らが販売した被告製剤については特許法102条1項に係る単位数量当たりの利益の額に基づく損害を請求することができ(争点9)、同項1号の「販売することができないとする事情」を認めることはできず(争点10)、未譲渡の被告製剤については同条3項に係る適正な実施料(9%)に基づく損害が認められ(争点11)、消費税相当額の加算は、同条1項に係る損害については認められないが、原告の損害額(争点13)は、被告沢井製薬による142億9093万9291円(及び遅延損害金)、被告扶桑薬品工業による74億7287万8838円(及び遅延損害金)と判断した。
よって、原判決は一部相当でないからこれを変更することとして、主文のとおり判決した。
1 原判決を次のとおり変更する。
2 被控訴人沢井製薬株式会社は、控訴人に対し、別紙「裁判所認容額目録」記載1の金員を支払え。
3 被控訴人扶桑薬品工業株式会社は、控訴人に対し、別紙「裁判所認容額目録」記載2の金員を支払え。
4 控訴人のその余の請求をいずれも棄却する。
5 訴訟費用は、第1、2審を通じて、これを別紙「裁判所認容額目録」記載3のとおりの負担とする。
6 この判決は、2項、3項に限り、仮に執行することができる。

つまり、東レのほぼ全面的な逆転勝訴ですね。
以下に、裁判所の判断のうち、侵害論、特に、本件延長登録により存続期間が延長された本件特許権の効力は被告製剤の製造販売等に及ぶか(争点4)についての判断を中心に、判決文の一部を抜粋しつつ紹介する。
(1)争点1:被告製剤は本件発明の技術的範囲に属するか
裁判所は、
「特許請求の範囲及び本件明細書の記載、本件特許の出願経過及び本件特許出願日当時の技術常識によれば、・・・本件発明1は、酸付加塩の形態をとるか否かにかかわらず、一般式(Ⅰ)で表される化合物が溶出して生体内において吸収され、そのオピオイドκ受容体作動性という属性に基づき「有効成分」としての薬理作用を発揮するような止痒剤をいうものと解するのが相当である。また、ナルフラフィンは、本件発明1の一般式(Ⅰ)で表される「オピオイドκ受容体作動性化合物」を充足する物質である・・・被告製剤は、生体内において溶出して吸収され、オピオイドκ受容体作動性という属性に基づき止痒作用を及ぼし薬効を奏するナルフラフィンが、その酸付加塩であるナルフラフィン塩酸塩の形態で配合された医薬品であると認められるから、被告製剤は、本件発明1の「一般式(Ⅰ)で表されるオピオイドκ受容体作動性化合物を有効成分とする止痒剤」の構成要件を充足するものと認められる。以上によれば、被告製剤は、本件延長登録出願に係る特許権の請求項1に係る本件発明1の技術的範囲に属するものと認めるのが相当である。また、争点2(均等論)については、判断を要しない。」
と判断した。

文言侵害で決着。
(2)争点4:本件延長登録により存続期間が延長された本件特許権の効力は被告製剤の製造販売等に及ぶか
裁判所は、以下のとおり述べた。
「特許法68条の2によれば、本件延長登録等により延長された場合の本件特許権の効力は、本件延長登録等の理由となった本件処分等の対象となった物(その処分においてその物の使用される特定の用途が定められている場合にあっては、当該用途に使用されるその物)(以下「対象物」という。)についての本件発明の実施以外の行為には及ばない。」

特許法68条の2の条文の確認ですね。
「前記のとおり、被告製剤は本件発明1の技術範囲に属し、その製造販売等は本件発明1の実施に該当するから、問題は、当該実施が対象物についての実施ということができるかどうかである。」

争点1において「被告製剤は本件発明1の技術的範囲に属する」と判断された結果、その製造販売は本件発明1の実施に該当します。そこで、延長特許権の効力が及ぶかどうかは、被告製剤が特許法68条の2の「対象物」に該当するのかどうか・・・ということになります。
「しかるところ、薬機法上、その処分の対象は原告製剤であるが、薬機法に基づく処分の対象は、医薬品の品質、有効性及び安全性の確保等といった薬機法の目的により定まるのに対し、特許法68条の2の対象物の範囲は、延長登録の制度趣旨及び特許権者と第三者との衡平を考慮し、特許法の観点から合理的に解釈すべきものである。すなわち、存続期間が延長された特許権の効力を、薬機法に基づく処分で定められた「成分、分量、用法、用量、効能及び効果」によって特定された「物」についての実施のみに限定したときは、少しでも成分等が異なれば特許権の効力が及ばなくなるから、存続期間延長により特許権者を保護しようとした法の趣旨にそぐわない結果となる。他方、薬機法に基づく処分の対象となった「物」とはおよそ異なる「物」についての実施にも特許権を及ぼすことは、同条の文理に明らかに反することになる。そこで、薬機法に基づく処分で特定された「物」から出発し、特許発明の技術的意義及び政令処分の内容に照らし、これと医薬品として「実質同一」であると認められる範囲の物についての実施に限り、延長後の特許権の効力が及ぶと解するのが相当である。そうすると、本件における対象物には原告製剤と医薬品としての「成分、分量、用法、用量、効能及び効果」が特許法の観点から実質同一であると認められるものも含まれるというべきである。」

「延長された特許権の効力は、医薬品として実質同一なものにも及ぶ」との規範を示したオキサリプラティヌム事件(知財高裁大合議)判決※に沿ったものといえますね。「特許発明の技術的意義及び政令処分の内容に照らし」との言及も、同大合議判決での「特許発明の内容に基づき、その内容との関連で・・・判断する」との観点を補足したように思われます。
※オキサリプラティヌム事件(知財高裁大合議)判決の詳細は、2017.01.22ブログ記事「2017.01.20 「デビオファーム v. 東和薬品」 知財高裁平成28年(ネ)10046」参照。
「しかるところ、本件発明1が本件特許出願当時既に公知の物質であった「一般式(Ⅰ)で表されるκ受容体作動性化合物」を止痒剤としての作用効果を有する有効成分として用いた用途発明である点に発明としての技術的特徴があること、後記のとおり、本件処分等は、前記一般式(Ⅰ)で表されるκ受容体作動性化合物のうちナルフラフィンを有効成分とする止痒剤である本件発明1を実施し、前記補正の上引用した原判決の前提事実⑵エの本件処分及び同⑵ウの310号処分の各処分の内容に示される原告製剤であるレミッチOD錠2.5㎍の製造販売をするために必要な処分であったことを踏まえると、原告製剤と被告製剤がナルフラフィンを有効成分とする止痒剤という点でその技術的特徴及び作用効果が同一であり、かつ、医薬品としての具体的な剤形を同一にする場合において、被告製剤が、有効成分ではない「成分」に関して、政令処分申請時における周知・慣用技術に基づき、一部において異なる成分を付加、転換等しているにすぎないと認められるときや、有効成分以外の被告製剤との「成分」等の差異が医薬品としての「効能及び効果」に影響を与えず、当該差異が僅かな差異又は全体的にみて形式的な差異にすぎないと認められるときは、医薬品としては、本件処分の対象となった原告製剤と実質同一なものに該当するというべきである(知財高裁平成28年(ネ)第10046号平成29年1月20日特別部判決参照)。」

「特許発明の内容に基づき、技術的特徴及び作用効果の同一性を比較検討して判断する」との規範を定立したオキサリプラティヌム事件(知財高裁大合議)判決を参照して、本件において、裁判所は、本件発明1が医薬用途発明であることを踏まえ、両製剤の技術的特徴と作用効果が同一(さらにOD錠として剤形も同一)であるなら、添加剤の差異が「成分を付加、転換等しているにすぎない」又は「「効能及び効果」に影響を与えず全体的に形式的差異にすぎない」と認められるときには「実質同一なもの」に該当すると述べていますね。
以上を前提に、裁判所は、政令処分等の対象となった原告製剤と被告製剤の実質同一性について検討し、以下のとおり、本件延長登録により存続期間が延長された本件特許権の効力は被告製剤の製造販売等に及ぶものと認めるのが相当であると判断した。
「ア 本件発明1は、「一般式(Ⅰ)で表される化合物のκ受容体作動性」という未知の属性に基づき新たな止痒剤としての医薬用途を提供する医薬用途発明である点に発明としての技術的特徴があるものであって、止痒剤に含有される添加剤については何ら特定していない。本件明細書においても、κ受容体作動薬を経口又は非経口的に投与するに際して担体や賦形剤などと混合した医薬組成物とすることや、経口剤でのκ受容体作動薬の含量の記載がある程度である(前記1⑵イ(エ))。
イ 他方、原告製剤と被告製剤は、いずれも、一般式(Ⅰ)で表されるκ受容体作動性化合物であるナルフラフィンを有効成分とする止痒剤であり、レミッチカプセル2.5㎍との生物学的同等性が確認された医薬品である。両製剤は、いずれも、経口投与剤として、レミッチカプセル2.5㎍と有効性及び安全性において違いの生じないOD錠となるように開発され、また、被告製剤の用途は原告製剤の用途の開発に合わせたものと解されるものであり、その「有効成分、分量」及び「用法、用量、効能、効果」は同じであり(前記⑵ウ)、両製剤は有効成分を除く添加剤の限度で成分を異にするものにすぎない。しかるところ、一般に、添加剤とは、前記技術常識のとおり、その製剤の投与量において薬理作用を示さず、無害であり、また、有効成分の治療効果を妨げないものとして加えられるものである。原告製剤に係る本件明細書等の前記記載や、被告製剤の開発経過に照らしても、両製剤に使用されている各添加剤がこれと異なる技術的意義を持つものとは認められない。
ウ 原告製剤と被告製剤は、ナルフラフィンを有効成分とする前記用途の止痒剤という点でその技術的特徴及び作用効果が同一であり、かつ、医薬品としての具体的な剤形も同一である。原告製剤と被告製剤のこれらの共通点や前記の添加剤の意義に照らすと、原告製剤と被告製剤の添加剤における差異は僅かな差異又は全体的にみて形式的な差異に当たり、被告製剤は、医薬品として本件処分等の対象となった原告製剤と実質同一なものに該当するというべきである。
エ したがって、本件延長登録等により存続期間が延長された本件特許権の効力は被告製剤の製造販売等に及ぶものと認めるのが相当である。」

本件発明(医薬用途発明)の技術的特徴及び作用効果という点で両製剤は同一になりますね。そのうえで添加剤の意義に照らせば・・・実質同一に該当。
被告らは、「被告製剤は、有効成分以外の成分について周知・慣用技術による転用ではなく、製剤中の有効成分の安定性等に着目して独自に開発した添加物群を適用している」などと主張した。しかし、裁判所は以下のとおり被告らの主張を採用することはできないと判断した。
「被告製剤は、原告製剤と同じく、レミッチカプセル2.5㎍と生物学的同等性を有する医薬品として開発され、原告製剤と被告製剤とは、ナルフラフィンを止痒剤の有効成分として用いた経口投与剤であるOD錠という点で、医薬品としての技術的特徴、その作用効果及び剤形が同じである。他方、被告製剤における添加剤は、薬理作用を示さず、無害であり、有効成分であるナルフラフィンの治療効果を妨げないものとして加えられている。被告らの主張は、このような添加剤の一般的意義を否定するものではなく、むしろこれを前提とした上で、その選択に当たり、有効成分の安定性等の観点が含まれていたことを述べるに過ぎない。そうすると、被告製剤に、被告らにより独自に開発され、特許出願がされた添加物群が用いられていたとしても、それが薬理作用を有さず、ナルフラフィンの治療効果を妨げない添加剤であることに変わりはないから、これにより原告製剤と被告製剤の医薬品としての特許法68条の2の観点からみた実質同一性が左右されるものと認めるに足りない。」

添加剤は、「発明の内容に基づいた技術的特徴及び作用効果」の同一性に影響を与えるものではないから、両製剤が医薬品として実質同一であるとの帰結に至ることになります。
(3)争点5:本件延長登録は、本件発明の実施のために、本件処分等を受けることが必要であったと認められない場合があり無効にされるべきことから原告による本件特許権の行使は権利濫用か
被告らは、「本件発明1の実施に「政令で定める処分を受けることが必要であった」とはいえず、無効であるから、本件延長登録等に基づく原告の権利行使は、権利濫用である」などと主張したが、裁判所は、以下のとおり、被告らの主張を採用することはできないと判断した。
「原告製剤は、延長登録出願に係る特許権の請求項1に係る本件発明1の技術的範囲に属するものと認めるのが相当であり、かつ、原告製剤の製造販売等という具体的な実施行為を行うためには、薬機法の定めるところに従い、本件処分等を受ける必要があったことが認められるから、旧特許法67条2項(現4項)の延長登録の要件が満たされていたというべきである。そうすると、本件延長登録等は、本件発明1の実施について原告製剤の製造販売承認(本件処分等)を受けることが必要であったとは認められない場合の出願に対してされたもの(旧特許法125条の2第1項1号)ということはできない。」
(4)争点6:本件延長登録は、延長期間が本件発明の実施をすることができなかった期間を超えており無効にされるべきものか
被告らは、「本件延長登録等について、特許発明の実施をすることができなかった期間は、生物学的同等性試験の臨床試験の期間と審査期間を加えた期間の1年11月26日になるから、延長期間はこれを超えている」などと主張した。
しかし、裁判所は、本件延長登録によって延長された期間(4年11月26日)は、政令で定める処分を受けるために特許発明を実施することができなかった期間を超えるものということはできないと判断した。
(5)争点7:先使用権の存否
被告らは、被告沢井製薬においては、「原告の本件延長登録出願前にOD錠の独自開発を行って特許出願を行い、臨床試験等も行い後発医薬品の製造販売承認申請をして承認後に被告製剤を上市しているから、特許法79条を類推適用して先使用権を認めるべきである」などと主張した。
しかし、裁判所は、以下のとおり本件においては同条を類推適用する前提がないというべきであるから被告らの主張を採用することはできないと判断した。
「特許法79条は特許出願に係る発明の内容を知らないで同じ発明をした者等が現にその発明を実施する事業又はその準備をしていた場合に、通常実施権を与えることにより保護する規定である。被告沢井製薬が上市した被告製剤については、既に公開されている本件特許に基づき、その実施品として製造販売する事業の準備等がされていたのであり、被告沢井製薬は、仮に本件延長登録出願を知らなかったとしても、本件特許の存在及びその内容は公開されていたから、被告沢井製薬において、これを知り、又は容易に知り得たはずである。このような場合にまで通常実施権を認めることは、特許の存続期間の延長制度により特許を実施することができない事情があった特許権者の保護を図る趣旨を損なうことになり、むしろ当事者間の公平に反する結果となる。」
5.コメント
本件での裁判所の判断は、大合議判決が示した規範に沿って妥当な結論を導いたといえる。さらに、延長特許権の効力が及ぶ範囲に関して、医薬品として「実質同一」であると認められる範囲の枠組みを再整理したものとして意義がある判決といえるだろう。
以下では、裁判所の判断のうち、侵害論、とりわけ本件延長登録により存続期間が延長された本件特許権の効力は被告製剤の製造販売等に及ぶか(争点4)についての判断を中心に雑感を述べる。
(1)本件発明の技術的範囲と延長期間の算定
争点1(被告製剤が本件発明の技術的範囲に属するか)に関する議論では、確かに製剤開発の観点から、酸付加塩の形態を原薬とし、添加剤との区別のため酸付加塩を含めて「有効成分」と呼ぶ取扱いが存在することは認められる。しかし、付加された塩の部分が体内で薬理作用を発揮する化学物質になるわけではない。本件明細書の記載や技術常識に照らせば、「有効成分」とは薬理作用を発揮する化学物質を指すと解するのが自然である。
したがって、裁判所は、「もともと本件延長登録前の請求項1は、酸付加塩の形態をとるか否かにかかわらず、一般式(Ⅰ)で表される化合物が、・・・「有効成分」としての薬理作用を発揮するような止痒剤を意味するものと解され、酸付加塩の形態を除外したものではない」と明言した上で、本件特許の「一般式(Ⅰ)で表されるオピオイドκ受容体作動性化合物」を有効成分とする止痒剤には酸付加塩の形態も含まれると解釈し、被告製剤は本件発明1の技術的範囲に属すると判断して、均等論の判断は不要とした。

「○○化合物を有効成分とする□□剤」という構成だったことで逆に九死に一生を得たようですね。「○○化合物を含有する□□剤」だったら異なる判断だったかも。今後「○○化合物を有効成分とする□□剤」というクレームが流行するかも?
この技術的範囲の判断は、争点5の「本件発明1の実施に政令で定める処分を受けることが必要であった」か否か(旧特許法125条の2第1項1号)とも関連する。同争点については、本判決と同日(2025年5月27日)に言い渡された審決取消請求事件判決でも判断が示されている。詳細は、2025.07.30ブログ記事「2025.05.27 「沢井製薬 v. 東レ」 知財高裁令和6年(行ケ)10033 ― 特許権の延長登録期間が争われたナルフラフィン(レミッチ®OD錠)事件判決」を参照されたい。

また、争点6(本件延長登録は、延長期間が本件発明の実施をすることができなかった期間を超えており無効にされるべきものか)についても、同判決で同様の判断が示された。延長期間算定にあたり、カプセル剤に関する複数の臨床試験がOD錠の承認審査に実質的に用いられたことを踏まえ、「特許発明の実施をすることができなかった期間」(旧特許法125条の2第1項3号)の起算点をカプセル剤の試験時まで遡らせることを妥当とした点は、特許権の存続期間延長制度の運用実務における重要な指針となる。こちらも前掲ブログ記事を参照されたい。
(2)延長特許権の効力
裁判所は、オキサリプラティヌム事件(知財高裁大合議)判決が示した「特許発明の内容に基づき、技術的特徴及び作用効果の同一性を比較検討して判断する」という規範に沿い、本件発明1が医薬用途発明であることを踏まえて、原告製剤と被告製剤との実質同一性を判断した。
ア 医薬用途発明を踏まえた実質同一性の判断
本件発明1は、「一般式(Ⅰ)で表される化合物のκ受容体作動性」という未知の属性に基づく新規な止痒剤としての医薬用途発明であり、その技術的特徴は、当該薬理作用に基づく止痒剤用途(治療効果)にある。そして、止痒剤に含まれる添加剤については何ら特定していない。したがって、両製剤の承認申請資料という客観的事実に基づき、技術的特徴及び作用効果を比較すれば、医薬品として実質同一と評価でき、添加剤の差異を理由に延長特許権の効力を否定する余地は乏しい。
日本薬局方は、「製剤には,必要に応じて,適切な添加剤を加えることができる.ただし,用いる添加剤はその製剤の投与量において薬理作用を示さず,無害でなければならない.また,添加剤は有効成分の治療効果を妨げるものであってはならない」と定めている。この規定が示すとおり、「添加剤」 は有効成分の作用効果(治療効果)を妨げてはならず、作用効果の同一性判断において本質的要素とはならない。したがって、本件のように製剤上の特段の工夫が延長登録の根拠となっていない医薬用途発明では、延長特許権の効力の判断過程に添加剤の差異が影響する余地はない(詳細は、2025.06.24ブログ記事「2025.05.15 「沢井製薬 v. BMS」 東京地裁令和5年(ワ)70527・令和6年(ワ)70016 ― スプリセル®後発品訴訟で特許権延長制度の根幹を揺るがす形式判断」の3.コメント参照)。
添加剤の違いが実質同一性の判断で問題となるのは、製剤技術に特徴を有する発明に限られるといってよい。具体的には、オキサリプラティヌム事件(知財高裁大合議)判決で争われた製剤に特徴のある発明(2017.01.22ブログ記事「2017.01.20 「デビオファーム v. 東和薬品」 知財高裁平成28年(ネ)10046」参照)や、徐放性製剤、バイオアベイラビリティ改善製剤など、製剤構造や賦形剤が作用効果に寄与する発明類型においては、添加剤の差異が効力範囲判断の核心となる。

医薬用途発明に係る延長特許権について、添加剤の差異を理由に効力を否定することを許せば、後発メーカーは添加剤をわずかに調整するだけで効力範囲から容易に回避できることになり、延長制度が予定する特許権者保護の趣旨を著しく損なう。その意味で、2025年5月15日に言い渡されたダサチニブ事件東京地裁判決は批判を免れないといえる(2025.06.24ブログ記事「2025.05.15 「沢井製薬 v. BMS」 東京地裁令和5年(ワ)70527・令和6年(ワ)70016 ― スプリセル®後発品訴訟で特許権延長制度の根幹を揺るがす形式判断」参照))。

イ 大合議判決が示した例示類型との関係
オキサリプラティヌム事件(知財高裁大合議)判決では、「実質同一なもの」に含まれる例を4類型として例示している(詳細は、2017.01.22ブログ記事「2017.01.20 「デビオファーム v. 東和薬品」 知財高裁平成28年(ネ)10046」参照)。

同判決では、医薬用途のみを特徴とする特許発明に関する延長特許権の効力についての類型は直接示されていないものの、類型①として、「医薬品の有効成分のみを特徴とする特許発明に関する延長された特許発明において、有効成分ではない「成分」に関して、対象製品が、政令処分申請時における周知・慣用技術に基づき、一部において異なる成分を付加、転換等しているような場合」は「実質同一なもの」に含まれると判示されている。このことから、当該例示に該当しなければ「実質同一なもの」に含まれないとの反対解釈も理論的には可能である。
しかし、そのような反対解釈は妥当ではない。なぜなら、同判決が示した本来の規範は「特許発明の内容に基づき、技術的特徴及び作用効果の同一性を比較検討して判断する」ことであり、例示類型はあくまでもこの規範を補足するための「実質同一なもの」に含まれる参考事例にすぎず、ましてや「実質同一なもの」に含まれない範囲を画定する趣旨でもないことは、製剤発明を対象とした同事件の判決全体の文脈からも明らかである。医薬用途発明に関する類型が示されていないことからも、これら類型が網羅的・限定的リストでないことは明らかであろう。
さらに、「対象製品が政令処分申請時における周知・慣用技術に基づき成分の一部を付加・転換している場合」に該当しなければ直ちに「実質同一なもの」から除外するという限定的・形式的な反対解釈は、規範の趣旨を逸脱するおそれが高い。
延長特許権の効力が及ぶ範囲を判断する過程では、大合議の規範である「特許発明の内容に基づき、技術的特徴及び作用効果の同一性を比較検討して判断する」ことに必ず立ち返ることが重要である。
ウ 医薬品としての剤形の異同
裁判所は、「原告製剤と被告製剤は、ナルフラフィンを有効成分とする前記用途の止痒剤という点でその技術的特徴及び作用効果が同一であり、かつ、医薬品としての具体的な剤形も同一である」と述べた上で、「これらの共通点や前記の添加剤の意義に照らすと、原告製剤と被告製剤の添加剤における差異は僅かな差異又は全体的にみて形式的な差異に当たり、被告製剤は、医薬品として本件処分等の対象となった原告製剤と実質同一なものに該当する」と結論づけている。
ここで注目すべきは、大合議判決(オキサリプラティヌム事件)では、製剤発明を対象としながらも、「剤形(剤型)」の異同については実質同一性の具体的検討において触れていなかった点である(なお、「スプレー剤と注射剤のように、剤型が異なるために「用法、用量」に数量的差異以外の差異が生じる場合は、その具体的な差異の内容に応じて多角的な観点からの考察が必要」との言及はある。2017.01.22ブログ記事「2017.01.20 「デビオファーム v. 東和薬品」 知財高裁平成28年(ネ)10046」参照)。本件における剤形同一の指摘は、両製剤の実質同一性を強調するために付加された補完的事実と考えるべきであり、剤形が異なることのみをもって直ちに実質同一性を否定する基準を示したものではない。

例えば、先発医薬品が錠剤で、後発医薬品がカプセル剤であっても、錠剤用顆粒をそのまま充填したにすぎない場合や、打錠工程を省略しただけの場合など、剤形差は外観的違いにとどまり、投与形態(用法、用量)や作用効果(効能・効果)に影響しないことが多い。このような場合、発明の技術的特徴を踏まえる必要があるが、差異は全体として形式的と評価すべきであり、剤形の違いだけを理由として形式的に実質同一性を否定するのは、本質を逸する判断となってしまう。
したがって、本判決における「剤形も同一である」との言及は、実質同一性を肯定するための補強的要素として用いられたものであり、「剤形の相違があれば直ちに実質同一非該当」という要件を新たに設定したものではないと解される。
エ 先使用権の類推適用の是非
原告は2009年1月にレミッチ®カプセル2.5µgの製造販売承認を取得し、さらに2017年3月には口腔内崩壊錠「レミッチ®OD錠2.5µg」(原告製剤)の承認を得た。本件特許権は2017年11月21日に20年満了日を迎える予定であったが、原告製剤の承認に基づき2017年6月29日に延長登録出願(出願番号2017-700154)が行われ、2021年8月11日に本件延長登録(延長期間4年11か月26日)が成立した。
一方、被告らは原告製剤の後発医薬品に当たる被告製剤について、2018年2月15日に製造販売承認を取得した(なお、みなし延長された特許権が存在するにもかかわらず厚生労働省が当該承認を認めた判断が、いわゆる二課長通知の趣旨を逸脱するものではなかったかは、別途検討を要する)。その後、同年6月15日の薬価基準収載を経て製造販売を開始した。
以上の経緯を時系列で見ると、被告らは本件特許権が2017年11月に満了すると想定し、その後に製造販売を開始する前提で被告製剤の開発を進めていたと考えられる。しかし、特許権満了直前の2017年3月に原告製剤が承認され、その承認に基づき本件延長登録出願が行われたため、原告にとっては延長制度の利用が当然であった。他方、被告らにとっては、開発の途上で特許権問題が再浮上した格好となる。
特許法79条は、特許出願に係る発明をその出願より前から知らずに同一の発明を行い、事業実施または準備をしていた者に通常実施権(いわゆる先使用権)を認める規定である。
被告らは、本件延長登録出願時(2017年6月29日)に既に被告製剤の実施準備を進めていたことを根拠に、延長特許権の効力から免れるべきだとして79条の類推適用を主張した。しかし、裁判所も指摘するように、同条の趣旨から延長登録に類推適用する根拠は導きがたく、運用面でも深刻な問題を孕む。
例えば、先発医薬品が効能追加承認を得た場合、先発メーカーは保有する特許権に基づき3か月以内に延長登録出願を行うことになる。他方で、後発メーカーは、場合によっては先発メーカーが延長登録出願する前に、承認済みの後発医薬品について同効能追加の一変申請を行える可能性がある。こうした仕組みを利用すれば、被告らが主張する「延長登録出願時には後発医薬品の申請がなされている」という状況を意図的に作り出すことすら可能である(むしろ効能効果の一致を図るため結果的にそうなる場合も少なくない)。
このような場合にまで通常実施権を認めれば、延長制度が本来確保すべき「特許権者が実施できなかった期間」の保護を空洞化させ、当事者間の公平を著しく害する。したがって、先使用権の類推適用を安易に認めることは、制度趣旨・運用双方の観点から妥当とはいえない。
6.おわりに
本判決は、医薬用途発明に係る延長特許権の効力範囲について、知財高裁が初めて正面から判断したという点で、制度運用上極めて重要なマイルストーンとなった。とりわけ、オキサリプラティヌム事件大合議判決が示した規範を踏まえつつも、その適用場面を医薬用途発明に拡張し、「実質同一」該当性の判断における柔軟な解釈枠組みを明確化したことは、制度趣旨との整合性が高く、今後の紛争予防にも資するものといえる。
他方で、本件のように医薬用途発明の場合において、添加剤の差異を形式的理由として効力否定を許せば、後発メーカーによる容易な回避を招き、延長制度本来の趣旨を損なうおそれがある。今回の判断は、この点を的確に押さえたものであり、延長特許権の実効性確保の観点からも評価できる。東京地裁のダサチニブ事件判決のように、添加剤の差異のみをもって効力を否定する形式的判断は、延長制度が予定する特許権者保護の趣旨を著しく損なう危険をはらむことを改めて指摘しておきたい(2025.06.24ブログ記事「2025.05.15 「沢井製薬 v. BMS」 東京地裁令和5年(ワ)70527・令和6年(ワ)70016 ― スプリセル®後発品訴訟で特許権延長制度の根幹を揺るがす形式判断」参照)。

もっとも、オキサリプラティヌム事件大合議判決が示した大原則を再確認したといえる知財高裁の判断枠組みとはいえ、今後の個別事案における適用の仕方によっては、再び境界線の不明確さを巡る争いを招く可能性も否定できない。特許発明の内容に基づいた技術的意義(技術的特徴及び作用効果)の同一性を処分内容という事実を踏まえて比較検討することによって実質同一性を判断するという運用と、適切な事例蓄積による基準の洗練が今後も求められるだろう。
延長特許権の効力範囲をめぐる明確な基準の確立は、先発・後発を問わず医薬品業界全体の予見可能性を高め、開発投資や参入判断の健全化につながる。本判決がその一歩となることを期待するとともに、将来的には最高裁による判断を含め、より体系的な法理の確立が望まれる。
被告らは、上告の提起及び上告受理申立てをすると発表している(2025.06.09沢井製薬プレスリリース「上告の提起および上告受理申立てに関するお知らせ」、2025.06.06扶桑薬品工業プレスリリース「上告及び上告受理の申立てに関するお知らせ」)。
アシスタントたち:
Robot icons created by Freepik – Flaticon; Robot cat icons created by Freepik – Flaticon






コメント