 2025年11⽉14⽇、厚⽣労働省 医薬局 医薬品審査管理課⻑より「医療⽤後発医薬品及びバイオ後続品の承認審査に際する特許抵触の有無の確認における専⾨委員制度導⼊の試⾏について」と題する通知(医薬薬審発1114第1号)が発出されました。
2025年11⽉14⽇、厚⽣労働省 医薬局 医薬品審査管理課⻑より「医療⽤後発医薬品及びバイオ後続品の承認審査に際する特許抵触の有無の確認における専⾨委員制度導⼊の試⾏について」と題する通知(医薬薬審発1114第1号)が発出されました。
この通知は、医療用後発医薬品およびバイオ後続品の承認審査にあたって、先発医薬品等との「特許抵触」の有無を確認する(いわゆる「パテントリンケージ」。医療用後発医薬品及びバイオ後続品に関する医薬品医療機器等法上の承認審査及び薬価収載に係る医薬品特許の取扱いについて(令和7年10月8日付け医政産情企発1008第1号、医薬薬審発1008第5号、厚生労働省医政局医薬産業振興・医療情報企画課長、医薬局医薬品審査管理課長 連名通知))ために、医薬品特許の専門家から意見を聴取できる「専門委員制度」を試行的に導入する旨を示したものです。
この制度はあくまでも「当面の間の試行的運用」であり、本施行の際には改めて通知するとのことです。
具体的な手続き等については下記のとおり定められています。
1 概要
厚生労働省は、医療用後発医薬品及びバイオ後続品(以下、併せて「後発医薬品等」という。)の承認審査の中で、先発医薬品(先行バイオ医薬品を含む。以下同じ。)と後発医薬品等との特許抵触の有無について確認を行うに当たって、医薬品特許に関する専門家から意見を聴取することが必要と認めるときは、専門委員に意見を聴取することができる制度(以下「専門委員制度」という。)を試行的に設ける。
2 専門委員制度の適用対象品目
専門委員制度の適用対象となる品目は、承認申請中(一部変更承認申請中を含む。以下同じ。)の後発医薬品等のうち、厚生労働省医薬局医薬品審査管理課(以下「医薬品審査管理課」という。)が指定するものとする。
なお、後発医薬品等のうち、医療用後発医薬品とは、先発医薬品と同一の有効成分(結晶形又は水和物/無水物が異なる場合も含む。)を同一量含み、同一経路から投与する医薬品(化学合成医薬品に限り、体外診断用医薬品を除く。)として、また、バイオ後続品とは、先行バイオ医薬品と同等/同質の医薬品として、異なる製造販売業者が製造販売承認申請(一部変更承認申請を含む。)を行っている医薬品をいう。
3 専門委員制度の対象品目として指定された場合の手続
医薬品審査管理課から専門委員への意見照会は、別添の「パテントリンケージにおける専門委員制度の運用指針」に基づき実施することとし、手続については、以下のとおりとする。
(1)医薬品審査管理課は、承認申請中の後発医薬品等を対象品目として指定した場合には、当該後発医薬品等の申請者(以下「後発企業」という。)及び先発医薬品の製造販売業者(以下「先発企業」という。)の双方に対し、その旨の通知を行う。
(2)後発企業及び先発企業は、以下の資料のうち、専門委員への共有について同意するものがあれば、通知を受けた日から 30 営業日以内に、医薬品審査管理課宛てに提出すること。
・承認申請資料(CTD 1.4 等)
・医薬品特許情報報告票
・特許抵触の有無に関する自社又は特許権者の見解をまとめた資料
・特許抵触の有無に関する専門家の意見書又は鑑定書
・判例や学説等の参考文献
・特許庁による判定制度の結果
(3)後発企業及び先発企業は、厚生労働省のウェブサイトにて公開する専門委員候補名簿をもとに、自社と特別の利害関係を有する専門委員候補について医薬品審査管理課に申告すること。その際、別添の4のうちいずれの要件を満たさないのかについても、併せて情報提供すること。
(4)医薬品審査管理課は、専門委員候補名簿の中から、後発企業及び先発企業のいずれとも特別の利害関係がないことが確認された専門委員(通常3名)を選定し、特許抵触の有無に関する意見照会を行う。
(5)医薬品審査管理課から意見照会を受けた専門委員は、医薬品審査管理課から以下に掲げる資料の提供を受けた日から 30 営業日以内を目処に、専門委員間で協議の上で意見書を作成し、医薬品審査管理課宛てに提出する。この間、専門委員は、医薬品審査管理課を介して、後発企業又は先発企業に対する質問又は追加の資料提供の依頼を行うことができ、後発企業及び先発企業は、当該依頼に対して速やかに、かつ誠実に対応するものとする。(ただし、速やかに対応できない場合は、その理由を付して、医薬品審査管理課に速やかに相談すること。)
①当該後発医薬品等及び先発医薬品に関連する公開情報(特許公報や先発医薬品の添付文書等)
②上記(2)により専門委員への共有について同意が得られた資料
(6)医薬品審査管理課は、専門委員から意見書を受領し、意見照会が完了した後、速やかに、後発企業及び先発企業に対して、専門委員への意見照会手続が終結した旨通知する。
(7)医薬品審査管理課は、承認予定日の経過等により後発医薬品等の承認可否についての最終的な判断が公になった後、速やかに、希望する後発企業及び先発企業に対して、以下の情報をマスキングした上で、専門委員から受領した意見書の写しを開示する。
①専門委員の氏名及び所属
②個人情報
③法人に関する情報のうち、第三者に開示にすることにより、法人の権利、競争上の地位その他正当な利益を害するおそれがあるもの
4 その他留意事項
令和7年度厚生労働科学特別研究事業「医薬品特許情報の専門的評価の枠組み構築に向けた調査研究」にて、専門委員制度の最適化に向けた実証研究を行う予定であり、今回の試行に際して確認された専門委員制度の課題や改善点等については、個別品目名や各企業の見解の内容等の機密情報を含まない形で、当該研究班に共有する可能性があることを申し添える。
医薬品審査管理課から専門委員への意見照会は、同通知の別添「パテントリンケージにおける専門委員制度の運用指針」に基づき実施することとしています。
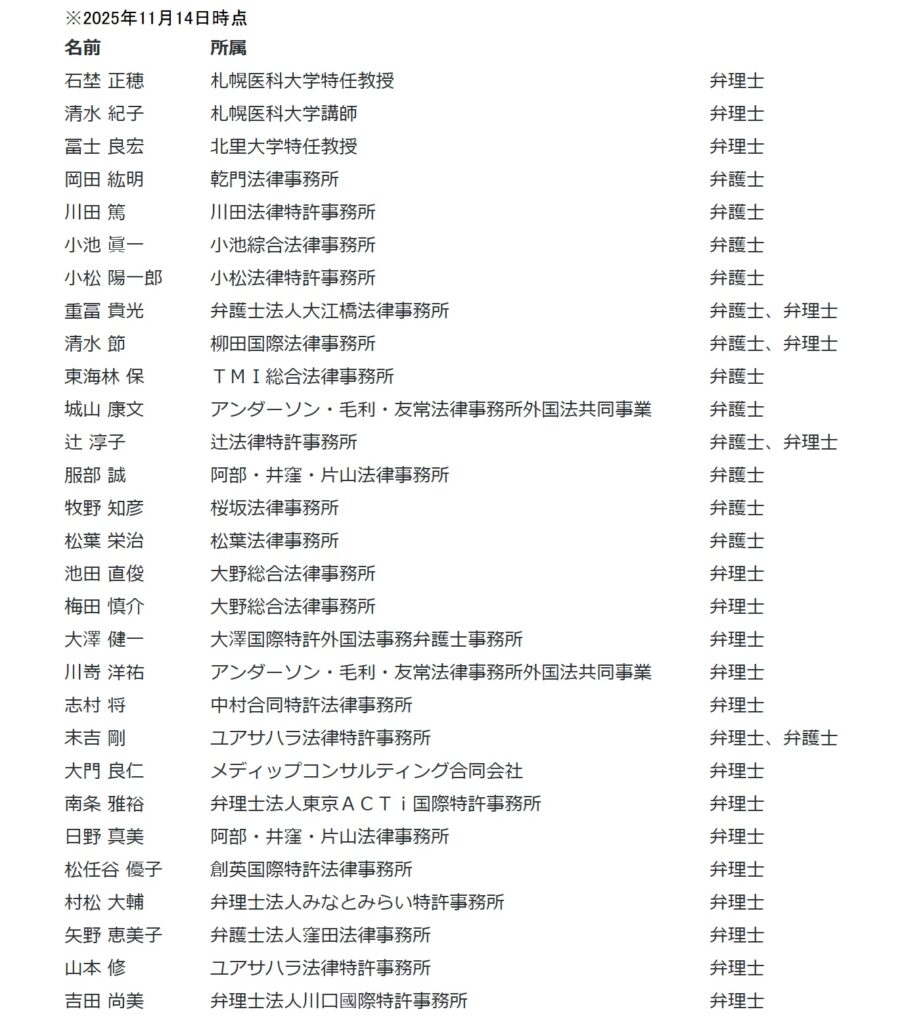
また、以下のとおりの専門委員候補が厚労省ホームページの「医薬品特許情報」サイトに公開されています。

この専⾨委員制度の試行的導⼊の検証には、同制度の対象となった後発企業及び先発企業双方から制度の納得感等についてのヒアリングが必須なのではないでしょうか。この検証とともにパンテントリンケージそのものの制度的課題の改善検討が並行してしっかり進められることを期待しています。
参考:
- 2025.10.11ブログ記事「厚労省、日本版パテントリンケージ制度の根拠となっている平成21年二課長通知を改正、新たな通知を発出」
- 2025.07.02ブログ記事「日本型パテントリンケージ制度において医薬品特許の専門家の意見を反映させる仕組みの構築に向けた調査研究」
- 2025.05.03ブログ記事「【速報】PhRMA、厚労省提案のパテントリンケージ制度に懸念を表明」
- 2024.07.25ブログ記事「【速報】厚生科学審議会(医薬品医療機器制度部会) パテントリンケージ制度の運用改善について議論 医薬品特許の専門家への意見照会制度の導入検討へ」
- 2021.03.08ブログ記事「日本のパテントリンケージの現状の課題とその解決に向けた提案」



コメント