Summary
本件は、リパスジル製剤に関する特許の特許権者である原告(興和)が、当該特許を無効とした審決(請求人:東亜薬品)の取消しを求めた事案であり、争点は進歩性判断の当否であった。2026年1月22日、知財高裁は、原告主張の取消事由はいずれも理由がないとして、原告の請求を棄却した。
本判決は、点眼剤の変色抑制という課題に関し、先行技術に記載された成分構成に加えてポリオレフィン容器を採用した点について、当業者が適宜選択し得る設計事項の範囲にとどまるとして、進歩性を否定したものである。また、発明の効果についても、特段予測困難な顕著な効果が認められるとはいえないと判断された。医薬製剤分野において、容器材料の選択を含む処方設計の進歩性判断に一定の示唆を与えた事例といえる。
さらに、本件は、自社論文公開後の出願という経緯の下で進歩性が争われた点でも示唆的であり、出願、論文公表、製品承認のタイミングを有機的に設計する重要性を改めて示すものとなった。また、本件特許の無効により、リパスジル点眼液0.4%の後発医薬品参入の動向にも一定の影響を及ぼす可能性があり、関連特許の帰趨と併せて今後の展開が注目される。
☕AIアシスタントたちのおしゃべりコーヒータイム☕
おや、ピポとミャオがおしゃべりしてますよ・・・

ピポせんぱ~い。この判決、すごくシンプルに教えてください!

「自分たちで出した論文に、自分の特許を潰された話」かな。

でも今回は、容器とか濃度とか、ちゃんと限定していましたよね?

そこが争点。でも裁判所はこう見たんだ。
「水性? 点眼剤なら普通」
「ポリオレフィン容器? 医薬品容器なら候補に入る」
「0.4%? 用量設計の範囲」
・・・というわけで、相違点は「設計事項」の範囲内と評価されたんだ。

でも、変色問題って、やってみないと分からないことも多そうですが。

実際はそう。でも今回は「予測不能な効果」とまでは認められなかったんだ。
つまり、「苦労した」と「進歩性のある発明だった」は別・・・という感じかな。

つまり、ピポせんぱいが一生懸命仕事で苦労しても、目立った成長が見られなかった・・・という感じと同じですか?

・・・(反論できず)
1.背景
本件(知財高裁令和7年(行ケ)10051)は、発明の名称を「医薬品」とする特許第6236167号の特許権者である興和株式会社(原告)が、当該特許を無効とした審決(請求人:東亜薬品株式会社(被告))の取消しを求めた事案である。争点は、進歩性判断の当否である。
(1)本件各訂正発明
本件訂正後の特許請求の範囲の請求項1から4(本件各訂正発明)の内容は、以下のとおりである。
リパスジル若しくはその塩又はそれらの溶媒和物を含有する水性組成物が、ポリエチレン及びポリプロピレンから選ばれる1種以上のポリオレフィン系樹脂製容器に収容されてなり、水性組成物中のリパスジル若しくはその塩又はそれらの溶媒和物の含有量が、水性組成物100mL当たりフリー体として0.4gであり、容器が、点眼剤用容器である、医薬製剤。
【請求項2】
水性組成物のpHが4~9であり、ポリオレフィン系樹脂製容器がポリエチレン製容器である、請求項1記載の医薬製剤。
【請求項3】
リパスジル若しくはその塩又はそれらの溶媒和物を含有し、水性組成物中のリパスジル若しくはその塩又はそれらの溶媒和物の含有量が、水性組成物100mL当たりフリー体として0.4gである水性組成物を、ポリエチレン及びポリプロピレンから選ばれる1種以上のポリオレフィン系樹脂製容器に収容する工程を含む、水性組成物の変色の抑制方法。
【請求項4】
容器が、点眼剤用容器であり、60℃で3ヶ月間保存したときに色差計(分光測色計CM-700d:コニカミノルタセンシング(株))で測定した保存前後の色差(ΔYI)を5未満とする、請求項3記載の方法。
リパスジルを眼科用剤として製剤化するにあたり、特定の材質の容器に収容した場合、高温・長期保存下で変色が生じるという問題が生じることが判明した。本件各訂正発明は、容器材質をポリエチレン又はポリプロピレンから選択されるポリオレフィン系樹脂製とすることで、60℃・3か月保存後の変色(ΔYI)を5未満に抑制し、保存安定性に優れた医薬製剤を提供する点に技術的特徴を有する。
(特許第6236167号より)
(2)無効理由の主引用例甲2との関係
東亜薬品が請求した無効審判(無効2023-800004号)では、甲2(Current Eye Research, 2014年, Vol.39, No.8, pp.813-822)を主引用例とする進歩性欠如(無効理由1)が主要な争点となった。
甲2は、ROCK阻害薬K-115(リパスジル塩酸塩水和物)の局所点眼液が新規かつ強力な抗緑内障薬であることを示した、興和研究者を著者とする論文であり、2014年2月6日にオンライン公開されている。本件特許の優先日は2014年9月25日であり甲2の公開後であった。
本件訂正発明1と甲2発明1(K-115を含有する局所点眼液)との一致点・相違点は以下のとおりである。
(一致点)
リパスジル若しくはその塩又はそれらの溶媒和物を含有する組成物。
(相違点1)
本件訂正発明1は、組成物が「水性組成物」であるのに対し、甲2発明1では、対応する事項が特定されていない点。
(相違点2)
本件訂正発明1は、組成物が「ポリエチレン及びポリプロピレンから選ばれる1種以上のポリオレフィン系樹脂製容器に収容されてなり」、「容器が、点眼剤用容器である、医薬製剤」であるのに対し、甲2発明1では、対応する事項が特定されていない点。
(相違点3)
本件訂正発明1は、組成物中の「リパスジル若しくはその塩又はそれらの溶媒和物の含有量」が、組成物「100mL当たりフリー体として0.4g」であるのに対し、甲2発明1では、対応する事項が特定されていない点。
審決は、本件各訂正発明はいずれも甲2記載発明及び周知技術に基づいて当業者が容易に想到し得たものであり、特許法29条2項(進歩性欠如)に該当すると判断した。
これに対し興和は、本件審決の取消しを求めて本件訴訟を提起し、本件各訂正発明と甲2発明との相違点に係る容易想到性及び顕著な効果の判断に誤りがあると主張した。
(3)リパスジルをめぐる特許係争の背景
本件判決を紹介する前に、まずはリパスジルをめぐる特許係争の背景を紹介する。
リパスジル(Ripasudil)は、2002年にデ・ウエスタン・セラピテクス研究所(DWTI)から興和に全世界を対象としてライセンスアウトされ、Rhoキナーゼ(ROCK)阻害薬として開発された緑内障・高眼圧症治療薬である。国内では、2014年9月26日にリパスジル塩酸塩水和物を有効成分とする「グラナテック®点眼液0.4%」として製造販売が承認された。その後、α2作動薬であるブリモニジン酒石酸塩(Brimonidine Tartrate)も配合した「グラアルファ®配合点眼液」が2022年に承認された。
 リパスジルは、Rhoキナーゼを阻害することにより房水流出を促進し、眼圧を低下させる薬剤である。従来の緑内障治療薬とは異なる作用経路を有することから、単剤としての使用に加え、他剤との併用療法においても一定の位置付けを占めてきた。
リパスジルは、Rhoキナーゼを阻害することにより房水流出を促進し、眼圧を低下させる薬剤である。従来の緑内障治療薬とは異なる作用経路を有することから、単剤としての使用に加え、他剤との併用療法においても一定の位置付けを占めてきた。
グラナテック®点眼液については、承認日である2014年9月26日から2022年9月25日までの8年間が再審査期間として設定され、その終了後、2024年2月15日には、「リパスジル点眼液0.4%『KOG』」(興和AGファーマ)がAG(オーソライズド・ジェネリック)として承認されている。現時点で薬価収載はされていないようである。
リパスジルに関する延長された物質発明の特許権はすでに存続期間を満了しており(特許第3834663号及び特許第4316794号)、リパスジル製剤について存続期間延長登録出願がなされた特許権を中心に整理すると、概ね以下のとおりである(なお、これら以外にも存続期間延長登録出願が行われていない特許権が存在する可能性はある)。
| 特許番号 | 発明の名称(分類) | 出願日 | 20年の満了日(延長後の満了日) | 特許の請求の範囲1の概要 |
| ①3834663 | イソキノリン誘導体及び医薬(物質) | 1997/01/31 | 2017/01/31 (2022/01/31) | 満了 |
| ②4316794 | イソキノリン誘導体及び医薬(物質) | 1998/10/22 | 2018/10/22 (2023/10/22) | 満了 |
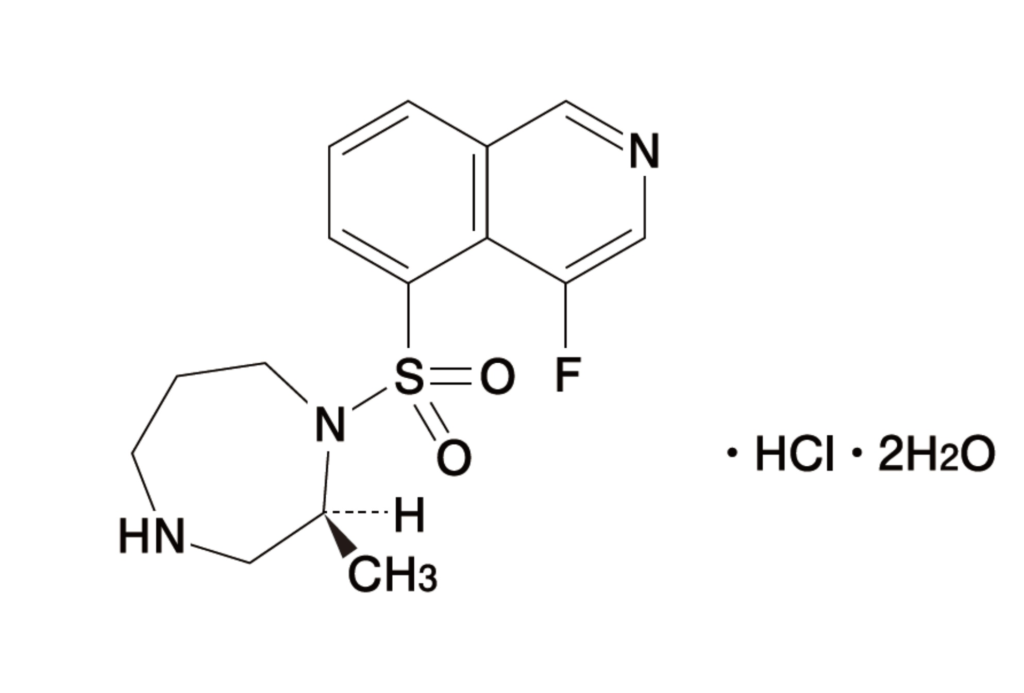
| ③4016060 | (S)-(-)-1-(4-フルオロイソキノリン-5-イル)スルホニル-2-メチル-1,4-ホモピペラジン塩酸塩・二水和物(結晶) | 2005/11/29 | 2025/11/29 (グラナテック®点眼液承認で2030/11/29) | (S)-(-)-1-(4-フルオロイソキノリン-5-イル)スルホニル-2-メチル-1,4-ホモピペラジン塩酸塩・二水和物。 |
| ④4099201 | 緑内障予防又は治療剤(製剤) | 2005/12/22 | 2025/12/22 (グラナテック®点眼液承認で2030/12/22) | ・・・及びリン酸又はその塩を含有する緑内障予防又は治療剤。 |
| ⑤4168071 | 点眼用組成物(製剤) | 2006/12/07 | 2026/12/07 (グラナテック承認で2031/12/07) | ・・・、リン酸又はその塩、及びグリセリン0.5~5重量%を含有する緑内障の予防又は治療用、あるいは高眼圧症の予防又は治療用の水性点眼用組成物。 |
| ⑥6244038 | 医薬製剤(製剤) | 2015/09/25 | 2035/09/25 (グラアルファ®配合点眼液承認で延長出願中) | ・・・を含有する水性組成物が、波長300~335nmの光線を遮断する包装体に収容されてなる、医薬製剤。 |
| ⑦6236166 | 水性組成物(製剤) | 2015/09/25 | 2035/09/25 (グラアルファ®配合点眼液承認で延長出願中) | ・・・と、ベンザルコニウム塩化物とを含有する、水性組成物。 |
|
⑧6236167本件特許 |
医薬品(製剤) | 2015/09/25 | 2035/09/25 (グラアルファ®配合点眼液承認で延長出願中) | ・・・を含有する水性組成物が、ポリエチレン及びポリプロピレンから選ばれる1種以上のポリオレフィン系樹脂製容器に収容されてなる、医薬製剤。 |
| ⑨6612774 | 緑内障を予防又は治療するための薬物療法(併用剤) | 2015/12/11 | 2035/12/11 (グラアルファ®配合点眼液承認で延長出願中) | ・・・とブリモニジン若しくはその塩又はそれらの溶媒和物とを配合してなる緑内障予防又は治療剤 |
| ➉5951920 | 新規水性組成物(併用剤) | 2015/12/11 | 2035/12/11 (グラアルファ®配合点眼液承認で延長出願中) | ・・・及びブリモニジン又はその塩を含有する、水性組成物。 |
| ⑪6495379 | 水性の組成物(併用製剤) | 2017/06/15 | 2037/06/15 (グラアルファ®配合点眼液承認で延長出願中) | 次の成分(A)及び(B): (A)ブリモニジン若しくはその塩又はそれらの溶媒和物; (B)(略) で表される化合物若しくはその塩又はそれらの溶媒和物; を含有する、水性組成物であって、成分(B)の含有量が、水性組成物全容量に対して、一般式(1)で表される化合物のフリー体に換算して0.25~6w/v%である、水性組成物。 |
現時点では、リパスジル点眼液0.4%AG以外の後発医薬品の承認は確認されていないものの、先発メーカー側がAG承認に踏み切っている経緯を踏まえると、リパスジル点眼液0.4%については、今後、非AGを含む後発医薬品の承認が進み、先発医薬品と後発医薬品が併存する市場構造へと移行する可能性が高いと考えられる。
これに対し、グラアルファ®配合点眼液は、リパスジルにブリモニジンを組み合わせた配合剤であり、2022年9月26日に製造販売承認を取得している。本剤の再審査期間は6年間とされ、2028年9月25日まで継続する。この再審査期間中は後発医薬品の承認申請が制限されるため、同配合点眼液の後発医薬品は事実上参入することはできない。
実際、現時点では、東亜薬品は、併用剤特許(表中⑨➉⑪)ではなく、特定の製剤特許(表中⑥及び本件特許⑧)に対してのみ無効審判を請求していることから、他の製剤特許等(表中③④⑤⑦)の発明の技術的範囲を回避しつつ、単剤であるリパスジル点眼液0.4%の市場参入を狙っているように思われる。
このように、リパスジル製剤における後発医薬品参入の展開は、単に「単剤か配合剤か」という製品形態の違いにとどまらず、承認時期の差に基づく再審査期間の設定、製剤に関する特許発明の技術的範囲、さらには延長された特許権の効力範囲といった複数の要因が重なって形成されている。
単剤であるグラナテック®点眼液が、すでにAGの投入や後発医薬品メーカーとの特許係争の段階に入っている一方で、グラアルファ®配合点眼液については、再審査期間の満了を迎える2028年を見据えて、本格的な特許係争が今後展開される可能性がある。
リパスジルの製造販売元である興和は非上場企業であるため、製品別の売上高は公表されていないが、創薬元であるDWTIのIR資料から、その売上動向を概観することができる。リパスジル単剤製剤であるグラナテック®は、2014年の上市から約10年が経過し、国内市場では成熟期に入っている。日本については2024年9月に興和からDWTIへのグラナテック®に関するロイヤリティ受領期間が終了した。興和における国内売上規模は、ピーク時で年間約80億円程度と推計されている。一方、ブリモニジンとの配合剤であるグラアルファ®は近年普及が進んでおり、2024年12月期のDWTI決算資料では、同製品に係るロイヤリティ収益が前期比約75%増と大きく伸長していることが示されている。
リパスジルは、単剤(グラナテック®)から配合剤(グラアルファ®)への展開、さらに再審査期間満了後の後発医薬品参入という製品ライフサイクルを通じて、医薬品開発、薬事制度、知財戦略がどのように相互に関係しているかを示す好例である。これらの点を押さえておくことによって、以下に紹介する本件特許係争の背景をより容易に理解することができるだろう。
なお、「グラナテック®点眼液0.4%」の容器本体の材質は、紫外線吸収剤含有ポリプロピレンである。同製品の審査報告書の記載によると、光安定性試験の結果、ポリプロピレン(PP)製容器に充てんされた製剤は、光に不安定であったが、紫外線吸収剤含有PP製容器に充てんされた製剤は、光に安定であったとのことである。
2.裁判所の判断
2026年1月22日、知的財産高等裁判所第1部(以下「裁判所」)は、原告が主張する取消事由はいずれも理由がないとして、原告の請求は理由がないからこれを棄却することとし、主文のとおり判決した。
1 原告の請求を棄却する。
2 訴訟費用は原告の負担とする。
本判決は、主引用例である甲2(K-115/リパスジル塩酸塩水和物点眼液に関する論文)に基づき、本件各訂正発明が当業者にとって容易想到であるか、及び主張された効果が進歩性を基礎付ける顕著な効果といえるかを中心に判断したものである。
まず、相違点1(水性組成物である点)について、裁判所は、甲2にはTris-HCl緩衝液中でのROCK阻害活性試験が記載されており、K-115が水を溶媒とする水性組成物として試験され活性を示していることが読み取れると認定した。その上で、甲2の局所点眼液についても非水性組成物であることを示す記載はなく、技術常識としても非水性とする理由は見当たらないことから、甲2発明の点眼液は水性組成物と評価できる、又は少なくとも当業者が自然に水性組成物と想起し得ると判断した。したがって、相違点1は実質的相違点とはいえないか、仮に相違点であっても容易想到であるとされた。
次に、相違点2(ポリオレフィン系樹脂製の点眼容器の採用)について、裁判所は、点眼液を医薬製剤化する際に容器材質を検討すること自体が当業者にとって自然な作業であるとした。そして、本件優先日当時、点眼容器としてポリエチレン、ポリプロピレン、PET、ポリカーボネート等が用いられており、容器材質が製剤安定性に影響することは周知であり、また承認取得のために安定性試験を通じて容器材質を特定する必要があることも周知であると認定した。そのため、ポリエチレン又はポリプロピレンを選択することは設計事項の範囲内であると判断した。
また、原告が主張した「60℃・3か月保存による変色課題は予見困難である」との点については、医薬製剤では温度・期間を変えた各種安定性試験を行うことが技術常識であり、高温長期保存で品質変化が生じ得ることは周知の課題であるとした。さらに、苛酷試験条件として60℃・3か月という条件も既に知られていたと認定し、この条件下で変色が抑制される容器材質を選択することは設計事項の範囲内であるとした。
さらに、ポリエチレンやポリプロピレンはガス透過性が高いため通常は回避されるとの原告主張については、変色がガス透過に起因することを示す証拠はなく、また当時それら材料が容器材質として不適と認識されていたとも認められないとした。
相違点3(リパスジル濃度:100mL当たりフリー体0.4g)については、点眼剤の有効成分濃度は有効性が期待できる範囲で当業者が設計する事項であり、動物試験の用量を参考にヒト用濃度を設計することは自明であるとした。そのため、甲2の用量依存的眼圧低下作用の知見に基づき、適切濃度を設定することは自然であり、容易想到であると判断した。
顕著な効果については、容器材質により変色程度が異なること自体は当業者が予期し得る事項であるとした。また、本件明細書における60℃・3か月条件やΔYI=5の評価基準についても技術的根拠が示されておらず、当業者が適宜設定し得る範囲にとどまると判断した。その結果、ポリオレフィン容器の採用による効果は予測困難又は顕著な効果とはいえないと結論付けた。
以上を前提として、裁判所は、本件訂正発明1は甲2及び周知技術に基づき容易想到であり、取消事由1は理由がないと判断した。そして、訂正発明2~4についても、相違点や効果の評価は基本的に同様であるとして、いずれも容易想到であると判断し、審決取消請求をいずれも棄却した。
3.コメント
(1)容器材質選択と容易想到性ハードル
本判決は、医薬製剤分野における「製剤設計」「容器選択」「安定性評価条件」を広く設計事項として整理した点に特徴がある。
特に注目されるのは、裁判所が本件の変色問題を、リパスジル固有の課題ではなく、「医薬製剤一般における高温長期保存下での品質変化」という一般的課題として評価した点である。この点から、個別化合物に特有の課題を発見したとしても、一般的課題であれば、その課題解決の提供が「設計事項」の範囲内として扱われてしまう可能性を再認識する必要がある。
また、容器材質についても、安定性との関係を踏まえた選択であっても、当業者による通常の最適化検討の範囲内と評価され得ることが明確に示された点は実務上重要である。医薬容器と製剤安定性の組合せ発明について、容易想到性が比較的広く認定され得ることを示唆する内容といえる。
本件と同様に、医薬品の容器材質と安定性との関係を踏まえて進歩性を否定した判決例として知財高裁平成26年(行ケ)10059事件判決がある。この判決は、乾燥リポソーム型ポビドンヨード製剤について、保存安定性を考慮してプラスチック等の容器材質を選択する点が争われた事案において、医薬品である以上、長期安定保存可能な容器を選択することは自明の課題であり、医薬品容器として通常用いられるガラス又はプラスチック等の材質の中から保存安定性を踏まえて適切なものを選択することは当業者がなし得るものであると判断したものであり、安定性との関係で容器材質の選択が行われた場合であっても、特段の阻害要因や予測困難な効果が認められない限り、進歩性を基礎付ける事情とはなりにくいことを示す例と位置付けられる(2014.12.27ブログ記事「2014.12.18 「ユーロ-セルティック v. 特許庁長官」 知財高裁平成26年(行ケ)10059」参照)。

本件では、さらに、顕著な効果の判断において、評価条件(60℃・3か月)及び評価指標(ΔYI=5)の技術的合理性が明細書上十分に基礎付けられていない点が重視されたことも重要である。すなわち、効果の差異のみならず、評価条件及び評価基準自体の技術的必然性まで説明する必要があることを示している。
本判決は、製剤、容器、安定性評価という複数の要素から構成される発明について、それぞれが個別最適化として理解され得る場合には、全体として設計事項と評価され得ることを示した点で、製剤系特許の実務に一定の示唆を与えるものであるといえるだろう。
なお、本件日本特許第6236167号のファミリーに属する米国出願(出願番号15/514,020)については、米国特許商標庁の特許審判部(PTAB)が、引用文献に基づき当業者にとって自明であるとした拒絶査定を支持する判断を示している(Appeal 2019-002914)。これに対し、欧州出願においては、ポリプロピレン製容器を構成要件とするクレームについて特許が認められ、登録(EP3199162B1)に至っており、容器材質の選択に関する進歩性評価が三極で必ずしも一様ではないことを示唆している。
(2)本件特許の出願のタイミング
本件特許の優先日は2014年9月25日であり、甲2の公開後であった一方、リパスジル塩酸塩水和物を有効成分とする「グラナテック®点眼液0.4%」の製造販売承認日の前日であった点は興味深い。
承認取得直前のタイミングを狙った出願(もしかすろと、むしろ無理を承知での出願)であった可能性も想起されるが、その結果、興和自身が公表した論文(甲2)が先行技術となり、進歩性判断において不利に働く結果となった。本件は、出願、論文公表、製品承認という三者のタイミングを有機的に設計することの重要性を改めて示した事案であるといえる。
(3)リパスジルの後発医薬品参入が加速する可能性
東亜薬品は、併用剤特許(前記の表中⑨~⑪)ではなく、特定の製剤特許(表中⑥及び本件特許⑧)のみに対して無効審判を請求している。この点からは、他の製剤特許等(表中③~⑤、⑦)の技術的範囲を回避しつつ、単剤であるリパスジル点眼液0.4%の市場参入を志向している可能性がうかがわれる。
本件特許⑧が無効となった場合、残る主要な製剤特許である特許第6244038号(表中特許⑥)の帰趨が注目される。同特許については、これを無効とした審決の取消訴訟の判決が2026年2月10日に言い渡される予定である(令和7年(行ケ)第10073号)。
今後の判断次第では、リパスジル点眼液0.4%の非AG後発医薬品の市場参入が現実味を帯びる可能性もある。
※ご覧いただきありがとうございます。この記事の内容について、読者の皆さまのご意見や気づきもぜひお聞かせください!
以下のようなご感想・質問、大歓迎です!
- 🤔ここ理解しづらいな、という部分はありましたか?
- 🤔このニュース、事件、判決例の実務影響についてご意見ありますか?
- 🤔過去の類似事例や判決例をご存じでしたら教えてください!
- 🤔恥ずかしい質問、つぶやき、大歓迎です
- 「👍」「なるほど」「疑問あり」だけでもOK!
コメント欄は↓ コメントは匿名OK! ぜひ気軽に投稿してください🙇
皆さんの反応が、次回の記事や解説のヒントになります🥰
Robot icons created by Freepik – Flaticon; Robot cat icons created by Freepik – Flaticon





コメント