2026年2月10日、アステラス製薬は、過活動膀胱治療剤Myrbetriq®(一般名:ミラベグロン/Mirabegron)の後発品に対する米国特許権侵害訴訟について、Lupin LimitedおよびLupin Pharmaceuticals, Inc.(以下「Lupin」)との間で和解契約を締結したと発表しました。アステラス製薬のプレスリリースによれば、本和解により、両社間で係属していたMyrbetriq®関連の全ての訴訟は終結するとのことです(アステラス製薬 press release「Myrbetriq®特許侵害訴訟でLupinと和解」)。
1.451特許(reduced food effect)をめぐる仮差止めの経緯
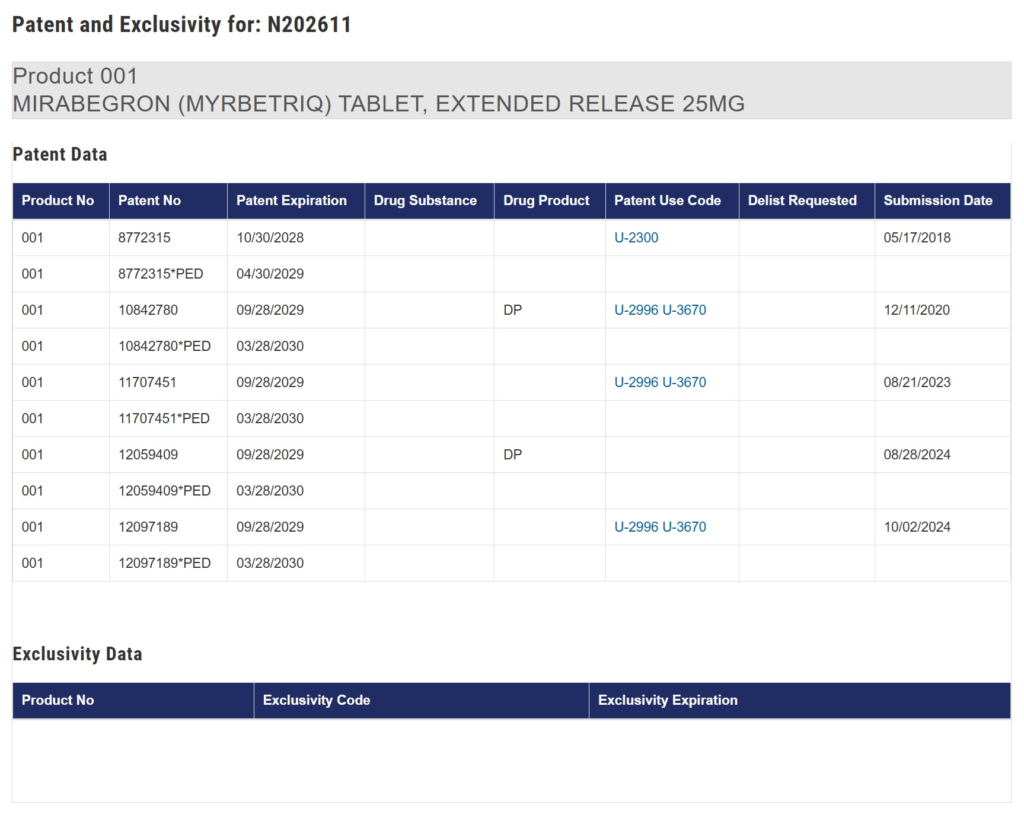
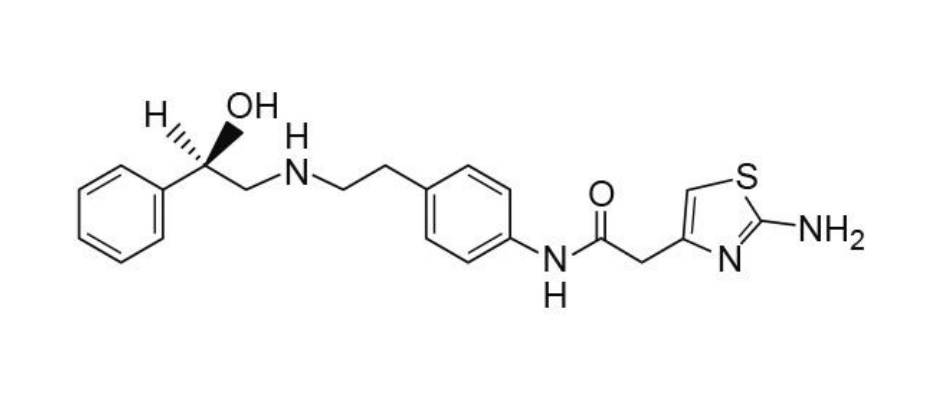 アステラス製薬は、ミラベグロンの徐放性製剤におけるreduced food effectを特徴とする過活動膀胱治療方法に関する米国特許11,707,451号(以下「451特許」、2030年3月満了)を根拠として、Lupinの後発品が同特許を侵害すると主張し、2023年7月、デラウェア州連邦地方裁判所に仮差止めを申し立てました。
アステラス製薬は、ミラベグロンの徐放性製剤におけるreduced food effectを特徴とする過活動膀胱治療方法に関する米国特許11,707,451号(以下「451特許」、2030年3月満了)を根拠として、Lupinの後発品が同特許を侵害すると主張し、2023年7月、デラウェア州連邦地方裁判所に仮差止めを申し立てました。
しかし、2024年4月、同地裁は差止めを認めない方向の報告・勧告を示し(Case No. 1:23-cv-00819-JFB-CJB)、Lupinは「at risk」で販売を継続し得る状況となりました(2024.04.22ブログ記事「アステラス製薬の過活動膀胱治療剤「Myrbetriq」 LupinとZydusによる後発品発売の停止を求める仮差止め請求に関する米国デラウェア州連邦地方裁判所の決定について」参照)。実際、Lupinは同年4月から後発品の販売を開始したと報じられています(Lupin press release)。
仮差止めが認められなかったことにより、市場構造は事実上ジェネリック参入を前提とする局面へ移行していました。

「451特許」は2023年7月に登録され、すぐに訴訟へ突入したようです。先行していたANDA訴訟で当時劣勢だったアステラスはこの特許で何とか後発品市場参入を抑えたかったところですが・・・
2.780特許訴訟とCAFC差戻し
451特許での訴訟提起に先行して、ミラベグロンの徐放性製剤に関する米国特許10,842,780号(以下「780特許」、2030年3月満了)について、アステラス製薬はLupinを含む複数企業に対し、デラウェア州連邦地方裁判所で特許侵害訴訟を提起していました(Case No. 1:20-cv-01589-JFB-CJB他)。
地裁は780特許を無効と判断しましたが(2023.06.12ブログ記事「アステラス製薬の過活動膀胱治療剤「Myrbetriq® 」米国デラウェア州連邦地方裁判所の判決について」参照)、これに対してアステラス製薬はCAFCに控訴。2024年9月、CAFCは地裁の無効判断に誤りがあるとして判決を取り消し、差し戻しました(Astellas Pharma, Inc. v. Sandoz Inc., 2023-2032, 2023-2063, 2023-2089)。

差戻し後の再審理(Case No. 1:24-cv-01069-JFB-EGT)は最終段階に入り、故意侵害および損害額認定を含む陪審審理(2026年2月10日開始予定)の直前で、Lupinとの和解が成立したことになります。
仮差止めに失敗した451特許と、差戻し後にアステラス製薬に有利な展開となっていた780特許という、性質の異なる二つの訴訟が並行していた点が、本件の構図上の重要な特徴といえます。
3.決算説明会で示唆されていた「2月以降」
2025年7月30日のアステラス製薬2025年度第1四半期決算説明会においては、ミラベグロンの後発品参入状況と今後の訴訟見通しに関する質疑がなされ、「来年2月以降に結論が出てくる」との趣旨の回答が示されていました。
酒井 [Q]:すいません。ミラベグロン、ジェネリックですが、今、2 社入ってきていたと思うんですけれども。それ以上の参入は防げるという、そういう理解でよろしいですか。
北村 [A]:一応フォーミュレーションのパテントの話であったり、というところで、しっかりと今、リティゲーションアクションを取っていて、われわれに対して今、フェイバラブルな結論が出ていると認識しています。
当然ジェネリックのほうはまた追加で上告してくる可能性は、当然これはあるとは思うんですけれども、いったん結論が来年 2 月以降に出てくると思います。
酒井 [Q]:2 月以降に、その訴訟の結果が出てくるってことですか。
池田 [A]:そうです。訴訟が 2 月以降に始まってまいりますので、それ以降に結果が出てくるということになるかと思います。
酒井 [Q]:2 月 9 日という話ですね、そうすると。
池田 [A]:訴訟の開始がということになります。– 2025年7月30日 アステラス製薬株式会社 2025年度第1四半期決算説明会トランスクリプトより
結果として、陪審審理直前のタイミングで和解に至ったことから、同説明は780特許訴訟の審理スケジュールを念頭に置いた発言であったと理解されます。
4.和解条件とLupinの販売継続
Lupin側も同日付で和解内容を公表しており、
- 総額9,000万米ドルをアステラス製薬に支払うこと
- うち7,500万米ドルは前払オプション料
- 残額は2027年9月までの販売数量に応じた前払ライセンス料
が含まれることを明らかにしています(Lupin press release)。
本契約により、Lupinは米国市場におけるミラベグロン後発品の販売を継続可能となりました。
すなわち、本件は販売停止型の和解ではなく、金銭支払と引き換えに販売継続を認めるライセンス型和解と位置付けられます。
5.事業面への影響
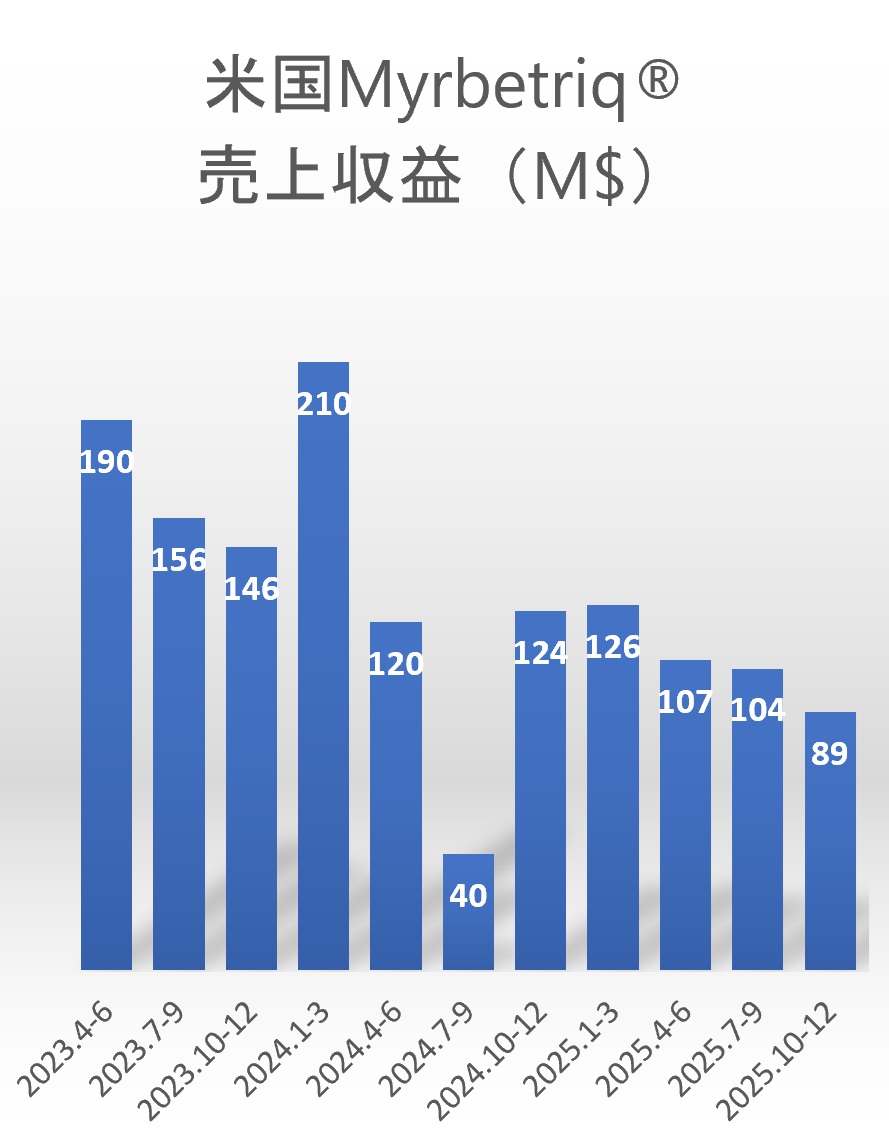
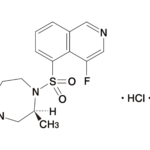
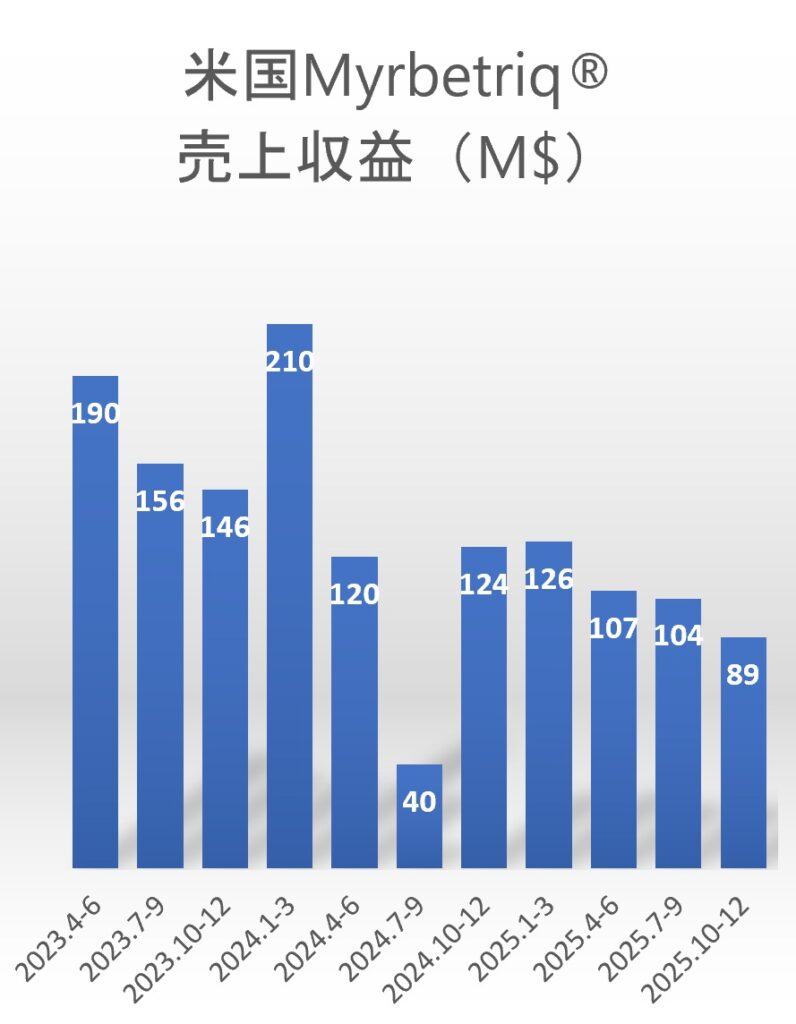 ミラベグロンは日本ではベタニス®として2011年に、米国ではMyrbetriq®として2012年に承認された選択的β3アドレナリン受容体作動薬であり、2023年度のグローバル売上は1,981億円(うち米国$701M)でした。
ミラベグロンは日本ではベタニス®として2011年に、米国ではMyrbetriq®として2012年に承認された選択的β3アドレナリン受容体作動薬であり、2023年度のグローバル売上は1,981億円(うち米国$701M)でした。
しかし、2024年4月からの米国での後発品参入の影響により、2024年度は1,700億円(うち米国$410M)へと減少し、2025年度も一定の減収が見込まれていました。
本件和解は、
- 451特許では仮差止めが認められず後発品が既に市場参入していたこと
- 他方、780特許ではCAFC差戻しによりLupin側が陪審審理を前に一定のリスクを抱えていたこと
- 保護特許群が2030年に満了予定であること(下記Orange bookの掲載特許リスト参照)
といった複数の要素を背景に、損害賠償リスクと市場不確実性を織り込んだ実務的解決に至ったものと考えられます。
特に、差戻し後の故意侵害認定および損害算定フェーズを目前に控えたタイミングでの包括和解である点は、当事者双方のリスク評価の結果として理解できるでしょう。
もっとも、Lupinの販売は継続されるため、米国におけるミラベグロン後発品市場の競争環境は今後も継続します。アステラス製薬の収益構造は、ミラベグロンの特許満了(2030年)に向けて段階的に再構築を迫られる局面に入ったといえます。

イクスタンジのパテントクリフも迫っており(2021.02.06ブログ記事「前立腺がん治療剤XTANDI®(イクスタンジ)のパテントクリフ」参照)、アステラス製薬にとっては重要な局面を迎えています。
※ご覧いただきありがとうございます。この記事の内容について、読者の皆さまのご意見や気づきもぜひお聞かせください!
以下のようなご感想・質問、大歓迎です!
- 🤔ここ理解しづらいな、という部分はありましたか?
- 🤔このニュース、事件、判決例の実務影響についてご意見ありますか?
- 🤔過去の類似事例や判決例をご存じでしたら教えてください!
- 🤔恥ずかしい質問、つぶやき、大歓迎です
- 「👍」「なるほど」「疑問あり」だけでもOK!
コメント欄は↓ コメントは匿名OK! ぜひ気軽に投稿してください🙇
皆さんの反応が、次回の記事や解説のヒントになります🥰
Robot icons created by Freepik – Flaticon; Robot cat icons created by Freepik – Flaticon



コメント
2026年2月12日、アステラス製薬は、Zydus Lifesciences LimitedおよびZydus Pharmaceuticals (USA) Inc.(以下「Zydus」)との間で和解契約を締結したことを発表しました。LupinおよびZydusそれぞれとの和解契約に基づき、アステラス製薬は訴訟解決のため、両社合計で6,000万米ドルを受領するとのことです。さらに、両社から総額1億5,000万米ドルの一時金ライセンス料を受領するとともに、両社が米国内で販売する対象製品1単位当たりのライセンス料を受領するとのことです。この和解により、両社との間でMyrbetriq®に関する全ての訴訟は終結します。
(アステラス製薬 press release「Myrbetriq®特許侵害訴訟でLupinおよびZydusと和解」より)
https://jp.newsroom.astellas.com/2026-02-12-astellas-reaches-settlement-agreements-with-lupin-and-zydus-in-myrbetriq-patent-litigation
Zydusの公表によると、本和解契約の主な内容は以下のとおりです。
・Zydusは、Astellas社に対し、総額1億2,000万米ドルを支払う。
・Zydusは、さらに、本和解契約日から2027年9月までの間に米国で販売するZydusの後発ミラベグロン製品の各販売単位について、前払いの単位当たりライセンス料を支払う。
・本和解契約により、Myrbetriq®に関してAstellasとの間で係属していたすべての訴訟は終結し、Zydusは米国において自社の後発ミラベグロン製品の販売を継続することが可能。
https://www.zyduslife.com/investor/admin/uploads/21/82/Update-on-litigation-12-Feb-2026.pdf