 アステラス製薬は、米国デラウェア州連邦地方裁判所において、米国で販売している過活動膀胱治療Myrbetriq(一般名:ミラベグロン(Mirabegron))に関する特許(米国特許番号:11,707,451、以下「451特許」、2023年7月25日に登録、2030年3月満了予定)侵害訴訟(以下、「本訴訟」)が決着する前の、LupinとZydusによる後発品発売の停止を求める仮差止め請求の却下を推奨する報告および勧告を確認したと発表しました(2024.04.22 アステラス製薬 press release: 過活動膀胱治療剤「Myrbetriq™」 仮差し止め請求に関する米国デラウェア州連邦地方裁判所の決定について)。
アステラス製薬は、米国デラウェア州連邦地方裁判所において、米国で販売している過活動膀胱治療Myrbetriq(一般名:ミラベグロン(Mirabegron))に関する特許(米国特許番号:11,707,451、以下「451特許」、2023年7月25日に登録、2030年3月満了予定)侵害訴訟(以下、「本訴訟」)が決着する前の、LupinとZydusによる後発品発売の停止を求める仮差止め請求の却下を推奨する報告および勧告を確認したと発表しました(2024.04.22 アステラス製薬 press release: 過活動膀胱治療剤「Myrbetriq™」 仮差し止め請求に関する米国デラウェア州連邦地方裁判所の決定について)。
アステラス製薬が創製したミラベグロン(mirabegron)は、選択的β3 アドレナリン受容体作動薬であり、日本では、2011年7月1日に承認され、「ベタニス®錠」の製品名で販売されています。米国では、2012年6月28日に承認され、「Myrbetriq」の製品名で販売されています。
ベタニス/Myrbetriq(米国での商品名)/Betmiga(欧州での商品名)の2023年3月期のグローバル売上は、 1,886億円であり、そのうち、日本での売上は335億円、米国での売上は965億円でした(アステラス製薬 2023年6月22日提出 2023年3月期(第18期)有価証券報告書)。
今後、アステラス製薬はこの米国地裁の決定に対して異議を申し立てる予定とのことです。
本訴訟は、LupinとZydusによりMyrbetriqの後発品が「451特許」を侵害するとして、2023年7月に、アステラス製薬が同地裁に提訴していたものです。

「451特許」は2023年7月に登録され、すぐに訴訟へ突入したようです。アステラスはこの特許で何とか後発品参入を抑えたいところですが・・・
「451特許」のclaim 1は以下のとおりです。
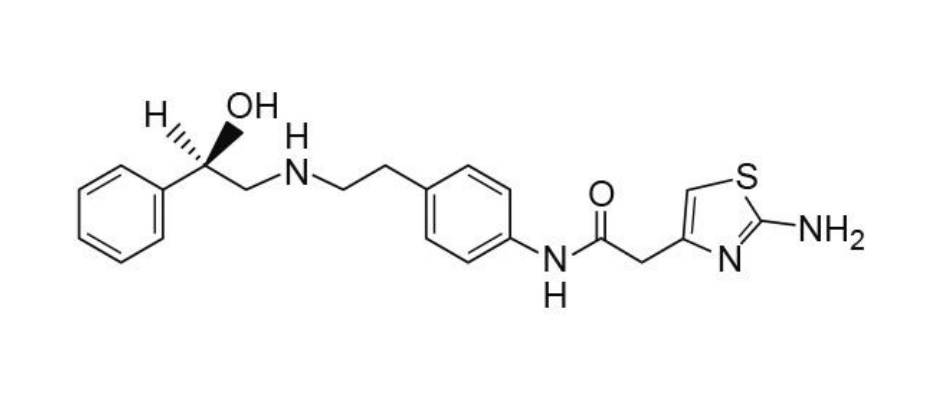
1. A method for treating overactive bladder such that the treating is with a reduced food effect, the method comprising administering orally to a subject in need thereof a tablet comprising 10 mg to 200 mg of (R)-2-(2-aminothiazol-4-yl)-4′-[2-[(2-hydroxy-2-phenylethyl)amino]ethyl]acetic acid anilide in a sustained release formulation,
wherein the sustained release formulation further comprises a carrier and provides a continuous drug release for at least 4 hours after oral administration,
wherein the sustained release formulation is any one selected from the group consisting of a sustained release hydrogel-forming formulation, a multi-layered formulation consisting of a drug core and a release-controlling layer which are geometrically arranged, a gel formulation in which a plurality of gums are combined, an osmotic pump type formulation a formulation utilizing a swelling polymer, a matrix formulation utilizing a water-soluble polymer, a modified release formulation with a coating membrane, and a matrix formulation utilizing an insoluble polymer, and
wherein the reduced food effect is compared to that after oral administration of an immediate release formulation comprising (R)-2-(2-aminothiazol-4-yl)-4′-[2-[(2-hydroxy-2-phenylethyl)amino]ethyl]acetic acid anilide.
また、LupinとZydusによる Myrbetriqの後発品が、上記とは別の特許(米国特許番号:10,842,780、以下「780特許」、2030年3月満了予定)を侵害するとアステラス製薬が主張する特許侵害訴訟が、現在、連邦巡回区控訴裁判所(Court of Appeals for the Federal Circuit:CAFC)で係争中とのことです。
「780特許」のclaim 1は以下のとおりです。
1. A pharmaceutical composition, comprising 10 mg to 200 mg of (R)-2-(2-aminothiazol-4-yl)-4′-[2-[(2-hydroxy-2-phenylethyl)amino]ethyl]acetic acid anilide, or a pharmaceutically acceptable salt thereof, in a sustained release hydrogel-forming formulation comprising a hydrogel-forming polymer having an average molecular weight of 100,000 to 8,000,000 and an additive having a water solubility of at least 0.1 g/mL at 20±5°C.,
wherein the hydrogel-forming polymer is at least one compound selected from the group consisting of polyethylene oxide, hydroxypropyl methylcellulose, hydroxypropyl cellulose, carboxymethyl cellulose sodium, hydroxyethyl cellulose, and a carboxyvinyl polymer,
wherein the additive is at least one selected from the group consisting of polyethylene glycol, polyvinylpyrrolidone, D-mannitol, D-sorbitol, xylitol, lactose, sucrose, anhydrous maltose, D-fructose, dextran, glucose, polyoxyethylene hydrogenated castor oil, polyoxyethylene polyoxypropylene glycol, polyoxyethylene sorbitan higher fatty acid ester, sodium chloride, magnesium chloride, citric acid, tartaric acid, glycine, (3-alanine, lysine hydrochloride, and meglumine, and
wherein a drug dissolution rate from the pharmaceutical composition is 39% or less after 1.5 hours, and at least 75% after 7 hours, as measured in accordance with United States Pharmacopoeia in 900 mL of a USP buffer having a pH of 6.8 at a paddle rotation speed of 200 rpm.
こちらの訴訟は、複数の企業が申請したMyrbetriqの後発品が、ミラベグロンの徐放性製剤に関する「780特許」を侵害しているとして、アステラス製薬が提訴していたもので、米国デラウェア州連邦地方裁判所が「780特許」を無効とする判決を下したため、アステラス製薬はこの判決に対し、CAFCに上訴したという経緯があります(2023.06.12 ブログ参考記事: アステラス製薬の過活動膀胱治療剤「Myrbetriq® 」米国デラウェア州連邦地方裁判所の判決について)。
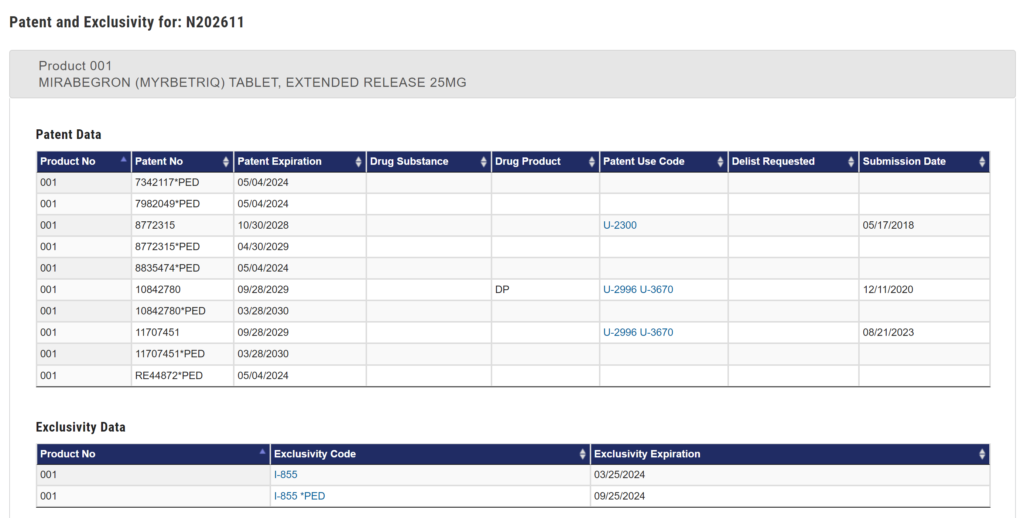
Orange Bookには、Myrbetriqを保護する米国特許として以下のものが収載されています(Orange Book Product Details for NDA 202611: MIRABEGRON (MYRBETRIQ) TABLET, EXTENDED RELEASE 25MG(アクセス日: 2024.04.22))。
- 今回プレスリリースで地裁がアステラスの請求却下を推奨したと報じられた「451特許」(2030年3月満了予定)
- 地裁が無効であると判決しアステラスが控訴している「780特許」(2030年3月満了予定)
- 用途特許(特許8,835,474及びRE44,872)および結晶特許(特許7,342,117及び7,982,049)(2024年5月満了予定)
- 特許8,772,315(「315特許」)(2029年4月満了予定)
「315特許」のclaim 5は以下のとおり、solifenacinとの併用の発明のようです。適応症の一つである”Overactive bladder (OAB) in adult patients with symptoms of urge urinary incontinence, urgency, and urinary frequency, either alone or in combination with the muscarinic antagonist solifenacin succinate.”を保護していると思われます。
FDAからLupin宛てに発出されたANDA APPROVAL LETTER(ANDA 209485)によると以下の記載があり、Lupinの後発品は「315特許」を回避したものとして承認されたようです。
“With respect to the ‘315 patent, your ANDA contains a statement under section 505(j)(2)(A)(viii) of the FD&C Act that this is a method-of-use patent that does not claim any indication for which you are seeking approval under your ANDA.”

所謂「Section VIII Label Carve-out」で「315特許」は争いになっていないのかな・・・
参考:
- 2022.09.29 Lupin press release: Lupin Receives Approval from U.S. FDA for Mirabegron Extended-Release Tablets
- 2024.04.22 Lupin press release: Lupin Launches Mirabegron Extended-Release Tablets in the United States

アステラス製薬は、XTANDI®(イクスタンジ)のパテントクリフも2027年以降に迫る中、ベタニス®/Myrbetriq®/Betmiga®のクリフも迫っている(?)となると、非常に厳しい経営とならざるを得ませんね・・・。米国での訴訟も含めてどうなるのか見守りましょう。


コメント
MyrbetriqのGranules for Extended-release Suspensionについても、2024年1月12日にANDA paraⅳ申請が1件あり、近い将来にANDA訴訟が始まると思われます。Granules for Extended-release Suspensionは、Extended-release Tabletsにはない小児適用(3 歳以上、体重 35 kg 以上の小児患者における神経因性排尿筋過活動 (NDO))を有します。
オレンジブック掲載特許は3件で、うち2件は上記Extended-release Tabletsと同じ結晶特許(特許7,342,117及び7,982,049)(2024年5月満了予定)で、1件が製剤特許US10,058,536(小児適用が2036年1月満了予定)ですので、この製剤特許がANDA訴訟に使用されるものと思われます。
情報ありがとうございます。