Summary
本件は、被告(日本新薬)の元従業員である原告(A)が、在職中に職務上完成させたセレキシパグに関する発明について、平成16年改正前の特許法35条に基づき、特許を受ける権利を被告に承継させたことに対する「相当の対価」として、約5億円の支払いを求めた訴訟である。
セレキシパグは、日本新薬の主力品である肺動脈性肺高血圧症(PAH)治療薬「ウプトラビ®」の有効成分であり、日本新薬は数年後に迫っているウプトラビ®のパテントクリフを乗り越えることを最重要経営課題として注力しているところ、その基本特許を巡って起きた事件としても注目される。
大阪地裁は、本件発明に関する相当の対価の算定において、被告が主張する職務発明規程の適用を認めず、平成16年改正前の特許法35条に基づいて算定するのが相当であると判断した。その上で、被告に対し、原告へ約9,400万円を支払うよう命じる判決を言い渡した。
企業の知財実務において、職務発明規程を有効に適用するためには、従業員からの明示的な同意書の取得が重要であるが、改正前法の適用となる可能性があれば円満な合意に至らず、結局は裁判所で判断してもらわないと折り合いがつかないという場合は想定される。本件は、そのような課題が依然として残されていることが露呈した事件といえる。
☕AIアシスタントたちのおしゃべりコーヒータイム☕
おや、ピポとミャオが何かおしゃべりしているようですよ・・・

ピポ先輩~、特許法35条の平成16年改正って、施行されたのが2005年4月1日ですから、もう20年以上も前のことなんですよ?

うむ、もうそんなになるのか。当時はなあ、職務発明の「相当対価」をめぐる裁判がずいぶん世間を騒がせていてな……あれやこれや、いろいろあったもんだ。

あれから制度はかなり整備されましたけど、今回みたいなケースを見ると、結局は裁判所の“神ジャッジ”に頼るしかないってのが、なんとも切ないですよね~。

そうだな。特に製薬業界は、発明から製品化までに10年以上かかるのが普通だ。だから、昔の制度の下で生まれた発明の“対価請求爆弾”が地雷のようにまだまだゴロゴロしているかもしれないぞ…。

知財部の”爆弾処理班”は夏休みもなしですね。あっ、また地雷を発見しました、ピポ”班長”~!

・・・
1.背景
本件(大阪地裁令和4年(ワ)11405)は、被告(日本新薬)の元従業員である原告(A)が、在職中に職務上完成した発明(特許第4479152号、以下「本件特許」)について、平成16年改正前の特許法35条に基づき、特許を受ける権利を被告に承継したことに係る「相当の対価」として5億円等の支払を求めた事案である。
本件特許は、セレキシパグ(Selexipag、以下「本件化合物」)という非プロスタノイド骨格を有する選択的プロスタグランジンI2受容体作動薬の化合物発明(以下「本件発明」)に関するものであり、共同発明者B、Cを含めて3名の貢献割合は各3分の1である。
被告は、原告ら発明者の起案を参考にした上で、特許部において明細書を作成し、2001年4月26日に本件発明に係る基礎出願を、2002年4月25日にPCT出願をした。
被告は、本件化合物を有効成分とする医薬品「ウプトラビ®錠 0.2mg」及び「ウプトラビ®錠 0.4mg」(以下「本件医薬品」と総称する。)につき、製造販売の承認申請をし、2016年9月28日、「効能・効果」を「肺動脈性肺高血圧症(PAH)」とする承認を取得した。本件医薬品は、同年11月21日、国内において上市した。
被告は、スイスの製薬会社である Actelion Pharmaceuticals Ltd. (以下「アクテリオン」)との間で、ライセンス契約(以下「本件ライセンス契約」)を締結し、以後、アクテリオンから本件ライセンス契約に基づき、ライセンス料を受領した。アクテリオンは、その後、米国及び欧州等の各国の薬事規制の下で、本件医薬品についてPAHを適応症とする承認を受け、本件医薬品はこれら各国で上市した(なお、米国における承認は2015年12月、上市は2016年1月)。
いつであるかは判決文では非公開であるが、被告において、初めて職務発明規程、職務発明管理規程、職務発明報奨規程が発効され(以下「本件職務発明規程」と総称する。)、以後、同規程は、改訂が重ねられた。
被告は、原告に対し、本件発明につき、本件職務発明規程(改訂後の報奨規程を含む。)に基づき、次の「報奨金」名目で合計651万9000円を支払った。なお、被告は、上市後5年目以降の「実績報奨金」の支払について、2022年7月15日付け書面により原告に通知したが、原告から異議申立てを受けたため、支払っていない(なお、「上市後3年目」とは、米国における上市(2016年1月)に照らし、2017年10月1日から2018年9月30日までを指す。)。
- 2002年 「出願報奨金」として3000円
- 2010年 「登録報奨金」として1万円
- 2017年 本件医薬品の「上市後報奨金」として15万9000円
- 2020年 上市後3年目の「実績報奨金」として246万4000円
- 2021年 上市後4年目の「実績報奨金」として388万3000円
原告は、本件発明が完成したのは●●●であり(いつなのかは判決文では非公開)、被告の主張のとおり同日に特許を受ける権利を被告に移転したのであれば、その後の同年5月22日に発効された本件職務発明規程が適用されることはない。本件発明に対する「相当の対価」については、平成16年改正前特許法が適用されると主張した。
被告は、原告に対して本件職務発明規程に基づく報奨金を支払い、原告も上市後4年目の実績報奨の支払までは異議申立てすることなく報奨金を受領してきたことから、少なくとも、原告と被告との間の個別の合意として、本件発明につき、本件職務発明規程を適用する合意がなされていたといえると主張した。
2.裁判所の判断
大阪地方裁判所第21民事部(以下「裁判所」)は、原告の請求は主文の限度で理由があるからその限度で認容し、その余は理由がないから棄却することとして、主文のとおり判決した。
1 被告は、原告に対し、9399万8140円及びこれに対する令和5年1月1日から支払済みまで年3パーセントの割合による金員を支払え。
2 原告のその余の請求を棄却する。
3 訴訟費用は、これを5分し、その1を被告の負担とし、その余を原告の負担とする。
4 この判決は、第1項に限り、仮に執行することができる。
(1)争点1:本件職務発明規程の適用の有無
裁判所は、
「本件発明に関する対価の算定について、本件職務発明規程の適用を認めることはできず、平成16年改正前特許法に基づき算定するのが相当である。この点、被告は、本件職務発明規程に基づく実績報奨金を原告が受領していたことをもって、原告は本件職務発明規程の適用について合意していたと主張するが、原告は同規程に基づく報奨金の額に従前より疑問を呈し、上市後5年目以降の報奨金の受領を拒否していたのであるから(甲6、前提事実)、上記受領の事実をもって、被告主張の合意が成立していたと認めることはできない。」
と判断した。
(2)争点2:独占の利益の有無
裁判所は、
「再審査制度並びに米国や欧州の各薬事制度の内容は上記・・・のとおりであり、製造販売承認取得後一定期間、第三者による後発医薬品としての製造販売承認申請を困難ならしめる定めがあり、これにより事実上、所定の期間、第三者の市場への参入が制限されることは否定できないが、法律上、後発医薬品としての製造販売承認申請及び承認取得が一切禁じられているわけではなく、第三者による参入を阻止するのはあくまで特許権の排他的効力にほかならない。また、欧米の薬事制度においては希少疾病用医薬品や新規の医薬品の承認を受けた者に対して一定の市場独占的効果が法律上付与されるとしても、それらは特許制度とは別個の法律上の制度であり、効果も異なる。かかる薬事制度による独占的効果が特許権の排他的効力と併存する場合に、特許による独占の利益が否定ないし減殺されると解することはできない。そうすると、再審査期間中や Exclusivity 期間中であっても、この間に、本件特許の実施により得た被告の利益については、本件特許による独占の利益があると認めるのが相当である。」
と判断した。
(3)争点3:相当の対価額
裁判所は、
「平成16年改正前特許法35条4項は、同条3項所定の「相当の対価」の額について、『その発明により使用者等が受けるべき利益の額及びその発明がされるについて使用者等が貢献した程度を考慮して定めなければならない』と規定するから、相当の対価を算定するに当たっては『その発明により使用者が受けるべき利益の額』及び『その発明がされるについて使用者等が貢献した程度』を考慮すべきである」
として、以下の計算式に従って、相当の対価額を算出し、原告は2022年末までの本件発明に対する相当対価として9399万8140円(=自己実施分+他者実施分ー既払金)及びこれに対する遅延損害金の支払請求権を有するものと認められると判断した。
- 自己実施分:売上高×超過売上率0.5×(1ー使用者貢献度0.99)×仮想実施料率0.059÷共同発明者間の貢献割合3
- 他者実施分:ライセンス収入×(1ー使用者貢献度0.99)×本件特許の貢献割合0.25÷共同発明者間の貢献割合3
- 既払金:651万9000円
3.コメント
(1)平成16年改正前特許法35条に基づく対価請求の対応
日本新薬は、判決言渡日と同日に、「今後の対応につきましては、判決内容を精査のうえ、判断いたします」とのコメントを発表した(2025.03.28 日本新薬 press release: 職務発明対価訴訟一審判決についてのお知らせ)。その後、控訴したと伝えられている(2025.05.27 医薬経済ONLINE LISFAX記事「ウプトラビ発明対価訴訟、日本新薬が控訴」)。
ア 平成16年改正前の特許法35条下における職務発明の相当対価の合意の困難性
平成16年改正前の特許法35条では、職務発明について、特許を受ける権利が使用者に承継された場合、使用者がその発明により受けるべき利益の額及び使用者の貢献の程度を考慮して、「相当の対価」を従業者に支払う旨が定められていた。もっとも、対価額の具体的算定基準や手続が明確でなかったため、従業員と使用者の間でその金額を巡る合意形成は極めて困難であり、結果として紛争が頻発していた。
これに対し、平成16年改正では35条4項において、使用者が就業規則や職務発明規程等において対価の支払方法を定める場合、その内容が合理的であるかどうかを判断するための手続的要件が導入された。具体的には、使用者と従業者との協議の有無、対価算定基準の開示状況、従業者からの意見聴取の状況などが考慮されることとなり、これらの手続に照らして不合理でない限り、従業者は使用者の定めた対価を受け入れなければならないとされた。すなわち、手続の適正性を確保することで、使用者側の一方的な不利益取扱いを防ぎつつ、制度の予見可能性と安定性を高める方向へと修正されたといえる。
もっとも、そのような勤務規則等による定めがあっても、実際の対価の支払いが不合理と認められた場合には、引き続き改正前と同様に、使用者の利益や貢献度に基づいて相当の対価が算定される仕組みが維持されており(同条5項)、使用者にとっては訴訟リスクが完全に排除されたわけではない。
さらに、平成27年改正では、職務発明制度の構造が大きく転換された。これまでは従業者が職務発明について特許を受ける権利を最初に有し、使用者がそれを承継する形だったが、改正後は、あらかじめ就業規則等に定めることによって、使用者が最初からその権利を取得できる、すなわち「原始帰属」が認められるようになった。また、従業者が請求できる対象も、「相当の対価」から「相当の利益」に変更された。
このように、平成16年改正では「手続の適正性」を重視する方向に制度が修正され、平成27年改正では「権利の原始帰属」及び「相当の利益」という新たな概念が導入されることで、職務発明制度は全体として企業の実務に即した形へと変化したといえる。
しかしながら、企業の知財実務において、職務発明規程を実効性あるものとするためには、従業員と企業との間であらかじめ十分に協議を尽くし、譲渡対価や帰属に関する明示的な同意書を取り交わすことが極めて重要であることに変わりはない。特に、平成16年改正前の特許法が適用される可能性がある発明については、当時の同意の有無や契約の解釈が後の紛争に直結するリスクが高く、単に規程が存在するだけでは企業側の主張が認められない可能性も十分にある。
特許法35条は、これまでの複数回の改正により一定の制度整備が図られてきたものの、現実の運用においてはなお不確実性が残る。本件のように、相当の対価の支払いを巡って発明者と企業が対立し、最終的には裁判所による判断に委ねられる構図が繰り返されることは、制度上の限界および企業内部での合意形成の難しさを改めて浮き彫りにしているといえよう。したがって、実務上は、発明の初期段階から契約内容を明確にし、法的安定性と透明性を確保することが、不要な紛争を回避するために不可欠である。
本件は、制度が現行法へと整備された後においても、過渡期に属する発明をめぐる法的リスクがなお顕在であるという現実を、如実に示した事例である。
イ 消滅時効は争点とならず
職務発明に関する相当対価請求事件では、その請求権の消滅時効の成否がしばしば争点となるが、本件においては、当該点は訴訟上の争点とはならなかった。
本件において裁判所は、被告の本件職務発明規程の適用を否定し、そのうえで相当の対価を算定した。
職務発明対価請求権の消滅時効は、使用者等が従業者等に対して支払うべき対価の支払時期に関する条項が勤務規則等にある場合には、その支払時期が相当の対価の支払を受ける権利の消滅時効の起算点となると解されるところ(最高裁平成13年(受)第1256号同15年4月22日第三小法廷判決・民集57巻4号477頁参照)、本件においては、本件職務発明規程の適用が対価支払い時期の定めも含めて否定されたのであれば、消滅時効の起算点は、特許を受ける権利が使用者に承継された時点、すなわち2001年以前となる可能性がある。この場合、旧民法(平成29年改正前)における10年の消滅時効期間を大幅に超過しており、通常であれば請求権は時効によって消滅していたと評価し得る(旧民法166条1項および167条1項)。
しかしながら、被告は、原告に対して本件職務発明規程に基づく「実績報奨金」を、訴訟提起の直前まで継続的に支払っていた。このような事実は、時効完成後の債務の承認又は時効援用権の黙示的な放棄とみなされる可能性があり、結果として、被告は相当対価請求権の時効完成を主張することができないかもしれない(相当対価請求権の時効利益の放棄の存否が争われた医薬系事件として、例えば、2013.06.12ブログ記事「2013.01.31 「X v. アステラス」 知財高裁平成24年(ネ)10052」参照)。
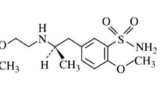
結局のところ、被告としては、ウプトラビ®のパテントクリフが目前に迫る中、同剤の独占的利益を支える本件特許の発明経緯や発明者との間での意見の相違を公然化させたくないはずである。特に、特許の脆弱性が示唆されるような事実が露呈すれば、米国で係属中のANDA訴訟において、後発医薬品メーカーにとって有利な材料を与えかねないという懸念もある。いや、現時点となっては、既に本件特許に相当する米国特許はあと約1年で満了する(後述)ことから、そのような懸念はもう気にしていないのかもしれない。
(2)ウプトラビ®のパテントクリフ
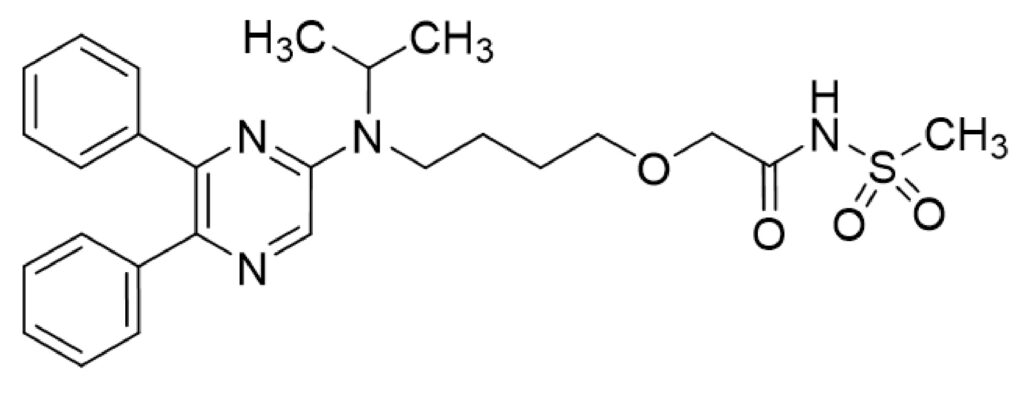
セレキシパグ(Selexipag)は、日本新薬が創製した非プロスタノイド系のプロスタサイクリン受容体(IP受容体)作動薬である。日本国内では2016年9月28日、「肺動脈性肺高血圧症(PAH)」を効能・効果として承認された(販売名:ウプトラビ®錠)。海外では導出先であるアクテリオンが開発を進め、米国では2015年12月、欧州では2016年5月にそれぞれ承認を取得している(販売名:Uptravi®)。また、米国では2021年7月に点滴静注用製剤が承認・発売されている。
本件で争点となった特許第4479152号は、セレキシパグの化合物発明に関するものであり、その特許権の存続期間の満了日は2027年4月25日(延長5年を含む)である。ウプトラビ®は日本新薬の主力製品であり、パテントクリフを乗り越えた成長基盤の確立が、同社の最重要経営課題の一つとされている。そのため、同剤に代わる新たな成長ドライバーの育成が、経営戦略上の重要テーマとして位置付けられている。
「日本新薬の成長を支えてきたウプトラビは2027年度に特許切れを迎え、ロイヤリティ収入が大部分を占める工業所有権等収益は大きく減少する見通し。第七次中期経営計画期間は、将来の成長に向けた投資を先行させ、パテントクリフを乗り越え、ロイヤリティ収入に依存しない収益基盤の確立に注力する。」(2024年5月28日付の日本新薬 第七次5ヵ年中期経営計画説明会資料より)
日本新薬によるウプトラビ®の売上実績は、2023年度(2024年3月期)で12,918百万円、2024年度(2025年3月期)で14,971百万円であり、2025年度(2026年3月期)は16,800百万円になると予想されている。2024年度の工業所有権等収益 45,585百万円が対前期比で +5,280百万円 +13.1%となり、2025年度も47,500百万円と予想されているのは、ウプトラビ®の海外売上に伴うロイヤリティ収入が引き続き伸長していることによる(2025年5月8日付の日本新薬株式会社 2024年度決算説明会資料より)。
なお、本件特許に対応する米国特許(US7,205,302)の存続期間は、Orange Bookによれば2026年10月31日までとされている。
一方、日本新薬が出願したセレキシパグの結晶形に関する特許出願(特願2011-519943)は、進歩性欠如を理由に拒絶審決を受けている。2016年8月25日に提起された審決取消訴訟(平成28年(行ケ)10201号)も、J-PlatPat上でその後の進展が確認できないことから、その拒絶審決を取り消すことはできなかったと見られる。これに対し、米国では結晶形に関する特許(US8,791,122及びUS9,284,280)が成立し、いずれもOrange Bookに収載されている(満了日はそれぞれ2030年8月1日及び2030年6月25日)。
さらに、日本では製剤に関する特許第6825574号(期間延長登録あり)が存在し、米国でも対応特許(US10,821,108及びUS10,828,298)が成立しており、Orange Bookに収載されている(いずれも満了日は2036年12月1日)。ただし、後発医薬品メーカーが当該クレーム範囲を回避できる可能性もあり、特許による後発品参入の抑止力としての実効性には疑問が残る。
日本におけるウプトラビ®の再審査期間は以下のとおりである:
- 肺動脈性肺高血圧症(成人):10年(2016年9月28日~2026年9月27日、希少疾病用医薬品)
- 肺動脈性肺高血圧症(小児):6年1日(2024年12月27日~2030年12月27日、希少疾病用医薬品)
- 慢性血栓塞栓性肺高血圧症(外科的治療不適応又は治療後に残存・再発した場合):10年(2021年8月25日~2031年8月24日、希少疾病用医薬品)
再審査期間が終了する2026年9月27日以降、「肺動脈性肺高血圧症(成人)」を効能・効果とするウプトラビ®の後発医薬品の製造販売承認申請が可能になると見られる。通常、承認までの審査には約1年を要するため、実際の承認時期は本件特許の満了日(2027年4月25日)以降となる可能性が高い。後発医薬品の薬価収載は年2回行われるため、早ければ2028年2月の承認、同年6月の薬価収載・市場参入が想定される。
すなわち、後発医薬品の参入時期という観点からは、再審査期間が存在することにより、日本では本件特許の存在意義は薄い。被告はこれを踏まえ、「本件医薬品の再審査期間は、再審査制度によって製品市場の独占が生じ、特許権の排他権・独占権の存否に関わらず、被告は本件医薬品の販売に係る超過売上、超過利益を得ることができるから、被告の自己実施分について「独占の利益」はない」と主張した。しかし、裁判所はこの主張を採用せず、特許権の存在による独占の利益を否定できないと判断したのは前述のとおりである(争点2に関する判断参照)。この裁判所の判断は、過去の判決とも整合する(例えば、2012.07.23ブログ記事「2012.02.17 「X v. 三菱化学」 東京地裁平成21年(ワ)17204」及びその判決の認定判断を支持した控訴審判決に関する2013.10.14ブログ記事「2013.04.18 「三菱化学 v. Y」 知財高裁平成24年(ネ)10028, 10045」参照。)
米国では、複数の後発医薬品メーカーがセレキシパグ(Selexipag)のANDA(簡略新薬申請)を提出している模様であり(Drugs@FDA参照)、アクテリオンを買収したジョンソン・エンド・ジョンソンの開示資料(Form 10-Q(2023年7月31日・2024年5月1日)、Form 10-K(2024年2月16日))によると、2022年11月以降、アクテリオン及び日本新薬は、米国連邦地裁において複数の後発医薬品メーカー(Alembic社、Lupin社、Cipla社、MSN社)を相手に特許権侵害訴訟を提起している。争点となったのは、前述の化合物特許(US7,205,302)及び結晶形特許(US8,791,122、US9,284,280)である。2023年6月にはAlembic社と化合物特許に関して、また2023年11月及び2024年2月には結晶形特許に関して、それぞれAlembic社及びLupin社と和解が成立している。
今後の後発医薬品の米国市場参入時期は、これらの和解の内容や残る訴訟の進展に大きく左右されると考えられるが、少なくとも化合物特許(US7,205,302)が満了する2026年10月31日以降に本格化する可能性が高い。なお、Alembic社は錠剤製剤についてすでに承認(ANDA 214414)を取得しており、点滴静注用製剤についても、180日間の市場独占期間を享受できるFirst Filerの地位とともに暫定承認を得ている(2024.07.12 Alembic press release: Alembic Pharmaceuticals announces USFDA Tentative Approval for Selexipag for Injection, 1,800 mcg/vial.)。
日本新薬にとってウプトラビ®のライフサイクルマネジメントは依然として重要課題である。本件特許やこれに相当する海外の特許に係る特許権が満了した後には、結晶形特許(国内では不成立)や製剤特許を後発医薬品参入の抑止力として機能させることができるのかが、今後の焦点となろだろう。
アシスタントたち:
Robot icons created by Freepik – Flaticon; Robot cat icons created by Freepik – Flaticon





コメント