Summary
本件は、東レが保有する特許権に係る存続期間延長登録に対して請求された無効審判において、特許庁が請求不成立とする審決をしたため、沢井製薬がその取消しを求めた訴訟である。
主な争点は以下の2点である。
- 「ナルフラフィン塩酸塩」を含有する本件医薬品(レミッチ®OD錠)が、「一般式(Ⅰ)で表されるオピオイドκ受容体作動性化合物を有効成分とする止痒剤」に該当し、本件発明の技術的範囲に属するか否か(取消事由1)
- 延長登録された期間が、承認(本件処分)を受けるために「その特許発明の実施をすることができなかった期間」を超えているか否か(取消事由2)
知財高裁は、2025年5月27日、審決に判断の誤りは認められないとして、沢井製薬の請求を棄却する判決を言い渡した。
本判決において注目すべきは、取消事由2に関する判断である。裁判所は、OD錠の承認審査において、先行するカプセル剤に関する複数の臨床試験が実質的に評価資料として用いられていたことを踏まえ、それらの試験期間も「その特許発明の実施をすることができなかった期間」に含まれるべきであると認定した。特許権の存続期間延長対象となる期間の認定において実務上重要な指針を示したものといえる。
☕AIアシスタントたちのおしゃべりコーヒータイム☕
おや、ピポとミャオが何かおしゃべりしているようですよ・・・

でもやっぱり、延長期間に先行カプセル剤の試験期間まで含めるって、やりすぎじゃない?OD錠の承認に直接必要だった試験期間だけにすべきじゃないの?

ピポ先輩~、たとえば映画制作で考えてみたんですが…ある映画会社が最初に第1作を作るとき、キャラクター設定や世界観づくりに莫大な時間とコストをかけますよね。

うん、最初が一番大変だな。

その設定がしっかりしてるからこそ、続編はスムーズに作れるしヒットもするわけですよね。続編だけの撮影期間しか評価されないとしたら、「あの土台を作るためにかけた時間と労力はどうなるの?」って話になりますよねー。

たしかに…1作目がなかったら続編も作れないわけだし。

医薬品でも同じで、OD錠の承認は、先行カプセル剤の試験データという土台があったから可能になったんじゃないかと思ったんです。その試験期間を延長期間に入れないのは、「続編は短期間で済んだから、それだけ評価すればいい」というのと同じで不公平なんじゃないですか。

作り手が同じなら、全体の努力をちゃんと見てあげないと理屈に合わないってわけか。

はい。だから、裁判所も「先行の努力は後行にも不可欠だった」として、その分も延長期間に含めていいと判断したんじゃないですかねー。

なるほど。劇場版「鬼滅の刃」の続編がこれだけヒットし続けているのも、これまでのストーリーがあってこそだしな。まさに、特許権の延長期間の算入の考え方は、すべての呼吸の基礎「始まりの呼吸」を編み出した最初の剣士の「型」が、後続の様々な「呼吸」の基礎になったのと同じで、最初の死ぬほどの努力が受け継がれてきたからこそ、真の価値として評価されるってわけだ!

・・・(その例え、合ってる?)
1.背景
本件(知財高裁令和6年(行ケ)10033)は、東レ株式会社(被告)が保有する、「止痒剤」を発明の名称とする特許権(特許第3531170号、出願日:1997年11月21日、登録日:2004年3月12日)に係る存続期間延長登録(以下「本件延長登録」)について、沢井製薬株式会社(原告)が、本件延長登録に対し無効審判(無効2021-800083号事件)を請求したが、特許庁はその請求を不成立とした審決(以下「本件審決」)をしたため、その取消しを求めた訴訟である。
争点は、旧特許法125条の2第1項1号及び3号(現行法125条の3第1項1号及び3号)に基づく無効理由の有無である。
平成28年法律第108号(平成30年12月30日施行)による改正前の特許法(旧特許法)の条文
(存続期間)
第六十七条 特許権の存続期間は、特許出願の日から二十年をもつて終了する。
2 特許権の存続期間は、その特許発明の実施について安全性の確保等を目的とする法律の規定による許可その他の処分であって当該処分の目的、手続等からみて当該処分を的確に行うには相当の期間を要するものとして政令で定めるものを受けることが必要であるために、その特許発明の実施をすることができない期間があつたときは、五年を限度として、延長登録の出願により延長することができる。
(延長登録無効審判)
第百二十五条の二 特許権の存続期間の延長登録が次の各号のいずれかに該当するときは、その延長登録を無効にすることについて延長登録無効審判を請求することができる。
一 その延長登録がその特許発明の実施に第六十七条第二項の政令で定める処分を受けることが必要であつたとは認められない場合の出願に対して されたとき。
二 その延長登録が、その特許権者又はその特許権についての専用実施権若しくは通常実施権を有する者が 第六十七条第二項の政令で定める処分を受けていない場合の出願に対してされたとき。
三 その延長登録により延長された期間がその特許発明の実施をすることができなかつた期間を超えているとき。
四 その延長登録が当該特許権者でない者の出願に対してされたとき。
五 その延長登録が第六十七条の二第四項に規定する要件を満たしていない出願に対してされたとき。
2~4 (略)
本件特許の請求項1(本件発明1)は、「一般式(Ⅰ)で表されるオピオイドκ受容体作動性化合物を有効成分とする止痒剤」とするものである。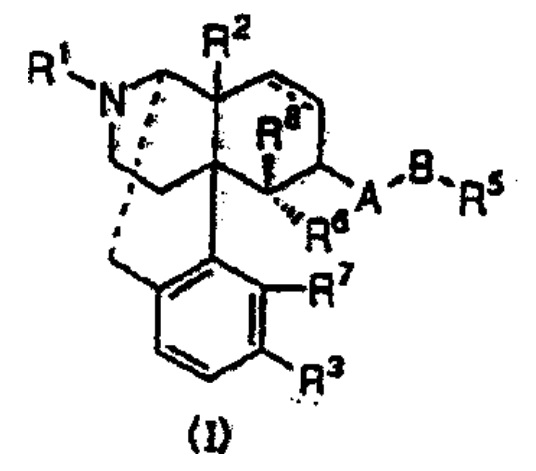

旧特許法125条の2第1項1号に関する争点では、請求項の「オピオイドκ受容体作動性化合物を有効成分とする止痒剤」という特定事項に注目。
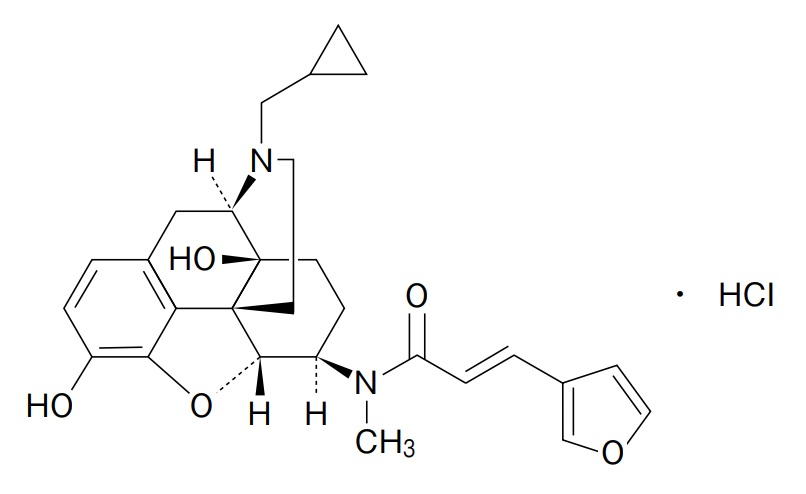
被告(東レ)は、ナルフラフィン塩酸塩を有効成分とする経口止痒剤「レミッチ®OD錠2.5μg」(以下「本件医薬品」)について、「次の患者におけるそう痒症の改善(既存治療で効果不十分な場合に限る)血液透析患者、慢性肝疾患患者」を効能・効果として、2017年3月30日(以下「処分を受けた日」)に薬機法に基づく製造販売承認(以下「本件承認」)を取得した。そして、同承認に基づき、同年6月29日、本件特許権について延長登録出願(出願番号:2017-700154号)を行った。OD錠とは、口腔内崩壊錠(Orally Disintegrating Tablets)の略である。

旧特許法125条の2第1項3号に関する争点では、「レミッチ®OD錠2.5μg」の本件承認のために、「レミッチ®カプセル2.5μg」の臨床試験等資料が提出されたという背景に注目。
当初、本件延長登録出願に対しては特許庁が拒絶する審決をしたが、知財高裁がこれを取り消したことにより、2021年8月11日、特許庁は本件延長登録(延長期間:4年11月26日)を認めたという経緯がある。この経緯については、以下のブログ記事を参照されたい。
- 2021.04.18ブログ記事「2021.03.25 「東レ v. 特許庁長官」 知財高裁令和2年(行ケ)10063」
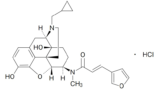
その後、2021年9月、原告(沢井製薬)は本件延長登録に対して無効審判(無効2021-800083号)を請求し、2024年2月28日、特許庁は請求不成立とする審決(以下「本件審決」)を下した。
本件審決は、以下の理由により、本件延長登録は旧特許法125条の2第1項1号及び3号(現行法125条の3第1項1号及び3号)に基づく無効理由には該当しないと判断した(なお、無効理由2については本件訴訟では争点とされていないため、ここでは割愛する)。
(1)無効理由1(旧特許法125条の2第1項1号)について:本件医薬品は、ナルフラフィンがオピオイドκ受容体作動薬として作用することを利用して止痒剤として用いられている。したがって、請求項1の「オピオイドκ受容体作動性化合物を有効成分とする止痒剤」に該当し、本件処分は本件発明1の実施に必要であったと認められる。よって、無効理由1には該当しない。
(2)無効理由3(旧特許法125条の2第1項3号)について:本件処分に際しては、「レミッチ®カプセル2.5μg」の承認申請時に提出された臨床薬理試験の評価資料が利用され、これが審査対象となったうえで承認が得られた。したがって、少なくとも特許設定日以降に行われた当該試験の期間は、特許発明の実施ができなかった期間に含まれる。よって、無効理由3にも該当しない。
なお、本件とは別に、本件特許権を巡る侵害訴訟も知財高裁に係属しており、同日(2025年5月27日)に判決が言い渡されている。沢井製薬及び扶桑薬品工業に対し、東レが提起した特許権侵害訴訟において、東レの主張が認められ、高額な損害賠償を命じる内容であった(詳しくは以下のブログ記事を参照)。
- 2025.05.27ブログ記事「東レ、レミッチ®用途発明に係る延長特許権侵害訴訟で勝訴 知財高裁が沢井製薬・扶桑薬品工業に巨額賠償を命令」

2.裁判所の判断
知的財産高等裁判所第2部(以下「裁判所」)は、本件審決に判断の誤りはなく、原告(沢井製薬)の請求は理由がないからこれを棄却するとして、主文のとおり判決した。
1 原告の請求を棄却する。
2 訴訟費用は、原告の負担とする。
以下、裁判所の判断理由のうち、主たる部分を抜粋して紹介する。
(1)取消事由1:旧特許法125条の2第1項1号
争点(取消事由1)は、「ナルフラフィン塩酸塩」を成分に含む本件医薬品(レミッチ®OD錠)が、請求項1に記載された「一般式(Ⅰ)で表されるオピオイドκ受容体作動性化合物を有効成分とする止痒剤」に該当するか、すなわち本件発明の技術的範囲に属し、その実施に本件処分(本件承認)が必要だったかどうか、である。
まず、裁判所は「有効成分」という用語について、以下のように判断した。
「「有効成分」の用語は、・・・本件特許出願の日の前後を通じて、体内(血中)で溶出し薬理作用を発揮する化学物質の意味で用いられる場合が一般的に見られていたものであり、本件明細書において、これと異なる解釈をとるべき理由は見当たらない。確かに、製剤開発の観点から、最終的に所望の溶解度、安定性を得るために酸付加塩の形態にしたものを原薬とし、配合目的が添加剤(甲96参照)である構成成分と区別するために、酸付加塩の形態を含めて「有効成分」と呼ぶ取扱いが存在することは認められるが、付加された塩の部分が体内で薬理作用を発揮する化学物質になるわけではない。」

医薬品に配合される添加剤と区別するため、酸付加塩の形態を含めて「有効成分」と呼ぶ実務上の運用がありますが、本件明細書の記載や技術常識に照らせば、「有効成分」とは薬理作用を発揮する化学物質を指すと理解するのが自然です。裁判所も、「そのような実務の運用があるとしても、それは薬機法の解釈運用の問題にすぎず、本件発明における『有効成分』の解釈は、あくまでも特許法の観点から、特許請求の範囲に基づいて判断されるべきである」と述べています。
この判断を前提として、裁判所は「酸付加塩」の形態で配合された医薬品と請求項1との関係について、次のように認定した。
「製剤開発の分野で、添加剤と区別するため、化合物とその薬理学的に許容される酸付加塩を含めて「有効成分」と呼ぶ場合があることを踏まえたとしても、当業者において、請求項1に「オピオイドκ受容体作動性化合物を有効成分とする止痒剤」とだけ記載されていることを理由に、その趣旨が、「これと薬理学的に許容される酸付加塩」は、本件発明1でいう有効成分には当たらず、特許の技術的範囲外であると解釈するとは考えられない。止痒剤に関する特許において、合理的理由もないのに、わざわざ酸付加塩の形態という薬としての溶解性や安定性を向上させるために通常よく用いられる構成を除外して、特許請求の範囲を決めることは不自然だからであり、むしろ、本件明細書の前記各記載によれば、「κ受容体作動性化合物の薬理学的に許容される酸付加塩」の形態は、κ受容体作動性化合物を有効成分とする止痒剤の実施形態の一つであることを容易に理解することができるというべきである。」

当該酸付加塩の形態で配合された止痒剤は、「κ受容体作動性化合物を有効成分とする止痒剤」の実施形態の一つ。
さらに、裁判所は、補正により「酸付加塩」の文言が請求項1の記載から欠落した点について、次のように判断した。
「本件特許の出願経過を参酌しても、被告は、本件補正により、補正前の請求項3の一般式(Ⅰ)を含む発明を補正後の請求項1に補正し、その際「またはその薬理学的に許容される酸付加塩」の文言を欠落させたことが認められるが、拒絶理由通知(甲28)においては、補正前の請求項3は拒絶の対象にされておらず、被告の意見書(甲29)においても、一般式(Ⅰ)の化合物に対する言及を含め、補正後の請求項1において「またはその薬理学的に許容される酸付加塩」の文言を欠落させたことについての説明はされていない。そうすると、本件特許の出願経過において、被告が、本件補正の際に、補正後の請求項1から「酸付加塩」の文言を意識的に除外したと認めることはできないというべきである。」

本件補正による文言欠落は、出願人にとって「意図しない」ことだったことは容易に想像できます。この経緯だけをもって、本件発明の技術的範囲から「意識的に」除外したとするのは酷すぎますよね(そもそも特許請求の範囲に基づいて上記のように判断されたなら、この点は議論するまでもなかったのでは・・・)。
以上を踏まえ、裁判所は、本件発明1の解釈について、
「特許請求の範囲及び本件明細書の記載、本件特許の出願経過及び本件特許出願日当時の技術常識によれば、本件発明1は、酸付加塩の形態をとるか否かにかかわらず、一般式(Ⅰ)で表される化合物が、生体内において吸収され、そのオピオイドκ受容体作動性という属性に基づき「有効成分」としての薬理作用を発揮するような止痒剤をいうものと解するのが相当である。」
「本件医薬品は、生体内において吸収され、オピオイドκ受容体作動性という属性に基づき止痒作用を及ぼし薬効を奏するナルフラフィンが、その酸付加塩であるナルフラフィン塩酸塩の形態で配合された医薬品であると認められるから、本件医薬品は、本件発明1の「一般式(Ⅰ)で表されるオピオイドκ受容体作動性化合物を有効成分とする止痒剤」の発明特定事項を備えるものと認められる。」
として、本件医薬品は特許発明の技術的範囲に属し、その製造販売には本件処分を受ける必要があったと認定した。
したがって、本件審決の判断に誤りはなく、原告の主張する取消事由1(旧特許法125条の2第1項1号)には理由がないと結論付けた。
(2)取消事由2:旧特許法125条の2第1項3号
争点(取消事由2)は、本件延長登録により延長された期間(4年11月26日)が、本件処分を受けるために「その特許発明の実施をすることができなかつた期間」を超えているか否か(旧特許法125条の2第1項3号)である。
原告は、この期間の起算点はOD錠に係る生物学的同等性試験の開始日であるとし、延長対象期間は1年11月26日に過ぎないと主張した。
これに対して裁判所は、まず、被告によってカプセル剤に関して実施された複数の臨床試験が、最終的にOD錠(本件医薬品)の承認申請においても評価対象とされ、製造販売承認に必要な資料として審査に用いられたと認定した。
「本件処分に係る本件医薬品(レミッチOD錠2.5μg)の承認申請においては、「剤形追加に係る医薬品」の承認申請時に提出を求められる「生物学的同等性」資料だけでなく、既承認医薬品につき実施されたこれらの試験に関する記載のある添付文書(案)や、既承認医薬品(レミッチカプセル2.5μg等)に関する審査報告書等の資料が提出されたことで、被告の行った前記ウの各臨床試験が、本件処分に係る医薬品の有効性及び安全性を検証及び確認するために必要な資料として各審査時点で評価試料として審査に用いられ、その結果、本件医薬品について「次の患者におけるそう痒症の改善(既存治療で効果不十分な場合に限る)血液透析患者、慢性肝疾患患者」との用途で承認されたことが推認され、これを覆すに足りる証拠はない。」
以上を前提として、裁判所は、「承認を受けるのに必要な試験を開始した日」は、C82001試験(軟カプセル剤を用いて健康成人を対象とした臨床試験(経口単回投与試験))の治験計画変更届出日の1998年3月17日であり、 その後、各試験が行われてきたところ、本件特許権設定登録日は2004年3月12日であるので、本件特許権の設定登録日以降の各試験期間を考慮すると、本件延長登録を認めることが可能な期間は、以下の①から⑤までの各期間の合計になると判断した。
- ①本件特許権の設定登録日から820CPC01試験(代償性肝硬変患者を対象とした臨床薬理試験)の終了届出日まで(10月13日)。
- ②820UPC04試験(血液透析患者を対象とした臨床試験(検証的試験))の治験計画届出日から820UPC05試験(血液透析患者を対象とした臨床試験(長期投与試験))の治験終了届出日まで(2年8月22日)。
- ③820HPC01試験(慢性肝疾患患者を対象とした臨床試験(第Ⅱ相試験))の治験計画届出日から治験終了届出日まで(2年3月10日)。
- ④820HPC04試験(慢性肝疾患患者を対象とした臨床試験(長期投与試験))の治験計画届出日から治験終了届出日まで(3年4月19日)。
- ⑤820BED01試験(健康成人を対象としたナルフラフィン塩酸塩の口腔内崩壊錠と軟カプセル剤との生物学的同等性を確認するための生物学的同等性試験)の治験依頼日から本件医薬品製造販売承認日の前日まで(1年11月26日)。
以上を踏まえ、裁判所は、本件延長登録によって延長された期間(4年11月26日)は、前記の各期間を合計した期間内に収まるものであるから、本件処分を受けるために特許発明を実施することができなかった期間を超えるものということはできないと判断した。

本件処分に係る医薬品の有効性及び安全性を検証及び確認するために必要な資料として審査に用いられた各臨床試験が何であったかが検討されたわけですね。
原告は、「被告がOD錠として実施する意思や能力がありながら実施することができなかった期間の開始日は、OD錠として初めての試験である生物学的同等性試験の開始日とすべきである」と主張した。しかし、裁判所はこれを退けた。
「被告は、当初からカプセル剤とOD錠を包含する経口剤の開発を企図していたことが推認され、前記生物学的同等試験の開始日まではOD錠として特許発明を実施する意思及び能力がなかったものと認めることはできない」

「特許発明を実施する意思及び能力がなかった」という具体的な事情が明確に立証できていない以上、裁判所は原告の主張を採用することはできないと判断しました。
また、原告は、「カプセル投与を定めた臨床試験の計画書には、OD錠(カプセル以外の剤形)の記載はなく、企業は計画書に拘束されず自由にその研究をすることができるから、カプセルに関する試験期間を、OD錠に係る処分を受けるための試験期間に算入することはできない」と主張した。
しかし、裁判所は、以下のとおり、原告の主張を採用することはできないと判断した。
「カプセル剤に関する臨床試験は、OD錠である本件医薬品と内容を同じくする有効成分について、その薬理作用に関する試験として実施されたものであり、本来、当初からカプセル剤ではなく、OD錠の承認を求める場合には、当然に必要とされていたはずのものである。現に、カプセル剤に関する試験結果や効能・効果等に関する審査経過は、OD錠である本件医薬品に係る本件処分の承認申請手続においても資料が提出されて審査対象とされたことが認められる。そうすると、カプセル剤に関する臨床試験は、本件処分を受けるためにも必要なものであったと評価し得る一方、本件において、その試験期間を「前記政令で定める処分を受けるために特許発明を実施することができなかった期間」に算入することが不合理であることを窺わせるような個別具体的な事情は見当たらない。」

本件医薬品の承認審査では、カプセル剤の臨床試験成績がなければ承認は得られなかったと考えられます。実際、承認申請手続でもカプセル剤の資料が提出され審査対象となっていることから、これらの臨床試験は本件処分を受けるために必要なものであったと評価できるということですね。
また、「OD錠の承認に伴う本件延長登録に軟カプセル剤の臨床試験期間を再度算定することは、実質的に2重に臨床試験期間を回復することになり制度趣旨に反する」との原告の主張に対しても、裁判所は以下のように明確に否定した。
「医薬品における「前記政令で定める処分を受けるために特許発明を実施することができなかった期間」は、薬機法に基づく当該医薬品の承認手続の内容、承認による禁止解除の範囲についての解釈を踏まえ、特許法の観点から個別に判断されるものであるから、本件医薬品の延長登録に関し、およそ既承認の医薬品の臨床試験期間を考慮することが許されないなどということはできない。
軟カプセル剤の承認による禁止解除の範囲は当該軟カプセル剤の剤形に限定され、直ちにはOD錠には及ばないのであり、原告において、同じ有効成分・分量、用法・用量及び効能・効果であっても、軟カプセル剤の承認を受けただけで、本件処分等を受けることなくOD錠の剤形で本件特許を実施することができるわけではない。少なくとも、本件の事実関係に照らすと、前記⑵ウに示された各試験が「承認を受けるのに必要な試験」であったと認められることは、前記⑶イのとおりである。」

『その特許発明の実施をすることができなかった期間』という文言を素直に読めば、こう解されるということですね。
3.コメント
本件は、特許権の存続期間延長制度における延長登録の処分必要性要件(旧特許法125条の2第1項1号)及びその特許発明の実施をすることができなかった期間(旧特許法125条の2第1項3号)に関して争われた事例である。
(1)「有効成分」の解釈
本件延長登録に関して「有効成分」の解釈が争われた本件とは別に、同特許権については以下の審決取消請求事件が存在し、既に、裁判所は、いずれの事件についても原告(東レ)にとって有利な判決を下していた。
- 2021.03.25 「東レ v. 沢井製薬・ニプロ」 知財高裁令和2年(行ケ)10098(知財高裁第2部):レミッチ®OD錠の特許権の存続期間の延長登録「腹膜透析患者のそう痒症」についての無効審決部分を取消す判決。知財高裁は、特許権の存続期間延長制度の趣旨に照らして、実質的に登録可否を判断すべきであるとの一般原則を示したうえで、本件においては、実質的には、効能・効果を生ぜしめる成分はフリー体の「ナルフラフィン」であるから、「ナルフラフィン」も本件医薬品の有効成分であると認め、従って、本件発明(「ナルフラフィン」のフリー体)の実施に本件処分を受けることが必要であった、と判断した。
- 2021.03.25 「東レ v. 沢井製薬・ニプロ」 知財高裁令和2年(行ケ)10097(知財高裁第2部):レミッチ®カプセルの特許権の存続期間の延長登録「腹膜透析患者のそう痒症」についての無効審決部分を取消す判決。知財高裁は、特許権の存続期間延長制度の趣旨に照らして、実質的に登録可否を判断すべきであるとの一般原則を示したうえで、本件においては、実質的には、効能・効果を生ぜしめる成分はフリー体の「ナルフラフィン」であるから、「ナルフラフィン」も本件医薬品の有効成分であると認め、従って、本件発明(「ナルフラフィン」のフリー体)の実施に本件処分を受けることが必要であった、と判断した。
- 2021.03.25 「東レ v. 沢井製薬・ニプロ」 知財高裁令和2年(行ケ)10096(知財高裁第2部):ノピコール®カプセルの特許権の存続期間の延長登録「慢性肝疾患患者のそう痒症」についての無効審決を取消す判決。知財高裁は、特許権の存続期間延長制度の趣旨に照らして、実質的に登録可否を判断すべきであるとの一般原則を示したうえで、本件においては、実質的には、効能・効果を生ぜしめる成分はフリー体の「ナルフラフィン」であるから、「ナルフラフィン」も本件医薬品の有効成分であると認め、従って、本件発明(「ナルフラフィン」のフリー体)の実施に本件処分を受けることが必要であった、と判断した。
- 2021.03.25 「東レ v. 特許庁長官」 知財高裁令和2年(行ケ)10063(知財高裁第2部):レミッチ®OD錠の特許権の存続期間の延長登録出願「血液透析患者、慢性肝疾患患者のそう痒症」の拒絶審決を取消す判決。「ナルフラフィン塩酸塩」のみを本件医薬品の有効成分と解し、「ナルフラフィン」は本件医薬品の有効成分ではないと認定して、本件発明の実施に本件処分を受けることが必要であったとはいえないと判断した本件審決の認定判断は、誤りであると知財高裁は判断した。
本件での裁判所の判断は、これらの結論を踏襲するものだったといえる。
例えば、本件延長登録出願(レミッチ®OD錠「血液透析患者、慢性肝疾患患者のそう痒症」)に係る拒絶審決取消請求事件(2021.03.25 「東レ v. 特許庁長官」 知財高裁令和2年(行ケ)10063)で、裁判所は、
本件処分の対象となった本件医薬品の有効成分は,本件承認書に記載された「ナルフラフィン塩酸塩」と形式的に決するのではなく,実質的には,本件医薬品の承認審査において,効能,効果を生ぜしめる成分として着目されていたフリー体の「ナルフラフィン」と,本件医薬品に配合されている,その原薬形態の「ナルフラフィン塩酸塩」の双方であると認めるのが相当である。
と判断している。
本件において裁判所は、「有効成分」という用語を「体内で薬理作用を発揮する化学物質」と解釈し、酸付加塩の形態で配合された止痒剤についても、「オピオイドκ受容体作動性化合物を有効成分とする止痒剤」の実施形態の一つに該当すると判断した。
原告は、薬機法の実務運用においてフリー体と酸付加塩がそれぞれ別個に承認されることを根拠に、酸付加塩は本件発明の技術的範囲に含まれないと主張した。
しかし、裁判所は、このような薬機法に基づく承認制度上の扱いは、「薬機法の解釈運用の問題」にとどまり、特許法における技術的範囲の解釈とは明確に切り分けられるべきだと述べた。
この判断は、特許法と薬機法の目的・規制対象が異なるため、それぞれの法律の観点から独立して判断されるべきだという原則を再確認したものであるように思われる。とりわけ、特許権の存続期間延長制度は、薬機法に基づく「処分」(製造販売承認)を前提とする点で、両法の交差点に位置する制度であることから、特許請求の範囲の解釈と条文上の「処分」要件該当性判断の双方において、両法の関与が不可避となる。今後の実務でも慎重な検討が求められるであろう。
本判決および他の知財高裁判決に照らすと、「『オピオイドκ受容体作動性化合物を有効成分』とする止痒剤」との記載は、本件明細書の記載内容や出願時の技術常識を踏まえる限り、「ナルフラフィン塩酸塩を原薬とする止痒剤」であっても、「ナルフラフィンのフリー体又は他の塩を原薬とする止痒剤」であっても、いずれも体内でナルフラフィンとして薬理作用を発揮するのであれば、結局は「『ナルフラフィンを有効成分』とする止痒剤」として技術的範囲に含まれると評価され得る。
もっとも、ここから直ちに、「○○化合物を有効成分とする医薬」という文言を含む特許権について、その化合物のプロドラッグを原薬とする医薬にも当然に特許権の効力が及ぶと結論づけるのは妥当ではない。プロドラッグのように体内で代謝を経て薬理活性を示す形態については、当該特許明細書の記載内容や出願当時の技術常識を基に、当業者がプロドラッグへの適用可能性を想定できたかどうかを個別具体的に判断すべきであろう。
(2)延長期間の算定
本判決において裁判所が示した重要なポイントは、取消事由2に関する判断にあり、延長期間の算定において、カプセル剤に関する複数の臨床試験がOD錠の承認審査に実質的に用いられたことを踏まえ、「特許発明の実施をすることができなかった期間」(旧特許法125条の2第1項3号。以下「実施不能期間」)の起算点をカプセル剤の試験時まで前倒しすることを妥当であるとした点にある。これは、特許権の存続期間延長制度の運用実務にとって重要な指針となる。
本判決は、同一の有効成分に関する先行処分のために得られた臨床試験データが、後行処分の審査において不可欠な評価資料とされたことから、その先行処分を受けるために必要であった試験期間も「実施不能期間」に含まれると判断した。そして、当該試験期間を除外すべき特段の不合理が認められない限り、後行処分のために必要な期間として算入されるべきであると明確に述べている。
これに対して原告は、「実施不能期間」は「特許発明を実施する意思及び能力があってもなお実施できなかった期間」であるから、その起算点はOD錠に係る試験の開始日であるべきと主張した。この「意思及び能力」という概念は、パシーフ事件判決(知財高裁)が旧特許法67条の3第1項1号の文脈で示した言い回しに依拠していると考えられる(ただし、上告審である最高裁はこの点について言及していない)。
しかし、パシーフ事件判決(知財高裁)における「特許発明を実施する意思及び能力」は、旧法67条の3第1項1号(処分必要性要件)に関する議論において示されたものであり、同じ条項の3号(実施不能期間)の解釈に直接適用すべき要件であるかどうかは確立した解釈ではない。実際、当該判決においては、「本件先行処分を受けた者が,本件特許権の特許権者である原告でもなく,専用実施権者又は登録された通常実施権者でもないことは,当事者間に争いがなく,本件先行処分によって禁止が解除された先行医薬品の製造行為等は本件発明の実施行為に該当するものではない」との判断を導くための文脈で用いられており、延長期間の算定において「意思」や「能力」を指標として取り入れることには論理的飛躍があるように思われる。仮にこれらを3号に適用する場合でも、「意思」の有無をどのような客観的基準で評価するのかが不明確であり、運用上の混乱を招くおそれがある。この点については、清水紀子 「医薬品等の特許権存続期間延長登録出願における「特許発明の実施をすることができなかった期間」を算定するために参酌すべき試験ー特許法第67条の7第1項第3号の解釈ー」 (北海道大学情報法政策学研究センター 知的財産法政策学研究 Vol.55 (2020))において詳細且つ有用な検討がなされているが、「特許発明を実施する意思及び能力」を指標に取り入れる解釈には同意できない。
本判決により、同一の有効成分に関する先行処分のために得られた臨床試験データが後行処分の承認審査において評価資料として不可欠である限り、その試験期間は「実施不能期間」に算入され得ることが明示された。これは、延長期間の起算点に関する不透明さの一部を払拭するものである。しかしながら、先行処分に用いられたデータが後行処分においても、提出されただけでなく評価されたのかどうか、さらにそれが実質的に評価されたのかどうかについて、これらの実質的な評価の内容についてまでも特段の不合理な事情を拾い出す余地があるのかどうか、依然として「処分を受けるために必要な期間」の認定に関する解釈には、個別事例によっては一定の不確実性が残るようにも思われる。今後、当該期間に不合理な要素が含まれているか否かをめぐる特許紛争が続くようであれば、米国(21 C.F.R. Part 60)と同様に、処分を所管する行政機関(日本においては厚生労働省)に「必要な期間」の認定権限を与える制度改革が検討される余地があるのかもしれない。
また、原告が主張した「二重回復」問題についても、裁判所は「剤形ごとの禁止解除」という考え方を採用した。すなわち、同じ有効成分であっても、異なる剤形はそれぞれ個別の承認手続きを要し、それに伴う実施不能期間も独立して発生するため、それぞれを個別に回復対象とするという本制度の趣旨と整合的であると判断された。
以上のように、本判決は、既存有効成分を用いた新規剤形や新規適応症追加等の開発を検討する製薬企業にとって、既にある特許権の価値を延長登録によって活用できる可能性を明確化するものであり、知財戦略上の意義は大きいといえる。
また、同日言い渡された特許権侵害訴訟判決と併せて、本判決は、日本における特許権の存続期間延長制度の実効性に一定の明確性を与えるものとなったと評価できる。
アシスタントたち:
Robot icons created by Freepik – Flaticon; Robot cat icons created by Freepik – Flaticon






コメント
こんにちは。いつも貴重な分析をありがとうございます。
期間の計算に関して、本判決は、ご抽出いただいた箇所の「被告の行った前記ウの各臨床試験が、本件処分に係る医薬品の有効性及び安全性を検証及び確認するために必要な資料として<<各審査時点で評価試料として審査に用いられ>>、その結果、本件医薬品について~承認された」としています。
ですので、私は、その試験が、<<先行処分での審査時点で評価資料とされたこと>>と、そもそも、後行の本件承認申請が該先行処分があった上でのものであることの根拠(該先行処分に係る審査報告書=評価資料とされたことが記載されていること、を提出したこと等)が示されていること、を要件としているもののように拝見しました。
つまり、御コメント欄3(2)でご指摘の「同一の有効成分に関する先行処分のために得られた臨床試験データが、<<後行処分の審査において不可欠な評価資料とされた>>こと」とは、判決に示されていないように思いました(「先行処分の」審査において不可欠な評価資料とされていたから、ではないかと・・・)
いかがご覧になりますか?
貴重なコメントを頂きありがとうございました。
ご指摘の<<各審査時点で評価試料として審査に用いられ>>の部分につきまして、私は、<<各審査>>とは(「各」と述べていることから)、「先行処分」及び「本件処分」の各々での審査を指し、<<先行処分(はもちろんのこと)及び本件処分の審査時点で(も)評価資料として審査に用いられ>>と理解しております。
以上の理解から、私は、「先行処分のために得られた臨床試験データが、(厚労省における)<<本件処分(=後行処分)の審査において(も)不可欠な評価資料とされた>>こと(が推認されること)から、(本判決は)・・・と判断した。」と解釈しました。
なお、「カプセル剤に関する臨床試験は、・・・本来、当初からカプセル剤ではなく、OD錠の承認を求める場合には、当然に必要とされていたはずのものである。・・・カプセル剤に関する臨床試験は、本件処分を受けるためにも必要なものであったと評価し得る・・・」と述べている部分からも、裁判所は、<<本件処分(=後行処分)の審査において(も)不可欠な評価資料とされた>>」ことの推認に基づいて、判断していると思われます。
ご指摘のお返事になっていますでしょうか。