ベルケイド®(凍結乾燥粉末形態のボルテゾミブ(Bortezomib)のマンニトールエステル)に関する特許: 知財高裁平成30年(行ケ)10158 (A事件); 10113 (B事件)
1.背景
 本事件は、「ボロン酸化合物製剤」に関する特許(第4162491号)の無効審判において特許庁がした請求不成立審決及び無効審決(無効2016-800096)に対して、特許権者(アメリカ合衆国)及び審判請求人(高田製薬)がそれぞれ取消しを求めて訴えを提起したものであり、進歩性を肯定した請求不成立審決の取消しを求めた高田製薬の請求は棄却され、一方、サポート要件違反とした無効審決の取消しを求めた特許権者の請求は認められた(審決取消となった)ものである。
本事件は、「ボロン酸化合物製剤」に関する特許(第4162491号)の無効審判において特許庁がした請求不成立審決及び無効審決(無効2016-800096)に対して、特許権者(アメリカ合衆国)及び審判請求人(高田製薬)がそれぞれ取消しを求めて訴えを提起したものであり、進歩性を肯定した請求不成立審決の取消しを求めた高田製薬の請求は棄却され、一方、サポート要件違反とした無効審決の取消しを求めた特許権者の請求は認められた(審決取消となった)ものである。
なお、同特許についてホスピーラを無効請求人とした同様審決(無効2016-800130)の取消訴訟もほぼ同内容で同日判決となった(2020.07.02 「アメリカ合衆国 v. ホスピーラ」 知財高裁平成30年(行ケ)10159 (A事件); 10153 (B事件))。
同特許権は、抗悪性腫瘍剤ベルケイド®(一般名: ボルテゾミブ(Bortezomib))を保護していると考えられ、ベルケイド®のジェネリック市場参入の観点でも注目される判決となった。
本記事では、(1)裁判所がサポート要件判断に示唆を与えるクライテリアを示した点、(2)日本におけるベルケイド®のジェネリック参入時期、(3)本件特許の欧米ファミリーの状況について触れる。
本件特許発明が解決しようとする課題:
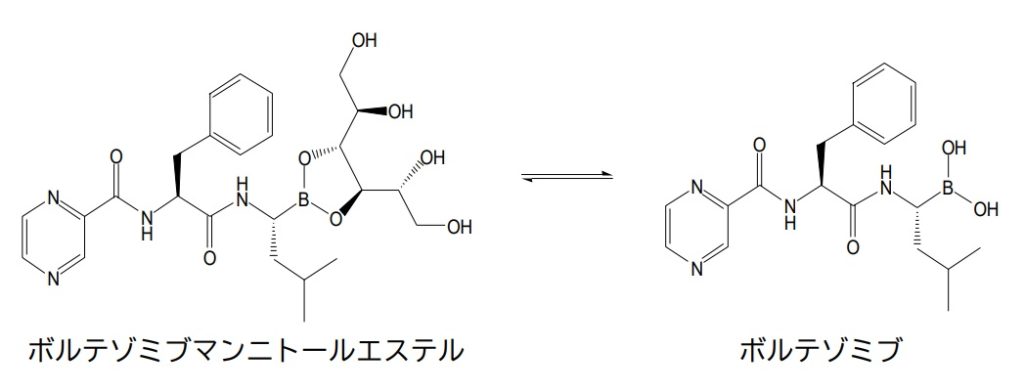
「製剤化したときに安定な医薬となり得て、水性媒体への溶解でボロン酸化合物(ボルテゾミブ)を容易に遊離する組成物となり得る凍結乾燥粉末形態のボルテゾミブマンニトールエステル(「BME」ともいう)を提供する」
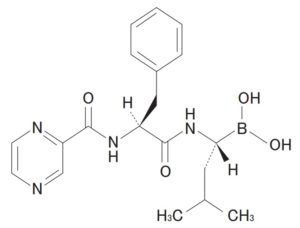
請求項17(訂正後):
「凍結乾燥粉末の形態のD-マンニトール N-(2-ピラジン)カルボニル-L-フェニルアラニン-L-ロイシン ボロネート。」
以下のPMDAホームページに公開されている「ベルケイド注射用 3mg」に関する資料「申請資料概要」の記載から、本件特許権はベルケイド®を保護していると考えられる。
「ボルテゾミブ注射剤は当初、液剤の開発がすすめられたが製剤の安定性を確保できなかったことから凍結乾燥製剤の開発が行われた。本剤は原薬をマンニトールエステルとすることにより室温における安定性の向上を図った製剤である。・・・本剤は固体状態でボルテゾミブのマンニトールエステルとして存在し、用時、生理食塩水で溶解することにより活性体のボルテゾミブとなる。」
PMDAホームページ「ベルケイド注射用 3mg」に関する資料「申請資料概要」より
2.サポート要件違反とした無効審決の要約
本件明細書の記載は、凍結乾燥品が示した安定性及び溶解性がボルテゾミブに由来したものではなくエステル化されたボルテゾミブ(BME)に由来するものであることを定量的に検証していないから、本件化合物発明(凍結乾燥粉末の形態のBME)は、発明の課題を解決できると当業者が発明の詳細な説明の記載から認識できる範囲のものではない。
3.裁判所の判断
(1)サポート要件充足性の判断手法について
特許請求の範囲の記載が明細書のサポート要件に適合するか否かは,特許請求の範囲の記載と発明の詳細な説明の記載とを対比し,特許請求の範囲に記載された発明が,発明の詳細な説明に記載された発明で,発明の詳細な説明の記載又はその示唆により当業者が当該発明の課題を解決できると認識できる範囲のものであるか否か,また,その記載や示唆がなくとも当業者が出願時の技術常識に照らし当該発明の課題を解決できると認識できる範囲のものであるか否かを検討して判断すべきである。
そして,サポート要件を充足するには,明細書に接した当業者が,特許請求された発明が明細書に記載されていると合理的に認識できれば足り,また,課題の解決についても,当業者において,技術常識も踏まえて課題が解決できるであろうとの合理的な期待が得られる程度の記載があれば足りるのであって,厳密な科学的な証明に達する程度の記載までは不要であると解される。
なぜなら,サポート要件は,発明の公開の代償として特許権を与えるという特許制度の本質に由来するものであるから,明細書に接した当業者が当該発明の追試や分析をすることによって更なる技術の発展に資することができれば,サポート要件を課したことの目的は一応達せられるからであり,また,明細書が,先願主義の下での時間的制約もある中で作成されるものであることも考慮すれば,その記載内容が,科学論文において要求されるほどの厳密さをもって論証されることまで要求するのは相当ではないからである。(2)本件化合物発明の課題について
本件明細書の記載によれば,本件化合物発明が解決しようとする課題は,製剤化したときに安定な医薬となり得て,また,水性媒体への溶解でボロン酸化合物を容易に遊離する組成物となり得る本件化合物(凍結乾燥粉末の形態のBME)を提供することである。そして,この課題が解決されたといえるためには,凍結乾燥粉末の状態のBMEが相当量生成したこと,並びに当該BMEが保存安定性,溶解容易性及び加水分解容易性を有することが必要であると解されるから,これらの点が,上記⑴で説示したような意味において本件明細書に記載又は示唆されているといえるかについて検討することとする。なお,ここでいう「相当量」とは,医薬として上記課題の解決手段になり得る程度の量,という意味である。
・・・(略)・・・
検討したところによれば、本件化合物発明の特許請求の範囲の記載は,サポート要件を満たすものというべきであり,これを否定した審決の判断は誤りである。
4.コメント
(1)サポート要件判断に示唆を与えるクライテリア
裁判所が示したサポート要件を判断するために示した下記点は、記載内容の厳密さを吟味する際のクライテリアとして有用と考えられる。
・課題が解決できるであろうとの合理的な期待が得られる程度の記載で足りる。
・厳密な科学的な証明に達する程度の記載や科学論文で要求される厳密な論証までは不要。
(2)日本におけるベルケイド®のジェネリック参入時期
ベルケイド®(一般名:ボルテゾミブ)は、米国Millennium Pharmaceuticals, Inc.(MPI社。現在は武田薬品の子会社)により、プロテアソームを選択的かつ可逆的に阻害して抗腫瘍作用を発揮する分子標的薬として開発された抗悪性腫瘍剤である。日本においては、MPI社とOrtho Biotech, Inc.(米国Johnson & Johnsonの傘下企業)が本剤の開発及び販売に関する世界的な包括提携契約を締結したことにより、ヤンセンファーマ(株)が開発権を取得し、2006年に効能・効果を「再発又は難治性の多発性骨髄腫」(希少疾病用医薬品)として承認された。
「多発性骨髄腫」の再審査期間は既に終了し、ボルテゾミブを保護する物質特許権(第3717934)の存続期間も延長期間が順次満了し権利消滅した(表1)。
| 再審査期間 | ボルテゾミブに関する物質特許(第3717934) | 「ボロン酸化合物製剤」に関する特許(第4162491) | |
| 再発又は難治性の多発性骨髄腫 | 10年: 2006.10.20〜2016.10.19 (希少疾病用医薬品) | 2016.12.7.満了 (延長2013-700031) | 2022.1.25満了 (延長なし) |
| 未治療の多発性骨髄腫 | 2011.9.16〜2016.10.19 (希少疾病用医薬品) | 2019.2.1.満了 (延長2011-700282) | 同上 |
| 新投与経路(皮下投与) | 6年: 2012.12.21〜2018.12.20 | 2020.4.8.満了 (延長2007-700012) | 同上 |
| マントル細胞リンパ腫 | 10年: 2015.6.26〜2025.6.25 (希少疾病用医薬品) | 2015.10.27満了 (延長なし) | 同上 |
ベルケイド®のジェネリックとして、2018年2月にボルテゾミブ静注用3mg「武田テバ」(武田テバファーマ)が単独初承認を得て以降、2019年2月にボルテゾミブ注射用3mg「DSEP」(第一三共エスファ)、2019年8月にボルテゾミブ注射用3mg「ヤクルト」承認(高田製薬)が承認を得ているが、いずれも薬価収載・販売には至っていない。
少なくとも高田製薬は本件「ボロン酸化合物製剤」に関する特許(第4162491号)の無効を争っていることから、同特許の存在が参入障壁となっていると推測され、この特許を回避する製剤でない限り、ジェネリックは同特許権が満了する2022年1月までは販売されないとも考えられる。本事件及びホスピーラが請求人である事件以外に、過去に富士製薬工業が無効審判を請求したが請求を取下げた経緯がある(無効2015-800153)。また、現在、ヘクサル社が無効審判を請求しているがその審理は本件訴訟手続きが完結するまで手続きを中止係属中である(無効2018-800012)。

本件化合物発明に係る特許は、いわゆるパテントリンケージの対象となる「物質特許」としてPMDA(厚労省)は扱ってくれなかったのかな・・・
(3)本件特許の欧米出願ファミリーの状況
米国:
米国ファミリーである特許6,713,446の独占実施権者Millennium社とVelcade®のANDA申請をしたジェネリックメーカー各社との間で争われた米国での特許侵害訴訟において、2017年7月17日、CAFCは、「同特許のクレーム20等を自明であり無効であるとした地裁判決は誤りである」と判断している(2017.07.17 MILLENNIUM v. Sandoz et al. CAFC No. 2015-2066, 2016-1008, 2016-1009, 2016-1010, 2016-1109, 2016-1110, 2016-1283, 2016-1762)。
Claim 20. The lyophilized compound D-mannitol N-(2-pyrazine)carbonyl-L-phenylalanine-L-leucine boronate.
Velcade®のOrangebookには、同特許6,713,446及び特許6,958,319が収載されており、特許満了日はいずれも小児延長分含めて2022年7月25日とされている。
米国においてボルテゾミブの物質特許権が満了したことにより、ボルテゾミブを含む競合製品が販売されているが、多くのジェネリックメーカーと上記特許侵害訴訟を争っていることから、本件発明(凍結乾燥粉末の形態のBME)に係る特許権が米国でもジェネリック参入障壁として一定の効果を発揮していると思われる。米国でのVelcade®の2019年度売上は前年度からの落ち込みはなく1,088億円(武田薬品2019年度本決算短信より)。
欧州:
欧州ファミリーである特許EP1355910B1は、異議申立を経て2016年9月26日に審判部において進歩性が否定された(Decision of the Board of Appeal (T1348/14) Patent revoked)。さらに分割出願として派生した特許EP2251344B1及びEP3078667B1もそれぞれ審判(Appeal received No. T0980/19)及び異議申立手続に係属中である。
欧州では2019年4月にジェネリックが参入しており、その影響を受けてVelcade®の米国以外グローバル2019年度売上は、2018年度売上1,116百万ドルから約3割減の751百万米ドルとなった(Johnson & Johnson Reports 2019 Fourth-Quarter Resultsより)。

本件特許発明について日・米では進歩性/非自明性が肯定されましたが、欧州では否定されてしまいました。三極の判断手法・観点の違いを知る良い材料かもしれませんね・・・。


コメント
【参考】
知財管理 71巻(2021年) / 8号 / 1122頁
判例と実務シリーズ(No. 519)「ボロン酸化合物製剤事件─サポート要件の判断基準は変更されたのか─」淺見節子
「厳密な科学的証明までは不要とされたことは・・・発明の証明のあり方における一つの指針となるものと思われる」
http://www.jipa.or.jp/kikansi/chizaikanri/search/detail.php?chizai_id=f7ffe0ea150bd7321cff8355d2956c70
2021.12.09 第一三共エスファ press release: オーソライズド・ジェネリック医薬品新発売のお知らせ
https://www.daiichisankyo-ep.co.jp/home/img/3_6.pdf
「2021年12月10日に新発売・・・ボルテゾミブ注射用 3 ㎎「DSEP」は、先発品:ベルケイドⓇ注射用 3 ㎎の AG です。当社が製造販売元として、ヤンセンファーマ株式会社より供給を受け当社が販売します。」
2022.01.25に「ボロン酸化合物製剤」に関する特許4162491が満了。それを待ってジェネリックメーカーが発売に向けて動き出しました。
ミクスonline 2022.01.27記事「ベルケイド後発品 東和薬品とファイザーは2月、沢井製薬、日本化薬、ヤクルト本社は3月発売予定」より
「東和薬品は本誌取材に、先発品の特許満了後すぐの発売ではなく、2月発売とした理由について、「特許満了後でなければ商業生産できないため」と説明した。」