延長された特許権の効力が争点となった判決3(実質的同一物とは、新たな効果を奏しないもの?): 東京地裁平成27年(ワ)12412
【背景】
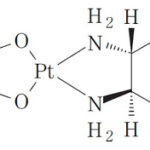
「オキサリプラティヌムの医薬的に安定な製剤」に関する特許第3547755号(本件特許)の特許権者であるデビオファーム(原告)が、武田テバファーマ(被告)に対し被告製品の生産、譲渡又は譲渡の申出の差止め及び廃棄を求めた事案。特に、被告製品に存続期間の延長登録を受けた本件特許権の効力が及ぶかが争点。
特許請求の範囲(本件発明):
濃度が1ないし5mg/mlでpHが4.5ないし6のオキサリプラティヌムの水溶液からなり,医薬的に許容される期間の貯蔵後,製剤中のオキサリプラティヌム含量が当初含量の少なくとも95%であり,該水溶液が澄明,無色,沈殿不含有のままである,腸管外経路投与用のオキサリプラティヌムの医薬的に安定な製剤。
【要旨】
東京地裁(民事第47部)は、延長された本件特許権の効力は被告製品に及ばないとして原告の請求を棄却した。裁判所が示した考えは、主に下記3点。
- 延長された特許権の効力は、当該政令処分対象物の審査事項(「物」として、成分(有効成分に限らない)。「用途」として、用法、用量、効能及び効果)によって特定された特許発明の実施の範囲で及ぶ。
- 延長された特許権の効力は、被疑侵害品が、当該政令処分対象物とは異なる部分を有する場合であっても、政令処分対象物の均等物ないしそれと実質的に同一と評価される物にも及ぶ。
- 被疑侵害品が均等物ないしそれと実質的に同一と評価される物といえる場合とは、「その相違が周知技術・慣用技術の付加、削除、転換等であって、新たな効果を奏するものではないと認められるなど」が相当する。
以下、裁判所の判断を抜粋。
政令処分対象物該当性について
「被告製品は,いずれも成分としてオキサリプラチン以外に添加物として乳糖水和物を含むものであって,成分に違いがあるから,本件処分の対象となった政令処分対象物には当たらない。」
均等物該当性について
「仮に,オキサリプラチン水溶液に乳糖水和物を添加すること自体が,被告製品について政令処分を受けるのに必要な試験が開始された時点において既に知られていたとしても,…(略)…オキサリプラチン水溶液に一定の条件を充たす乳糖水和物を添加することは,本件発明との関係において,周知・慣用技術の付加等にすぎないとはいえず,むしろ,ジアクオDACHプラチン二量体の発生を抑制し,オキサリプラチン水溶液の安定性を向上させるという新たな効果を奏するものといえるから,被告製品は,本件処分の対象となった政令処分対象物の均等物ないし実質的に同一と評価される物とはいえない。」
【コメント】
裁判所は、対象物件が政令処分対象物と実質的同一物であるかどうかは、その相違が「新たな効果を奏するものでない」かどうかであると判示した。しかし、①「新たな効果」とは何なのか不明である。そして、②そのような基準で判断することが制度趣旨からしてなぜ妥当なのか、その理由が判決文には全く示されていない。
①「新たな効果」について
同じ「効果」という基準が採用されている進歩性判断においては、顕著な「効果」の適否は長年の判例蓄積でその基準がそれなりに確立されてきたわけであるが、この判決で定める「新たな効果」は極めて低いレベル感の「新しさ」、またはどのような観点での「新しさ」であっても許容されるとすれば、後発医薬品に対して、期間延長された特許権(有効成分に関する化合物の特許権ですら)の効力は全く意味のないものになりかねない。
- 「新たな効果」とは、有効成分以外で相違する添加剤が費用的に安価であるという経済的効果も含まれるのか?
- 政令処分対象物の審査事項の「効能及び効果」の「効果」のこと(ではないだろうが)?
- 後発医薬品の承認が先行医薬品と治療学的に同等かどうかを見るという政令処分の観点からすれば「効果」とは治療学的効果のみと解せるのでは?
- 発明の観点なのか政令処分対象物の観点なのか?
②実質的同一物かどうかはどのような観点で判断すべきかについて
2016.12.02 「デビオファーム v. ホスピーラ」 東京地裁平成27年(ワ)12415のコメントでも触れたが、後発医療用医薬品(ジェネリック医薬品)とは、新有効成分や新しい効能・効果等を有することが臨床試験等により確認され承認された新薬と同一の有効成分を同一量含み、同一投与経路の製剤であり、効能・効果、用法・用量も原則的に同一である医薬品で、生物学的同等性試験等にてその新薬と治療学的に同等であることが検証されたものである。確かに、多くのジェネリック医薬品はその製剤の添加剤成分が先発医薬品とまったく同一ではなく、中には、製剤化を容易にする、品質の安定化を図る、または使用性を向上させるなどの目的で異なる添加剤を使用している場合もある。しかし、製剤の添加剤成分が異なっていたとしても、それは溶出挙動やヒトでの生物学的同等性試験を行い、先発医薬品と治療学的に同等となるよう製剤設計されているのであって、政令処分の観点からは本質的には同等なのであり、先発医薬品たる政令処分対象物の本質的部分に依拠して(を利用して)承認されるのがジェネリック医薬品なのである。
いわゆる実質的同一物の基準に均等論を適用してしまった東京地裁民事第40部のような判決内容にならずホッとしたところではあるが、それでも本判決では、裁判所が「後発医薬品がどのように製造販売承認等を受けるかと,延長後の特許権の効力が及ぶ範囲をどう解するかは,全く別個の問題」と言及している部分がある。特許期間延長登録制度の趣旨は、「政令処分」を受けることが必要であったために特許発明の実施をすることができなかった期間を回復することを目的とするものである。その制度趣旨が実体的に意味することは、先行医薬品の特許回復の期間・範囲と裏腹にある後発医薬品の製造販売承認時期・範囲をどう認めることがその目的に資するかということであり、決して「後発医薬品がどのように製造販売承認等を受けるかと,延長後の特許権の効力が及ぶ範囲をどう解するかは,全く別個の問題」とは言えないのである。特許延長期間中にもかかわらず政令処分対象物に依拠して、利用して、フリーライドして、すり抜けてジェネリック医薬品の承認販売を認めることは、著しく公平を損なうことは確かであり、その観点から「実質的同一物」の範囲をどのように解釈するかは非常に重要である。裁判所は、実質的同一物かどうかの判断基準を示すなら、その理由が制度趣旨とどのようにつながっており、なぜそのような基準を当てはめることが妥当と解されるのかを示してほしい。
本件延長された特許権は本件被告製品との関係で効力が及ばないと判断されただけであり、他の後発医薬品に効力が及ぶのかどうかは個別判断ということになる。延長された特許権の効力がどの範囲まで及び得るのかについて一般化することはできず、依然として、特許権者及び後発品メーカー両者にとって延長された特許権の行使可能性・侵害予見性は極めて低いものと言わざるを得ないだろう。
参考:

コメント