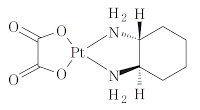
*Case2018
*Case2018 2018.03.28 「バクスアルタ v. 中外製薬」 東京地裁平成28年(ワ)11475
機能的表現抗体クレームの技術的範囲の解釈(中外エミシズマブ(ヘムライブラ®)): 東京地裁平成28年(ワ)11475【背景】「第Ⅸ因子/第Ⅸa因子の抗体および抗体誘導体」に関する特許権(特許第4313531号; 存続期間満了日は2020年9月13日)に係る特許発明の技術的範囲に属すると主張して、特許権者である原告(バクスアルタ)が、被告(中外製薬)に対して、被告製品(開発コードACE910、一般名...