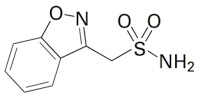
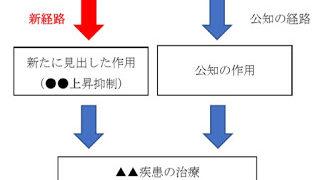
 *Case2019
*Case2019 2019.03.19 「サン ファーマ v. ジェネンテック」 知財高裁平成30年(行ケ)10036
IL-23アンタゴニストによるIL-17産生阻害の新経路発見に基づく作用機序特許、乾癬治療用途は同じでも新規?:知財高裁平成30年(行ケ)100361.背景被告(ジェネンテック)が保有する「IL-17産生の阻害」に関する特許(第5705483号)に対して原告(サン ファーマ)がした無効審判請求に対する不成立審決(無効2017-800007号)の取消訴訟である。争点は、①新規性、②進歩性、③明確性要...