トレリーフ®(ゾニサミド)を保護する用途特許の進歩性: 知財高裁平成30年(行ケ)10098
【背景】
被告(大日本住友)が保有する「神経変性疾患治療薬」に関する特許(第3364481号)に対して原告(テバ)がした無効審判請求の不成立審決(無効2017-800120号)の取消訴訟。
争点は進歩性。
審決の理由は、本件各発明は、引用発明並びに甲3文献に記載された事項及び技術常識に基づいて、当業者が容易に発明をすることができたものではない、というものであった。
本件発明1(請求項1):
ゾニサミドまたはそのアルカリ金属塩を有効成分とする神経変性疾患治療薬。
引用発明:
ゾニサミドを有効成分とする抗てんかん薬であって,ゾニサミドの投与量が20mg/kg,50mg/kgであり,雄のwistarラットの線条体のドパミンの細胞外濃度が上昇する作用を示す,抗てんかん薬。
本件発明1と引用発明との一致点及び相違点:
(ア) 一致点
ゾニサミドまたはそのアルカリ金属塩を有効成分とする医薬。
(イ) 相違点
医薬について、本件発明1では「神経変性疾患」を治療対象とするのに対して、引用発明では「てんかん」を治療対象としている点。
【要旨】
裁判所は、本件発明は引用発明並びに甲3文献に記載された事項及び技術常識に基づいて当業者が容易に発明をすることができたものではない、というべきであるとして、原告主張の取消事由はいずれも理由がない、と判断した。
請求棄却。
以下、引用発明において相違点に係る本件発明1の構成を採用する動機付けについての裁判所の判断を抜粋。
「(ア) 引用例及び甲3文献は,いずれも,ゾニサミドが,健常動物において,線条体ドパミン量の増加作用を有すること,MAO-B阻害作用を有することを示唆するにとどまるものである。
そして,前記ウ(ア)のとおり,本件優先日当時の当業者は,健常動物で得られた線条体ドパミン量の挙動が,パーキンソン病疾患モデル動物における線条体ドパミン量の挙動を必ずしも示すものではないとの技術常識を有していたものである。
そうすると,当業者は,引用例及び甲3文献から上記示唆を受けても,そもそもパーキンソン病疾患を有する患者において,ゾニサミドが線条体ドパミン量を増加させたり,ゾニサミドがMAO-B活性を阻害したりするとは理解しないから,ゾニサミドがパーキンソン病の治療薬になる可能性を認識し得ないというべきである。
(イ) また,引用例及び甲3文献における前記示唆から,健常動物以外であっても,ゾニサミドの投与が線条体ドパミン量の増加作用及びMAO-B阻害作用を僅かでも有する可能性があることまでは否定できない。
しかし,前記ウ(イ)及び(ウ)のとおり,本件優先日当時の当業者は,抗てんかん薬であるゾニサミドについて,線条体ドパミン量の増加作用の観点からも,MAO-B阻害作用の観点からも,パーキンソン病に対して治療効果を奏する可能性は低いとの技術常識を有していたというべきである。
そうすると,このような技術常識を有する当業者は,引用例及び甲3文献から,ゾニサミドがパーキンソン病の治療薬になると合理的に期待し得ないというべきである。
(ウ) よって,当業者は,引用発明において,相違点に係る本件発明1の構成を採用することを動機付けられることはないというべきである。」
【コメント】
引用発明において、相違点に係る本件発明1の構成を採用することの阻害要因について検討するまでもなく、本件発明1は、引用発明並びに甲3文献に記載された事項及び技術常識に基づいて、当業者が容易に発明をすることができたものではない、と判断された。
①引用例に記載された健常動物で得られた挙動は疾患モデル動物の挙動を必ずしも示すものではないとの技術常識、②線条体ドパミン量を増加させる薬物にはパーキンソン病患者への使用が禁忌とされるものがあり治療効果を奏する可能性は低いとの技術常識、③ゾニサミドのMAO-B阻害作用の程度から他のパーキンソン病治療薬と同程度の薬理効果を奏する可能性が低いとの技術常識、を当業者は有していたという主張を被告は展開し、相違点の構成を採用することの動機づけを認めさせないことに成功した。
医薬用途発明の進歩性が認められた事例として参考になる。
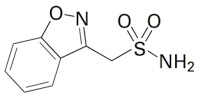
ゾニサミド(Zonisamide)/トレリーフ®:
ゾニサミド(Zonisamide)は大日本住友において1974年に合成され、抗てんかん剤として開発された化合物であり、1989年3月に抗てんかん剤のエクセグラン®として日本で承認を取得、同年6月に販売を開始した。その後、パーキンソン病治療薬としての開発が進められ、2009年1月にトレリーフ®錠25mgとして日本で承認を取得した。2013年8月にはパーキンソン病の症状の日内変動(wearing-off 現象)の改善を目的として1日1回50mgを投与する用法・用量の一部変更が承認、2014年8月にはトレリーフ®OD錠25mgが承認、2017年8月にはトレリーフ®OD錠50mgが承認された。また、2018年7月にはレビー小体型認知症に伴うパーキンソニズムの効能・効果及び用法・用量が追加承認された。ゾニサミド製剤は、抗パーキンソン病薬としては外国で販売されていないようである(2018年6月時点)。
本件特許(JP3364481B):
本件特許は、トレリーフ®を保護する用途特許である。早期審査請求により拒絶理由通知が発せられることなく特許査定となった。分割出願はない。本件出願ファミリー(WO1999/033465)として、欧米では一旦特許が成立したが(EP1040830B; US6342515B)、いずれも放棄された。下記表のとおり、本件特許権の存続期間延長登録出願がトレリーフ®の各承認に基づいて行われている。ゾニサミドが1989年にエクセグラン®として上市されたことから物質特許は既に満了していると考えられる。これまでのトレリーフ®承認時の延長出願対象特許の有無から、トレリーフ®を保護する主要な特許権は用途特許3364481のみと推定される。
トレリーフ®(ゾニサミド/Zonisamide)のヒストリー:
|
製品ヒストリー
|
用途特許3364481ヒストリー
|
ジェネリックの動き
|
|
|
1974
|
ゾニサミドが合成される
|
|
|
|
1989.03.31
|
抗てんかん薬エクセグラン®として承認
|
|
|
|
1997.12.26
|
|
特許出願(優先日)
|
|
|
1998.12.21
|
|
特許出願(PCT出願日)
|
|
|
2002.10.25
|
|
日本特許成立(登録日)
|
|
|
2009.01.21
|
パーキンソン病治療薬トレリーフ®錠25mgとして承認
|
|
|
|
|
|
錠25mg/パーキンソン病について延長出願2009-700028(5年延長登録)
|
|
|
2013.01.20
|
パーキンソン病の再審査期間(4年)終了
|
|
|
|
2013.08.20
|
錠25mgに症状の日内変動の改善を目的として用法・用量(1日1回50mg)の追加承認
|
|
|
|
2014.08.15
|
OD錠25mgの承認
|
|
|
|
|
|
OD錠25mg/パーキンソン病について延長出願2014-700230(5年延長登録)
|
|
|
2014.12.17
|
OD錠25mgに症状の日内変動の改善を目的として用法・用量(1日1回50mg)の追加承認
|
|
|
|
2017.08.15
|
OD錠50mgの承認
|
|
|
|
|
|
OD錠50mg/パーキンソン病について延長出願2017-700307(5年延長審査中)
|
|
|
2017.08.30
|
|
|
テバが特許無効審判請求(無効2017-800120号事件)
|
|
2018.06.13
|
|
|
特許無効審判請求不成立審決(無効2017-800120号事件)
|
|
2018.07.02
|
錠25mg/OD錠25mgのレビー小体型認知症に伴うパーキンソニズムの効能・効果の追加承認
|
|
|
|
|
|
錠25mg/レビー小体型認知症に伴うパーキンソニズムについて延長出願2018-700295(5年延長審査中)
|
|
|
|
|
OD錠25mg/レビー小体型認知症に伴うパーキンソニズムについて延長出願2018-700296(5年延長審査中)
|
|
|
2018.12.21
|
|
特許存続期間(20年)の満了
|
|
|
2019.03.25
|
|
|
不成立審決(無効2017-800120号事件)取消訴訟請求棄却判決(平成30年(行ケ)10098)
|
|
2019.10.
|
錠25mgの販売中止/出荷終了(予定)
|
|
|
|
2022.07.01
|
レビー小体型認知症に伴うパーキンソニズムの再審査期間(4年)終了
|
|
|
|
2023.12.21
|
|
錠25mg/パーキンソン病について延長2009-700028期間(5年)満了
|
1)
|
|
2023.12.21
|
|
OD錠25mg/パーキンソン病について延長2014-700230期間(5年)満了
|
2)
|
|
2023.12.21
(みなし) |
|
OD錠50mg/パーキンソン病について延長2017-700307期間(みなし5年)満了
|
3)
|
|
2023.12.21
(みなし) |
|
錠25mg/レビー小体型認知症に伴うパーキンソニズムについて延長2009-700028期間(みなし5年)満了
|
|
|
2023.12.21
(みなし) |
|
OD錠25mg/レビー小体型認知症に伴うパーキンソニズムについて延長2014-700230期間(みなし5年)満了
|
|
2019.04.06現在の情報として、J-PlatPat、トレリーフ®インタビューフォーム、大日本住友ウエブサイト等より参照。
脚注:
1) 現状ではトレリーフ®後発品は用途特許存続期間満了(2023.12.21)後の2024.02承認/2024.06薬価収載となる見込み。
2) 先行処分(錠25mg)の後、後行処分(OD錠25mg)を得るために要した期間をどのように主張して5年得たのかは延長期間算定の根拠主張に参考になるかも知れない。
3) 先行処分(OD錠25mg)の後、後行処分(OD錠50mg)を得るために要した期間をどのように主張して5年得るのかは延長期間算定の根拠主張に参考になるかも知れない。仮に、延長5年が認められず、2023.12.21より前にOD錠50mgのジェネリックが承認販売されると想定した場合、OD錠50mgのジェネリックは錠25mgやOD錠25mgに基づく延長用途特許の傘の下にあるとしてそれら延長特許権の効力が及ぶのか(傘の下説)、それともOD錠50mgだけ延長期間に穴が開いたと考える(傘穴開き説/短冊説)のか、それら観点を厚労省/PMDAは適切に判断しパテントリンケージを運用できるのか。


コメント
トレリーフ®のAG
2023.08.15 住友ファーマプロモ press release: ゾニサミド OD 錠 25mgTRE「SMPP」/ OD 錠 50mgTRE「SMPP」 製造販売承認取得のお知らせ
https://prm.sumitomo-pharma.co.jp/wp-content/uploads/23080ZON_Oshirase.pdf
「トレリーフ®OD 錠 25 ㎎/ OD 錠 50mg」(住友ファーマの製品名)のオーソライズド・ジェネ
リックとのことです。
2023年12月7日、厚労省は後発医薬品などの薬価基準追補収載を官報告示、トレリーフ®の後発医薬品としてはAG(ゾニサミド OD 錠 25mgTRE「SMPP」/ OD 錠 50mgTRE「SMPP」)が他の後発医薬品に先行して承認され、2023年12月8日に薬価収載される。
AGではないトレリーフ®後発品は用途特許存続期間満了(2023.12.21)後の2024.02承認/2024.06薬価収載となると推測しています。
トレリーフ®の後発医薬品として、2023年12月8日、先行してAG(ゾニサミド OD 錠 25mgTRE「SMPP」/ OD 錠 50mgTRE「SMPP」)が薬価収載されましたが、2024年2月15日、14社が後発医薬品の承認を取得しました。AGの製造販売元である住友ファーマプロモは2月20日の発売を予定していると伝えています。
2023.12.07 住友ファーマ・住友ファーマプロモ press release:「オーソライズド・ジェネリック(AG)ゾニサミドOD錠TRE「SMPP」に関する薬価収載および発売日のお知らせ」
https://prm.sumitomo-pharma.co.jp/wp-content/uploads/e555fad95d1e735346722b45e0b6cc6d.pdf
【追加情報】
2024年6月13日、厚生労働省は、2024年6月14日に収載する後発品等の薬価基準追補収載を官報告示。
https://kanpou.npb.go.jp/20240613/20240613g00142/20240613g001420002f.html
後発品が最も多く参入するのは抗パーキンソン病薬・トレリーフOD錠(ゾニサミド)(14社28品目)。トレリーフの後発品は、AGが2月20日に先行発売しており、今回の28品目は通常の後発品。
2024.06.13 ミクスOnline「後発品追補収載 初後発は1成分のみ、09年以降最も少なく AG先行発売のトレリーフに14社28品目」より
https://www.mixonline.jp/tabid55.html?artid=76696
用途特許の延長期間も満了し、これら後発品は2月に承認を取得していた。