1.背景
セレコックス錠®(有効成分: セレコキシブ)を保護する特許~先発メーカーとジェネリックメーカーの攻防・・・本件(知財高裁令和元年(行ケ)10137)は、被告(ジー.ディー.サール)が保有する「セレコキシブ組成物」に関する特許3563036号(本件特許)に対して無効審判(無効2018-800071)を請求した原告ら(日本ケミファ及びダイト)が、特許庁がした請求不成立審決(進歩性欠如、サポート要件違反、実施可能要件違反の無効理由はいずれも理由なし)を不服として、審決の取り消しを求めた訴訟である。本件訴訟で原告らが主張した取消事由は進歩性判断の誤りである。
本件特許(第3563036号)は、非ステロイド性消炎・鎮痛剤(COX-2選択的阻害剤)セレコックス(Celecox)®錠(有効成分: セレコキシブ)を保護するものであり、20年の存続期間満了日は2019年11月30日であるが、延長登録により、「関節リウマチ、変形性関節症」については2022年6月26日、「腰痛症、肩関節周囲炎、頸肩腕症候群、腱・腱鞘炎」及び「手術後、外傷後並びに抜歯後の消炎・鎮痛」については2024年11月30日が満了日となっている。
請求項1:
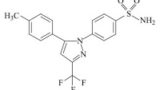
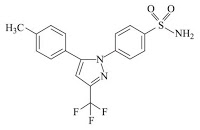
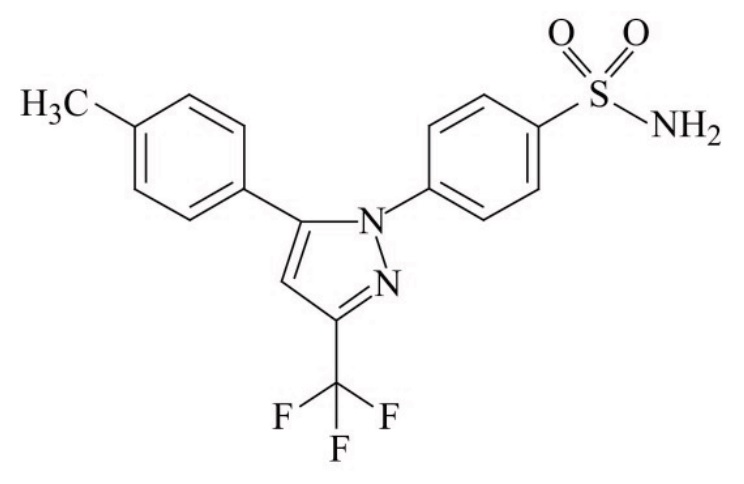
一つ以上の薬剤的に許容な賦形剤と密に混合させた10mg乃至1000mgの量の微粒子セレコキシブを含み,一つ以上の個別な固体の経口運搬可能な投与量単位を含む製薬組成物であって,粒子の最大長において,セレコキシブ粒子のD90が200μm未満である粒子サイズの分布を有する製薬組成物。
2.判決要旨
裁判所は、
・・・主引用例に接した当業者が、経口吸収性の改善及び薬効成分の含量均一性の改善のために、セレコキシブの粒子サイズを小さくすることに思い至ったとしても、「粒子の最大長において,セレコキシブ粒子のD90が200μm未満である粒子サイズの分布を有する」との構成を採用することについての動機付けがあるものと認めることはできないから、主引用例及び技術常識ないし周知技術に基づいて、当業者が上記構成を容易に想到することができたものと認めることはできない・・・
と判断し、原告らの請求を棄却した。
以下に、取消事由1-1(甲1を主引用例とする本件発明1の進歩性判断の誤り)についての裁判所の判断を一部抜粋した。
原告らは,・・・当業者は,甲1発明のカプセル剤において,経口吸収性(生物学的利用能)の改善及び薬効成分の含量均一性の改善のために,「薬効成分の粒子サイズを小さくする」という周知技術を適用する動機付けがあり,セレコキシブの粒子サイズを最大長「D90が200μm未満」とすることは,単なる設計事項であるから,甲1発明のカプセル剤に含有するセレコキシブを「粒子の最大長において,セレコキシブ粒子のD90が200μm未満である粒子サイズの分布を有する」微粒子セレコキシブ(相違点1-2に係る本件発明1の構成)とすることを容易に想到し得たものであり,これと異なる本件審決の判断は誤りである旨主張する。
・・・しかるところ,甲1には,甲1発明の「セレコキシブを300mg含む経口投与用カプセル」にいう「セレコキシブ」について,その調製方法を示した記載はなく,また,粉砕により微細化をしたセレコキシブを用いることや,その微細化条件を「セレコキシブのD90粒子サイズ」で規定することについての記載も示唆もない。
次に,原告らが挙げる甲9・・・また,甲10・・・の記載は,溶解速度を改善するために製剤側で制御可能なファクターは,表面積と溶解度であり,表面積を増大する方法として,薬物粒子を微細化する手段が最もよく利用されていること,薬物粒子は多くの場合,粉砕機を用いて粉砕され,通常有機薬物結晶では十数μmから数μm程度まで微細化できること,微細化により粒子径が小さくなると,表面積の増加により溶解速度が増大し,また,微細化によりバイオアベイラビリティーを改善できることが多くの難溶性薬物で報告されていることなどを示すものである。
一方で,甲9及び10には,特定の大きさよりも小さい粒子サイズの粒子が効果を奏する粉体の場合には,その粒度分布を,平均粒子径ではなく,「所望の大きさよりも小さい粒子サイズの粒子が粉末全体に占める割合」で特定することは,医薬品の原料粉末では一般的であることについての記載や示唆はなく,ましてや,セレコキシブの微細化条件として「セレコキシブのD90粒子サイズ」で規定することや,「セレコキシブのD90粒子サイズ」を「約200μm以下」とした場合には,セレコキシブの生物学的利用能が改善されることについての記載も示唆もない。他に特定の大きさよりも小さい粒子サイズの粒子が効果を奏する粉体の場合には,その粒度分布を,平均粒子径ではなく,「所望の大きさよりも小さい粒子サイズの粒子が粉末全体に占める割合」で特定することは,医薬品の原料粉末では一般的であることを認めるに足りる証拠はない。
そうすると,甲1に接した当業者において,甲1発明のセレコキシブを300mg含む経口投与用カプセルにおいて,経口吸収性(生物学的利用能)の改善及び薬効成分の含量均一性の改善のために,薬効成分のセレコキシブの粒子サイズを小さくすることに思い至ったとしても,セレコキシブの微細化条件として「粒子の最大長において,セレコキシブ粒子のD90が200μm未満である粒子サイズの分布を有する」との構成(相違点1-2に係る本件発明1の構成)を採用することについての動機付けがあるものと認めることはできないから,甲1及び技術常識ないし周知技術に基づいて,当業者が上記構成を容易に想到することができたものと認めることはできない。
したがって,原告らの前記主張は,採用することはできない。
3.コメント
(1)本件特許に対する無効審判の行方
当業者がサイズを小さくすると思い至っても、その条件を当時一般的であると認める証拠はないと判断されたパラメータ(粒子のD90)での特定をその条件として構成に採用することに動機付けがあるとは認められないと判断された。特許を取得する側には、好都合な戦術として参考になりそうだが、本件特許(第3563036号)での「200μm未満」という数値範囲は明細書の記載からして権利として与えられる妥当な範囲なのか・・・。原審で争われたサポート要件欠如・実施可能要件欠如を無効理由とする点は、本件訴訟では取消事由として原告らは主張しなかったようである。サポート要件欠如を無効理由とする主張については、本件審判とは別に係属している特許無効審判(無効2016-800112号)において、請求不成立審決とされた部分は取り消されるべき(サポート要件に適合しない)とした知財高裁判決(2019.11.14 「東和薬品・日本ケミファ・ヘキサル v. ジー.ディー.サール」 知財高裁平成30年(行ケ)10110; 10112; 10155)がだされ、特許庁での審理が再開されたところだ。
欧米ファミリー特許の状況は以下のとおり。
- 欧州特許(EP1049467B)は登録されたが、Teva社等から異議申立てが提出され、その後の審判でも特許無効と判断されている(2009年2月5日)(T0696/05)。
- 米国特許(US9,750,756B2)は2017年9月5日に登録され、2019年11月30日に満了した。
(2)セレコックス®錠(セレコキシブ)のジェネリックが承認されるまでの経緯
- 1992年に米国サール社(現 米国ファイザー社)でセレコキシブを合成
- 1996年4月から、日本で、山之内製薬(現 アステラス製薬)と日本モンサント(現 ファイザー)が共同開発を実施
- 2007年1月26日、「関節リウマチ、変形性関節症」を効能・効果としてアステラス製薬がセレコックス®錠の製造販売承認を取得
- 2009年6月17日、「腰痛症、肩関節周囲炎、頸肩腕症候群、腱・腱鞘炎」効能・効果が追加承認
- 2011年12月22日、「手術後、外傷後並びに抜歯後の消炎・鎮痛」の効能・効果が追加承認
- 2015年1月25日、再審査期間終了
- 2019年11月14日、セレコキシブの物質特許権(第3025017号、5年延長)が満了
- 2020年2月17日、20社40品目のジェネリックが初承認
セレコックス®錠(セレコキシブ)を保護する物質特許が満了し、本件特許(第3563036号)の無効が争われているものの、多くの後発品が2020年2月に一斉に承認となり2020年6月から発売が開始された。
セレコックス®錠の先発メーカーの動きとジェネリックメーカーの動きは、製品・特許の観点から時系列でまとめたものを下記過去記事(2019.11.14 「東和薬品・日本ケミファ・ヘキサル v. ジー.ディー.サール」 知財高裁平成30年(行ケ)10110; 10112; 10155)の「表1 セレコックス®(セレコキシブ)のヒストリー(日本)」に記載しているのでそちらを参照されたい。

また、「2020年2月 セレコックス®(セレコキシブ)のジェネリックが初承認」については以下過去記事参照。
ジェネリックのなかには、例えば、日本ケミファが製造販売するセレコキシブ錠100mg「ケミファ」/セレコキシブ錠200mg「ケミファ」やダイトが製造販売するセレコキシブ錠100mg「アメル」/セレコキシブ錠200mg「アメル」がある。本件訴訟原告ら(日本ケミファ、ダイト)は、同社らによるジェネリックの製造販売行為が本件特許権の侵害に当たるとされることを回避することを意図して本件特許の無効審判を請求したと考えられる。
(3)特許権侵害訴訟は提起されているのだろうか~侵害主張立証のハードル
一方で、特許権者側がジェネリックの発売を開始した各メーカーに対して本件特許権の侵害訴訟を提起しているのかどうか、するのかどうかは定かではない。日本ケミファは、セレコキシブ錠100mg「ケミファ」について原薬の製造国は「大韓民国・中華人民共和国」であることをホームページにて公開しているが、ジェネリックの製剤に用いられる原薬としてのセレコキシブのD90粒子サイズが約200μm以下であることを特許権者側が訴訟提起時点で主張立証することにはハードルがあり(入手した製剤から原薬粒子サイズの分布を分析するのは困難ではないか)、そのような証拠を提示できなければ、探索的訴訟であるとして請求却下される可能性もあるだろう。「無効審判を請求したジェネリックメーカーは請求人適格として利害関係を有するのであるから、その製品の製造等行為が本件特許権を侵害している可能性を自認している」との主張をすることだけで(証拠を入手できていなくとも)差止等請求の却下を回避できるのかどうか・・・。本件特許クレームのような製剤に取り込まれてしまう原薬の状態を構成とする類のクレームにおいては、特許権侵害行為の発見に高いハードルがある。
(4)セレコックス®錠のパテントクリフとAGの投入
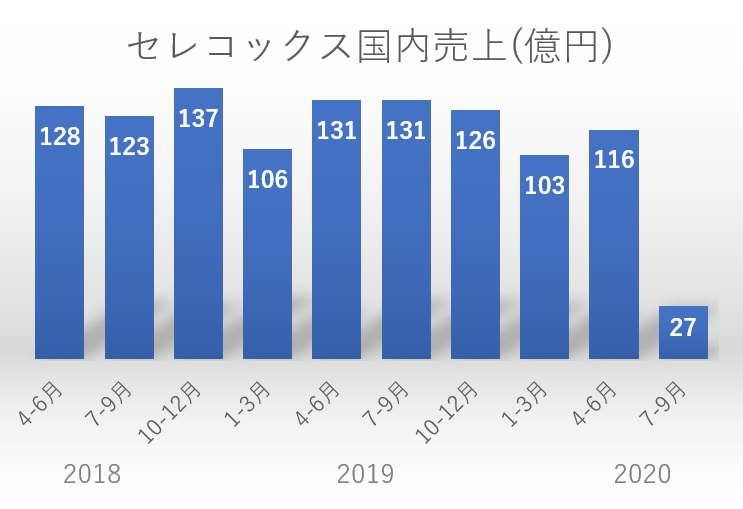
先発品セレコックス®錠の国内売上は、2019年3月期(2018年度)は494億円、2020年3月期(2019年度)は492億円であったが、2021年3月期(2020年度)の最新予想においては、後発品の参入の影響を受け、209億円(対前年比57.4%減)を予想している(アステラス第2四半期 決算補足資料より)。
欧米(米国での商標はCelebrex®)では2014年の物質特許権満了を受けてジェネリックが承認・発売となり、Celebrex®の欧米での2015年売上は対前年比で約1割(2014年US$1872M⇒2015年US$189M)に激減、全世界売上としても対前年比で約3割(2014年US$2699M⇒2015年US$830M)に激減した(2016.02.29 Pfizer SEC Filing 10-K Annual report)。
日本でもとうとう物質特許権満了に伴いジェネリック参入による売上激減、いわゆるパテントクリフ(特許の崖)を落下しつつある状況にある。
多数のジェネリックの市場参入に対抗して、ジェネリック発売と同時期の2020年6月、ファイザーはオーソライズド・ジェネリック(AG)の販売に踏み切った(2020.06.19 ファイザー press release: セレコキシブ錠100mg「ファイザー」、同200mg「ファイザー」発売)。
ジェネリックは先発メーカーが育ててきた市場にあっと言う間に浸透してしまうわけだが、AGが投入された場合にはなおさら、ジェネリック各社も生き残るために競争力が求められる。
(5)セレコキシブ・ビジネスに新たな展開はあるのか
上記のようなジェネリック参入によるパテント・クリフを迎えた状況となった現在、日本でのセレコキシブ・ビジネスに発展があるか掴むため、「セレコキシブ」の改良発明特許の存在の有無をJ-PlatPatのキーワード検索により簡易的ではあるが拾い上げを試みた(表1)。
この特許情報から、例えば、セレコキシブの経皮吸収製剤の特許発明が認められた。特に帝國製薬の特許明細書(特許6495723)には、セレコキシブの経皮吸収製剤の実施例として基材の選択から薬効試験まで具体的に記載されている。しかし、帝國製薬が実際にセレコキシブの経皮吸収製剤の開発を現在進めているかどうかは不明である。
セレコキシブの経皮吸収製剤を実際に開発している製薬メーカーの情報や最近の研究成果はなかなか見当たらない。非ステロイド性抗炎症剤(NSAIDs)のほとんどはCOX阻害薬であってそれらの経皮吸収製剤は市場に既に多く存在していることから、抗炎症を目的とした経皮吸収製剤市場での競争環境は非常に厳しい(レッドオーシャンまたはコモディティ化している)と想像される。セレコキシブ自体が経皮吸収に適しているかどうかという技術的な課題があるのかどうかや、他のNSAIDs経皮吸収製剤に対する競争力を描けるのかどうかは分からないが、新たな付加価値とそれを保護する特許権がなければセレコキシブの経皮吸収製剤という方向性は難しいビジネスではないかと考えられる。
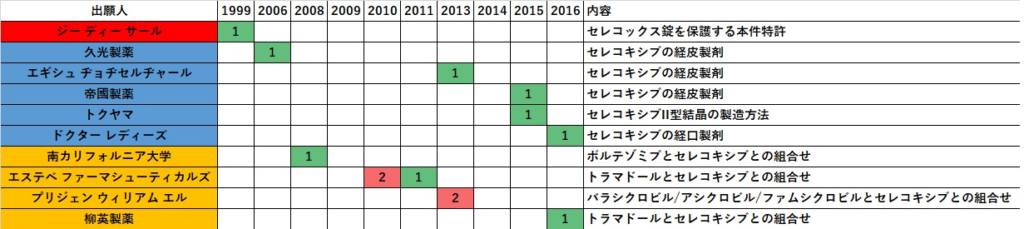
検索方法・・・J-Platpat特許・実用新案検索にて論理式「セレコキシブ/TI+セレコキシブ/BI+セレコキシブ/AB」(登録日あり)で25件がヒット(検索日2020.11.03)。そのうち生存している特許件数(請求の範囲にセレコキシブが有効成分として記載され、その原薬・製剤・製法を包含するもの)を出願人別/出願年(原出願年)別にリストした。


コメント
2020.12.07 アステラス press release: 「セレコックス®錠」の共同販促終了、製造販売承認の承継および販売移管について
https://www.astellas.com/jp/ja/news/16251