プロペシア®錠特許(用量発明)の無効審決取消訴訟: 知財高裁平成27年(行ケ)10033
【背景】
原告(メルク シャープ アンド ドーム)が保有する「5α-レダクターゼ阻害剤によるアンドロゲン脱毛症の治療方法」に関する特許(第3058351号)の無効審決(無効2013-800194)取消訴訟。
本件明細書の記載によれば、アンドロゲン脱毛症や前立腺ガンの治療におけるフィナステライドの有用性は文献に例示されており、同例示に係る特定用量は、患者1人当たり5~2000mg/日の範囲であるところ、本発明者らは、1日用量を少量にした5α-レダクターゼ2阻害剤がアンドロゲン脱毛症の治療に特に有用であるという知見を見いだした、とのことである。
請求項1:
単位用量として0.05~1mgの5α-レダクターゼ2阻害剤および医薬的に許容可能なキャリヤーより成る,ヒトにおけるアンドロゲン脱毛症治療用経口剤型医薬組成物。
請求項2:
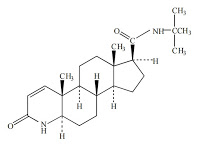
5α-レダクターゼ2阻害剤が17β-(N-t-ブチルカルバモイル)-4-アザ-5α-アンドロスト-1-エン-3-オンである請求項1に記載の医薬組成物。
審決の理由は、本件発明はいずれも引用発明及び各引用例に記載された事項に基づいて当業者が容易に発明をすることができたというものであった。
本件発明1と引用発明との一致点:
5α-レダクターゼ2阻害剤及び医薬的に許容可能なキャリヤーより成るものである点
相違点1:
本件発明1は、「経口剤型医薬組成物」であるのに対し、引用発明は、経口投与されるものではあるものの、「経口剤型医薬組成物」について特定されていない点
相違点2:
本件発明1においては、用途について「ヒトにおけるアンドロゲン脱毛症治療用」と特定されているのに対し、引用発明においては、そのような特定がなく、禿げかかった成体雄 stumptail macaque サルにおいて作用を確認している点
相違点3:
本件発明1においては、用量について、「単位用量として0.05~1mg」と特定されているのに対し、引用発明においては、「0.5mg/日」と特定されている点
【要旨】
裁判所は、本件審決の引用発明の認定、本件発明1と引用発明との一致点及び相違点の認定及び各相違点を容易に想到することができるとした判断に誤りはなく、並びに本件審決に顕著な効果を看過した誤りはなく、本件発明1に係る原告主張の各取消事由は理由がないから、原告の請求をいずれも棄却した。原告は、本件発明2、4ないし16、18ないし20について本件審決の取消事由を主張しなかった。
以下は裁判所判断の抜粋。
取消事由3(相違点1の判断の誤り)について
原告は,仮に,当業者が,本件優先日当時,引用発明に係る実験の結果からフィナステライドをヒトのアンドロゲン脱毛症の治療に試すことを考えたとしても,皮膚を標的とする局所製剤の開発を試みたものと考えられる旨主張する。しかし,本件優先日当時,フィナステライドの経口投与については,これを有効成分とする前立腺肥大症の経口治療薬であるPROSCARが市販されていたことなど,アンドロゲン脱毛症と同じくアンドロゲン過剰蓄積が原因となって発症する前立腺肥大症の治療という薬効が発揮されるために適切な投与経路であることを示す事実の存在が認められるのに対し,局所投与については,適否を判断するのに十分な事実の存在が認め難いことに鑑みれば,当業者は,サルに対してフィナステライドを投与した引用発明に係る実験の結果から,まず,フィナステライドを経口剤型医薬組成物とすることを試みるものと考えられる。
本件優先日当時,stumptail macaque は,他の動物に比してヒトのアンドロゲン脱毛症に似た脱毛症の症状を示すことから,ヒトのアンドロゲン脱毛症の臨床研究に有用な動物であることが,技術常識として確立していたものということができる。したがって,当業者は,本件優先日当時,禿げかかった5匹の成体雄 stumptail macaque サルに対して0.5mg/日のフィナステライドをリンゴのスライスに塗布して経口投与したところ,うち4匹が頭皮毛髪重量の増加を示したという引用発明に係る実験の結果から,フィナステライドがヒトのアンドロゲン脱毛症患者に対しても頭皮毛髪重量の増加を促すことを期待して,フィナステライドをヒトのアンドロゲン脱毛症の治療に試用するものと考えられるから,フィナステライドをヒトのアンドロゲン脱毛症の治療に用いる動機付けは十分にあるというべきである。
取消事由5(相違点3の判断の誤り)について
当業者は,ヒトのアンドロゲン脱毛症の治療のために,頭皮毛髪重量の増加と相関関係があり得る血清DHT濃度の低下を目指してフィナステライドの経口投与を試み,用量の設定に当たっては,引用例2から5の記載に接し,ヒトの男性に対する0.04mg/日など1mg/日以下の用量のフィナステライドの投与によって血清DHT濃度が低下することを認識するものということができる。以上によれば,当業者は,ヒトのアンドロゲン脱毛症の治療剤の開発に当たり,引用例2から5を参照しながら1mg/日以下のフィナステライドの経口投与を試み,血清DHT濃度を低下させることのできる用量として相違点3に係る0.05~1mg/日の用量の設定を容易に想到することができたものということができる。
取消事由6(顕著な効果を看過した誤り)について
原告が本件発明の顕著な効果として主張するもののうち,患者の生活の質の向上及び副作用の低減については,本件明細書に記載されておらず,したがって,これらの効果に係る原告の主張は,本件明細書に基づかないものであるから,採用できない。
【コメント】
本件発明2に記載されている17β-(N-t-ブチルカルバモイル)-4-アザ-5α-アンドロスト-1-エン-3-オンは、一般名フィナステリド(finasteride)と知られる5α‐レダクターゼ2の阻害剤である。日本では2005年10月11日に男性型脱毛症の治療薬として承認され、プロペシア®(Propecia®)錠0.2mg、1mgとしてMSD社が販売。しかし、本件特許権の存続期間満了日は2019年10月11日であったところ、2014年10月に本件無効審決がでると、ファイザー(マイラン製薬提携)が2015年4月から後発品の販売を開始し(ファイザー社 press release: 2015.02.20 「男性型脱毛症治療薬「フィナステリド錠」の製造販売承認取得後発医薬品として日本初」; 2015.04.06 「男性型脱毛症用薬「フィナステリド錠」を4月6日に発売後発医薬品として日本初」)、2016年春にもさらに2社が販売を開始している。
本件では、請求項1のような、化学構造を限定していない、いわゆる機能的表現クレームが特許庁の審査を経て登録されている。本件無効審判では特許庁は無効と判断したわけであるが、J-PlatPatでの審査状況を見る限り、一度も拒絶理由通知を受けることなく特許査定を受けている。
欧米対応特許の成立クレームは下記のとおりである。日本特許の請求項1のような機能的表現クレームでは成立していない。請求項2の同様なクレームは成立しており、用量に特徴がある発明だったいう観点で、日米欧間での進歩性判断の比較において参考になるかもしれない。
- EP0724444(B1)
Claim 1. The use of 17β-(N-tert-butylcarbamoyl)-4-aza-5-alpha-androst-1-ene-3-one for the preparation of a medicament for oral administration useful for the treatment of androgenic alopecia in a person and wherein the dosage amount is about 0.05 to 1.0 mg.
- EP0776664: The application is deemed to be withdrawn.
- US5547957 (A)
Claim 1. A method of treating male pattern baldness comprising orally administering to a male person_having a balding area 17.beta.-(N-tert-butylcarbamoyl)-4-aza-5.alpha.- androst-1-ene-3-one in a dosage amount from 0.05 to 3.0 mgs/day at least until growth of hair can be detected in the balding area by haircount analysis of the balding area.
- US5760046 (A): Patent Expired Due to NonPayment of Maintenance Fees
Claim 1. A method of treating female pattern baldness comprising orally ale person in need of such treatment the 5.alpha.-reductase 2 inhibitor 17.beta.(N-tert.-butylcarbamoyl)-4-aza-5.alpha.-androst 1-ene-3-one in a dosage amount from 0.01 to 3 mgs/day.
- US5824686 (A)
Claim 1. A tablet useful for the treatment of androgenic alopecia, consisting essentially of 17.beta.-(N-tert-butylcarbamoyl)-4-aza-5alpha-androst-1-ene-3-one as the active ingredient wherein the dosage is about 0.05 to 3.0 mg.
- US5981543 (A): Patent Expired Due to NonPayment of Maintenance Fees
Claim 1. A method of treating female hirsutism comprising orally administering to a female person in need of such treatment the 5.alpha.-reductase 2 inhibitor 17.beta.-(N-tert-butyl-carbamoyl)-4-aza-5.alpha.-androst-1-ene-3-one in a dosage amount of from about 0.01 to 3.0 mg/day.
- US6174892 (B1): Patent Expired Due to NonPayment of Maintenance Fees
Claim 1. A method of treating acne consisting essentially of orally administering to a person in need of such treatment a 5.alpha.-reductase 2 inhibitor of structural formula I ##STR3##
- US6355649 (B1): Patent Expired Due to NonPayment of Maintenance Fees
Claim 1. A method of treating seborrhea comprising orally administering to a person in need of such treatment a 5.alpha.-reductase 2 inhibitor of structural formula I ##STR3##
- US2002042425 (A1): Abandoned — After Examiner’s Answer or Board of Appeals Decision


コメント