Summary
骨粗鬆症治療剤エディロール®カプセルの有効成分エルデカルシトールの用途発明に係る特許権を保有する中外製薬(原告)が、沢井製薬及び日医工(被告ら)がその後発医薬品を製造・販売する行為は侵害に当たると主張して、その差止・廃棄を求めた事件。
本件発明は、「非外傷性である前腕部骨折を抑制するための」医薬組成物であるところ、本件発明と公知の乙1発明が相違するといえるかが問題となった。
裁判所(東京地裁・民事第46部)は、
- 優先日当時の技術常識から、乙1発明の骨粗鬆症治療薬には、骨粗鬆症患者に対する、通常は骨折を生じさせない些細なきっかけで橈骨(とうこつ)(前腕部)に新たな骨折を発生させないようにすることについても用途として含まれることは明らか
- 乙1文献には、エルデカルシトールが骨密度を上昇させる効果を有することが記載されており、乙1発明の骨粗鬆症治療薬について、当然に前腕部に係る骨折予防についても有効であることが具体的に想定されていたと認められる
-
本件明細書の実施例で記載されている分析結果からは、前腕部についてのみ良好な結果が得られたのか、椎体(ついたい)についてのみ良好とはいえない結果が得られたのかすら明らかにされておらず、顕著な効果を認めることはできない
-
投与対象を「原発性骨粗鬆症患者」や「I型骨粗鬆症患者」といった特定の患者に限定することは、乙1発明で想定されていた用途と評価されるべきであり、乙1発明との相違点になるとはいえない
から、本件発明はいずれも乙1文献に記載された発明に基づき新規性が欠如し、本件訂正によってもその無効理由は解消されないと判断し、その余の争点について判断するまでもなく、中外製薬の請求にはいずれも理由がないとして、中外製薬の請求を棄却した。
中外製薬は当該判決を不服として控訴している。
1.背景
本件(東京地裁令和2年(ワ)13326; 13331)は、発明の名称を「エルデカルシトールを含有する前腕部骨折抑制剤」とする特許第5969161号の医薬用途発明に係る特許権を有する原告(中外製薬)が、被告ら(沢井製薬及び日医工)がそれぞれ製造販売承認を得た医薬品が、いずれも上記発明の技術的範囲に属するとして、被告らに対して、特許法100条1項、2項に基づき、同医薬品の生産、輸入、譲渡、譲渡の申出及び廃棄を請求する事案である。
参考:
- 2020.05.29 過去記事: 中外 エディロール用途特許侵害で沢井・日医工を提訴
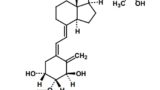
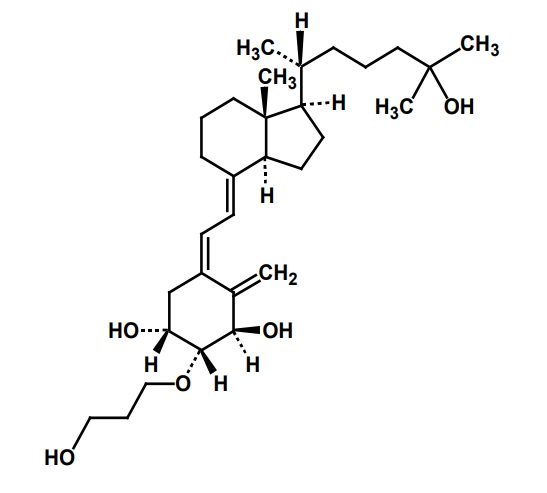
(1)本件特許の特許請求の範囲
本件特許について、無効審判(無効2019-800112。以下「本件無効審判」という。)が請求され、原告は、本件無効審判の手続において、令和2年(2020年)11月30日付け訂正請求書により、本件特許の特許請求の範囲のうち、請求項4について、新たな請求項4(訂正事項2)と請求項5(訂正事項3)とすることを含む訂正の請求をした(以下、この訂正の請求を「本件訂正」といい、訂正事項2の訂正を「本件訂正4」、訂正事項3の訂正を「本件訂正5」という。)。
本件発明1、2、4及び本件訂正発明4、5の特許請求の範囲を分説すると次のとおりになる(以下、分説された構成要件の符号に従い「構成要件1A」などという。)
| 本件発明 | 本件訂正 |
|---|---|
| 本件発明1 1A エルデカルシトールを含んでなる 1B 非外傷性である前腕部骨折を抑制するための 1C 医薬組成物。 | – |
| 本件発明2 2A 投与される対象が原発性骨粗鬆症患者である、 2B 請求項1に記載の組成物。 | – |
| 本件発明4 4A エルデカルシトールが0.75μg/日の用量で経口投与される、 4B 請求項1~3のいずれか1項に記載の組成物。 | 本件訂正発明4(訂正事項2) 4C エルデカルシトールを含んでなる 4D 非外傷性である前腕部骨折を抑制するための医薬組成物であって、 4E 投与される対象が I 型骨粗鬆症患者であり、 4F エルデカルシトールが0.75μg/日の用量で経口投与される、 4G 上記組成物 本件訂正発明5(訂正事項3) 5A エルデカルシトールを含んでなる 5B 非外傷性である前腕部骨折を抑制するための医薬組成物であって、 5C 投与される対象が、非外傷性である前腕部骨折の抑制が必要とされる原発性骨粗鬆症患者であり、 5D エルデカルシトールが0.75μg/日の用量で経口投与される、 5E 上記組成物 |
(2)被告製品
被告らは、令和2年(2020年)2月17日、中外製薬が製造販売している骨粗鬆症治療剤エディロール®カプセル(有効成分: エルデカルシトール)の後発医薬品として、以下の製品(総称して「被告製品」という。)について製造販売承認を得て、被告製品につき販売を開始している。
沢井製薬
- エルデカルシトールカプセル0.5μg「サワイ」
- エルデカルシトールカプセル0.75μg「サワイ」
日医工
- エルデカルシトールカプセル0.5μg「日医工」
- エルデカルシトールカプセル0.75μg「日医工」
2.裁判所の判断
裁判所(東京地裁・民事第46部)は、本件発明1、2、4はいずれも「乙1文献」(井上大輔ほか「骨粗鬆症治療薬:ED-71」(「ホルモンと臨床」第55巻7号69~75頁。平成19年7月1日発行))に記載された発明(以下「乙1発明」という。)に基づき新規性が欠如し、本件訂正4、5によってもその無効理由は解消されないと判断し、その余の争点について判断するまでもなく、原告(中外製薬)の請求にはいずれも理由がないとして、原告の請求をいずれも棄却した。
以下に、裁判所の判断を抜粋する。
(1)争点2(本件発明1,2,4は、乙1発明に基づき新規性を欠如するか)について
ア 本件発明1について
乙1文献には、エルデカルシトールを骨粗鬆症治療薬として用いることが記載されており、本件発明1と乙1発明とは、構成要件1A、1Cにおいて一致している。他方、本件発明1は、「非外傷性である前腕部骨折を抑制するための」(構成要件1B)医薬組成物であるところ、乙1発明は骨粗鬆症治療薬であり、この点において本件発明1と乙1発明が相違するといえるかが問題になる。
本件明細書によれば、「非外傷性骨折とは、転倒などの一般的な日常生活で起こる軽微な外力により生じた骨折を示す」(【0035】)とあり、「前腕部は、橈骨と尺骨からなる」(【0022】)とされ、また、「抑制あるいは予防は、骨粗鬆症にり患していない者あるいは骨粗鬆症患者のいずれにおいても、新たな骨折が発生しないことを意味する。」(【0022】)とされている。
したがって、本件発明1の「非外傷性である前腕部骨折を抑制する」とは、骨粗鬆症にり患していない者及び骨粗鬆症患者のいずれについても、転倒などの一般的な日常生活で起こる軽微な外力によって橈骨又は尺骨に新たな骨折が発生しないようにすることを意味しているといえる。
・・・骨粗鬆症治療薬は、骨粗鬆症を治療することを目的とする薬物なのであるから、骨折のリスクを低下させること、すなわち、新たな骨折を発生させないようにすることを目的としているといえる。そして、本件優先日当時、骨粗鬆症においては、骨強度の低下により、通常は骨折を生じさせない些細なきっかけで生ずる骨折である脆弱性骨折が生ずることが問題とされており、骨折が生ずることがある具体的な部位としては、大腿骨、椎体等と並んで、橈骨が含まれていたことが知られていたと認められ・・・そうすると、乙1発明の骨粗鬆症治療薬とは、骨強度の低下によって通常は骨折を生じさせない些細なきっかけで大腿骨、椎体、橈骨等に新たな骨折を発生させないようにすることを目的とする治療薬であり、この中には、骨粗鬆症患者に対する、通常は骨折を生じさせない些細なきっかけで橈骨に新たな骨折を発生させないようにすることについても用途として含まれることは明らかである。
(ア)原告は、乙1発明の骨粗鬆症治療薬について、エルデカルシトールに骨折抑制効果があることは知られていなかったと主張する。
しかし、乙1文献の表題は「骨粗鬆症治療薬」というものであり、その表題からも、そこに記載されたエルデカルシトールが骨粗鬆症の治療薬であること、すなわち、エルデカルシトールが骨粗鬆症患者に対する骨折抑制効果があることに関する文献であることが理解できる。
そして、乙1発明のエルデカルシトールは活性型ビタミンDの誘導体であり、活性型ビタミンDが体内のビタミンD受容体と結合して作用するのと同様にビタミンD受容体に結合して作用するという、活性型ビタミンDと同一の機序によって骨粗鬆症に作用することが想定されていた。
活性型ビタミンDは、前腕部を含む骨における骨形成を促進し、骨破壊を抑制することによって骨量を増やして骨密度骨強度を増加させるとともに、転倒自体を抑制するといった作用を有することが知られており(前記2(3)ア、(4) )、実際に、乙1文献には、エルデカルシトールが骨密度を上昇させる効果を有することが記載されている。
さらに、当時、一般に、骨量が多いほど骨折しにくくなり、骨量の多寡が骨折リスクの指標になると考えられていた(前記2(2))。これらからすると、当業者は、乙1発明の骨粗鬆症治療薬について、前腕部骨折予防効果があると理解すると認められる。
原告が指摘する文献や記載は、上記技術常識等に照らし、当業者に対して乙1発明のエルデカルシトールが上記骨折抑制効果を有することに対して疑念を抱かせるものとは認められない。
以上によれば、本件発明1のうち、骨粗鬆症患者において一般的な日常生活で起こる軽微な外力によって橈骨に新たに骨折が生じさせないことを用途とする構成は、乙1発明のエルデカルシトールの用途と一致すると認められる。
(イ)原告は、公知の用途であってもその用途を限定することにより新規性が認められると主張する。
しかし、本件発明1のうち、骨粗鬆症患者において、一般的な日常生活で起こる軽微な外力によって橈骨に新たに骨折が生じさせないことを用途とする構成について、前記イに述べたところにより、乙1発明のエルデカルシトールにおいても、当然に当該部位に係る骨折予防についても有効であることが具体的に想定されていたと認められる。
また、乙1文献には、エルデカルシトールを活性型ビタミンD3製剤であると記載されていて、乙1発明においても、既存の活性型ビタミンD製剤と同様の機序、すなわち、ビタミンD受容体への作用による骨強度の上昇及び転倒防止(前記2(3)ア、(4))が想定されていたと認められる。
本件明細書には、本件発明1について、技術常識から認められる上記機序と異なる機序によって作用していることについての記載もなく、本件発明1も、乙1発明と同一の作用機序を前提にしていると認められる。
仮に年齢等によって第1選択として投与される薬剤の種類が異なるとしても、エルデカルシトールが投与されたとき、乙1発明のエルデカルシトールが投与されたのか、本件発明1のエルデカルシトールが投与されたのかを区別することができるものではない。
本件発明1の一部の用途は、作用機序の点からも、乙1発明の用途と区別することはできない。
(ウ)原告は、本件発明1において、エルデカルシトールの前腕部骨折抑制に関する顕著な効果が初めて見出されたとも主張する。
原告が本件明細書で明らかにされた医学的に有用であると主張する具体的な知見は、①前腕部の骨折予防の観点からは、アルファカルシドールよりもエルデカルシトールの方が顕著に優れていること、②前腕部以外の部位においては、エルデカルシトールとアルファカルシドールの効果の差は前腕部における差ほど顕著ではないという2点である。
しかし、仮に原告が主張する上記評価が統計学上正当であると認められるとしても、①については、本件明細書で明らかにされているのは、エルデカルシトールがアルファカルシドールに比べて骨折抑制効果が高いことのみであり、このことのみからは、エルデカルシトールがプラシーボに比べて顕著に優れている可能性も、アルファカルシドールがプラシーボに比べて顕著に劣っている可能性も、どちらともいえない可能性もある。
さらに、乙1発明において、エルデカルシトールの骨折抑制効果がアルファカルシドールを上回ること自体が想定されていたことも認められる(前記3)。
②についても、本件明細書の実施例で記載されている前腕部骨折以外に関する分析結果は椎体骨折に関するもののみ(【0069】)であり、前腕部についてのみ良好な結果が得られたのか、椎体についてのみ良好とはいえない結果が得られたのかすら明らかにされていない。
これらによれば、何らかの顕著な効果の存在を理由に乙1発明に対する新規性等が認められる場合があるか否かは措くとしても、本件においてはその前提となる顕著な効果を認めることはできない。
(エ)原告は、65歳の患者群やI型骨粗鬆症患者群においては前腕部における骨折抑制が特に求められており、独立の用途を構成するなどと主張する。
しかし、乙1発明のエルデカルシトールにおいても、一般的な日常生活で起こる軽微な外力によって橈骨に新たに骨折が生じさせないことに有効であることが具体的に想定されていたと認められるなど、上記に述べた事情に照らせば、原告が主張する上記知見は、本件において、乙1発明の用途を前腕部の骨折予防に限定することに新規性を付与すべき事情に当たるとはいえない。
以上によれば、本件発明1は、乙1発明で想定される橈骨の骨折抑制、大腿骨の骨折抑制といった複数の骨折抑制部位に係る用途のうち、前腕部の効果に着目したものと認められる。
本件発明1において「非外傷性である前腕部骨折を抑制するための」と限定した部分は乙1発明との相違点になるとはいえず、本件発明1は、乙1発明と同一であり、本件発明1は、新規性が欠如しているといえる。
イ 本件発明2について
本件発明2は、本件発明1について投与される対象を原発性骨粗鬆症患者に限定したものである。前記(1)で説示したとおり、本件発明1のうち、少なくとも骨粗鬆症患者を対象とし、橈骨の骨折予防を用途とする構成については、乙1発明と同一であるといえる。
また、原発性骨粗鬆症患者とは、閉経や加齢が原因で起きる骨粗鬆症であり(前記2(1)エ)、原発性骨粗鬆症患者は骨粗鬆症患者のうちの一部であるといえる。
なお、本件明細書には、投与対象として乙1発明が対象とする骨粗鬆症患者から原発性骨粗鬆症患者を区別することによって新たな効果が生ずることなどの記載はない。
そうすると、本件発明2のうち、少なくとも橈骨の骨折予防を用途とする構成については、乙1発明と同一であり、新規性が欠如している。
ウ 本件発明4について
本件発明4は、本件発明1~3について、これを0.75μg/日の用量で経口投与される組成物に限定したものである。
乙1文献には、エルデカルシトールを骨粗鬆症治療薬として用いるに当たって、0.75μg/日の用量で経口投与される構成が記載されている。
そうすると、本件発明4のうち、本件発明1及び本件発明2について0.75μg/日の用量で経口投与される構成については、(1)、(2)で説示したのと同様の理由により、乙1文献に記載された発明と同一であるというべきであるから、新規性が欠如している。
(2)争点3(本件訂正4、5によって、本件発明4に係る新規性欠如、進歩性欠如の無効理由が解消されるか)について
ア 本件訂正発明4について
本件訂正4による訂正後の本件訂正発明4は、本件発明1について、①投与される対象を I 型骨粗鬆症患者に限定し、②投与方法を0.75μg/日の用量で経口投与されるものに限定するものである。
前記3(1)で説示したとおり、本件発明1のうち、少なくとも骨粗鬆症患者を対象とし、橈骨の骨折予防を用途とする構成については、乙1発明と同一であるといえる。
投与される対象をⅠ型骨粗鬆症患者に限定する点について、本件優先日当時、女性における閉経後の最初の15~20年に生ずる、皮質骨と比較して海綿骨の過度かつ不均衡な現象を特徴とする骨粗鬆症をⅠ型骨粗鬆症として分類することが提唱されていた(前記2(1)エ)。
このように提唱されていたⅠ型骨粗鬆症は、骨粗鬆症の一種であることは明らかである。他方、本件明細書には、投与対象として、乙1発明が対象とする骨粗鬆症患者からI型骨粗鬆症患者を区別することによって生ずる効果等についての記載は一切ない。
そうすると、投与対象をⅠ型骨粗鬆症患者に限定することは、乙1発明で想定されていた用途と評価されるべきであり、乙1発明との相違点になるとはいえない。
また、②投与方法を0.75μg/日の用量で経口投与されるものに限定している点については、前記3(4)で説示したとおり、乙1文献に記載された発明との相違点になるとはいえない。
そうすると、本件訂正発明4のうち、少なくとも橈骨の骨折予防を用途とする構成については、乙1文献に記載された発明と同一であるというべきであり、新規性が欠如している。
よって、本件訂正4によって新規性欠如の無効理由が解消するとはいえない。
イ 本件訂正発明5について
本件訂正5による訂正後の本件訂正発明5は、本件発明1について、①「投与される対象が、非外傷性である前腕部骨折の抑制が必要とされる原発性骨粗鬆症患者」に限定し、②投与方法を0.75μg/日の用量で経口投与されるものに限定するものである。
前記3(1)で説示したとおり、本件発明1のうち、少なくとも骨粗鬆症患者を対象とし、橈骨の骨折予防を用途とする構成については、乙1発明と同一であるといえる。
投与される対象を「非外傷性である前腕部骨折の抑制が必要とされる原発性骨粗鬆症患者」とする点について、これは、投与される対象を原発性骨粗鬆症患者のうち、非外傷性である前腕部骨折の抑制が必要とされる者に限定するものと認められる。
一般に骨粗鬆症は、骨折のリスクが増大することを問題とする疾患であり、(前記2(1)ア)、骨粗鬆症において想定される骨折部位も橈骨等も含む全身の骨なのであるから、骨粗鬆症患者については、他の部位と並んで、前腕部の骨折について抑制が必要とされているといえるのであって、このことは原発性骨粗鬆症患者についても同様である。
そうすると、原発性骨粗鬆症患者であれば、前腕部骨折の抑制が必要とされるといえる。
他方で、本件明細書には、投与対象として、乙1発明が対象とする骨粗鬆症患者から原発性骨粗鬆症患者を区別することによって生ずる効果等についての記載は一切なく、投与対象を原発製骨粗鬆症患者に限定することは、乙1発明で想定されていた用途と評価されるべきであることは、前記3で説示したとおりであり、乙1発明との相違点になるとはいえない。
また、②投与方法を0.75μg/日の用量で経口投与されるものに限定している点については、前記3(3)で説示したとおり、乙1文献に記載された発明との相違点になるとはいえない。
そうすると、本件訂正発明5のうち、少なくとも橈骨の骨折予防を用途とする構成については、乙1文献に記載された発明と同一であるというべきであり、新規性が欠如している。
よって、本件訂正5によって、新規性欠如の無効理由が解消するとはいえない。
3.コメント
「乙1文献」には、エルデカルシトールを骨粗鬆症治療薬として用いることが記載されており、「本件発明1」と「乙1発明」とは、「エルデカルシトールを含んでなる」(構成要件1A)「医薬組成物」(構成要件1C)において一致している。
本件発明1は、「非外傷性である前腕部骨折を抑制するための」(構成要件1B)医薬組成物であるところ、「乙1発明」は骨粗鬆症治療薬であり、この点において本件発明1と乙1発明が相違するといえるかが問題となった。
「乙1文献」には、エルデカルシトール(ED-71)投与により腰椎および大腿骨の骨密度が増加することまでは記載されているが、「前腕部」でどうなのか、ましてや「骨折を抑制する」ことについての記載は一切ない。
本件発明1の新規性が否定されるには、「非外傷性である前腕部骨折を抑制する」ことも含めて本件発明1の全ての構成要件を兼ね備えた発明が、出願日(優先日)当時の技術常識に照らして、乙1文献に記載されているに等しいといえることが、論理的に示される必要がある。
中外製薬「ほねとひざ.comネット」(https://hone-hiza.com/op/op_3.html)によれば、手首の骨折(橈骨遠位端骨折)は、大腿骨近位部に比べ、45 歳以上から急増する、骨折の初発部位として多い部位とされている。
以上を踏まえると、裁判所の新規性判断には、いくつかの疑問点があるように思われる。
- 裁判所の判断は、技術常識としての骨粗鬆症薬が抱える課題または期待(些細なきっかけで骨折を生じないようにすること)の存在をもって、乙1文献においては些細なきっかけで骨折を生じさせないようにする(「前腕部骨折を抑制する」)ことをエルデカルシトールにより「解決できる」ことが開示されているとして、すなわち、骨粗鬆症薬一般の「課題または期待」の開示を特定のエルデカルシトールの「解決手段」の開示にすり替えていないだろうか。実際、乙1文献は、これまでのビタミンD誘導体の報告には椎体も非椎体に対しても効果があったりなかったりと結果は様々であることを説明しているようである。エルデカルシトールが「前腕部骨折を抑制する」ことのエビデンスはあったのだろうか。
- 「骨粗鬆治療薬」に「非外傷性である前腕部骨折を抑制する」との構成は含まれていたことを理由として本件発明1の新規性を否定した裁判所のロジックや、「原発性骨粗鬆症患者は骨粗鬆症患者のうちの一部である」ことを理由として本件発明2の新規性を否定した裁判所のロジックは、公知の上位概念の用途に含まれる下位概念の用途は新規性が必ず否定されるというロジックに読めるが本当だろうか。この点は進歩性の判断として議論すべき点のようにも思える。裁判所は、一応「本件においては・・・顕著な効果を認めることはできない。」とも判断しているが・・・。
- 「乙1発明のエルデカルシトールにおいても、当然に当該部位に係る骨折予防についても有効であることが具体的に想定されていたと認められる」、「エルデカルシトールが投与されたとき、乙1発明のエルデカルシトールが投与されたのか、本件発明1のエルデカルシトールが投与されたのかを区別することができるものではない。本件発明1の一部の用途は、作用機序の点からも、乙1発明の用途と区別することはできない。」という裁判所の認定は、「非外傷性である前腕部骨折を抑制する」ことが「知られていた」ことを認定していることと厳密には異なる。引用発明に内在している「非外傷性である前腕部骨折を抑制する」という技術思想が「知られていなかった」としても新規性を否定する引用発明になるとの立場を裁判所が示した一例と考えるべきだろうか。
ところで、エディロール®(エルデカルシトール)は、「明らかな前腕骨の骨折抑制効果を示した本邦初の薬剤」であることが、中外製薬の資料に記載されている。この点は、本件発明の特許性議論にポジティブに働くことはないのだろうか。
ED-71は新規椎体骨折だけでなく日本人で初めて非椎体骨折の抑制効果のエビデンスを得た骨粗鬆症治療薬である。
ED-71は新規椎体骨折の骨折発生頻度においてアルファカルシドールに対する優越性が検証され,相対骨折リスク減少率は26%であった。更に,ED-71のプラセボに対する相対骨折リスク減少率は約50%と推定できた。また,ED-71は非椎体の主要3部位(大腿骨,上腕骨,前腕骨)の骨折発生頻度がアルファカルシドールより有意に低く,特に,前腕骨の骨折については,ED-71はアルファカルシドールに対して相対骨折リスクを71%減少させ,明らかな前腕骨の骨折抑制効果を示した本邦初の薬剤である。
※エディロールカプセル0.5 μg/エディロールカプセル0.75 μg(エルデカルシトール) 第1部(モジュール 1)申請書等行政情報及び添付文書に関する情報 1.5 起原又は発見の経緯及び開発の経緯 1.5.6 特長及び有用性(https://www.pmda.go.jp/drugs/2011/P201100025/index.html)より引用
中外製薬は、本件判決を不服として控訴している。
参考:
- 2022.06.09 中外製薬 press release: エディロールカプセルに関する特許権侵害訴訟における控訴について
- 2020.05.29 過去記事: 中外 エディロール用途特許侵害で沢井・日医工を提訴

4.その他
沢井製薬及び日医工は、本件用途特許第5969161号に対して、2019年12月23日に無効審判を請求した(無効2019-800112)。特許庁は、甲1(「乙1文献」と同じ)に基づく新規性欠如及び進歩性欠如を理由として本件特許を無効であると審決しており、その判断を不服として中外製薬が提起した審決取消訴訟の審理が、現在、知財高裁にて係属している(令和3年(行ケ)10066; 出訴日2021年5月21日)。本件用途特許に係る特許権の存続期間満了日は2030年4月28日(期間延長なし)。
また、エルデカルシトールの結晶特許第3429432号に係る延長された特許権を保有する中外製薬が、沢井製薬・日医工・日産化学がその後発医薬品を製造・販売する行為は同特許権の侵害に当たると主張して、その差止・廃棄を求めた事件については、裁判所(東京地裁・民事第46部)が、中外製薬の請求を棄却しており、中外製薬は控訴を断念したようである。
参照:



コメント