Summary
- アムジェン社が販売する乾癬治療薬Otezla®(有効成分: アプレミラスト)の米国ANDA訴訟で、2023年4月19日、CAFCは、ラセミ混合物として記載された先行文献からエナンチオマー(立体的に純粋なアプレミラストを含む医薬組成物)の非自明性を認めた米ニュージャージー州連邦地裁の判断を支持した。
- CAFCは、当業者であれば立体的に純粋なアプレミラストを含む医薬組成物を作ろうと試みる理由を抱いたであろうことやそうすることで成功すると合理的に期待したであろうことについて、サンド社の主張は明白で説得力のある証明に至っていない、とした地裁の判断には誤りはないと判断した。
- 本事案は、二次的考慮事項が非自明性に有利に働いた例としても参考になる。
- 日本では、進歩性欠如を理由とした拒絶審決の取消訴訟で原告の請求は棄却されている。
1.背景
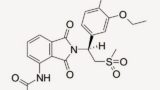
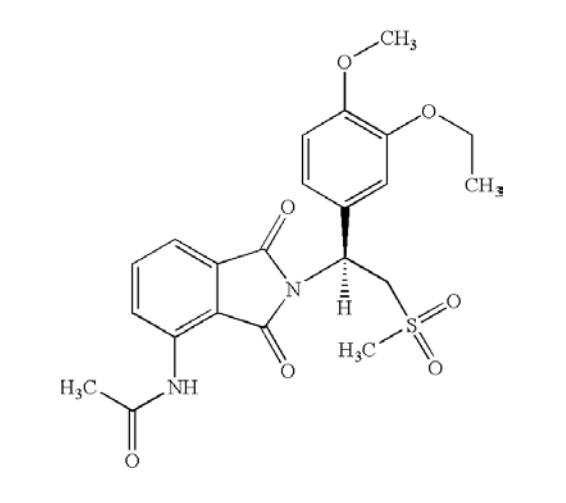
アムジェン社(Amgen Inc.)は、ホスホジエステラーゼ4(PDE4)阻害剤であり、以下の構造式で示されるアプレミラスト(apremilast)を有効成分とする乾癬治療薬Otezla®を米国で販売している。
本件(CAFC 2022-1147, 2022-1149, 2022-1150, 2022-1151)は、サンド社(Sandoz Inc.)を含む複数の後発医薬品メーカーが米国食品医薬品局(FDA)にOtezla®の後発医薬品の簡略新薬承認申請(ANDA)を提出したことを受けて、同後発医薬品が、Otezla®を保護する米国特許7,427,638号(以下、「’638特許」という。)を含む複数の特許権を侵害しているとして提起された訴訟である。
中でも、’638特許の請求項は、立体的に純粋なアプレミラストを含む医薬組成物を対象とするものであった。
6. The pharmaceutical composition of claim 5 [A pharmaceutical composition comprising stereomerically pure (+)-2-[1-(3-ethoxy-4-methoxyphenyl)-2-methylsulfonylethyl]-4-acetylaminoisoindoline-1,3-dione, or a pharmaceutically acceptable salt, solvate or hydrate, thereof; and a pharmaceutically acceptable carrier, excipient or diluent, wherein said pharmaceutical composition is suitable for parenteral, transdermal, mucosal, nasal, buccal, sublingual, or oral administration to a patient, wherein the amount of stereomerically pure (+)-2-[1-(3-ethoxy-4-methoxyphenyl)-2-methylsulfonylethyl]-4-acetylaminoisoindoline-1,3-dione is from 1 mg to 1000 mg, wherein the amount of stereomerically pure (+)-2-[1-(3-ethoxy-4-methoxyphenyl)-2-methylsulfonylethyl]-4-acetylaminoisoindoline-1,3-dione is from 5 mg to 500 mg], wherein the amount of stereomerically pure (+)-2-[1-(3-ethoxy-4-methoxyphenyl)-2-methylsulfonylethyl]-4-acetylaminoisoindoline-1,3-dione is from 10 mg to 200 mg.
サンド社らは、’638特許が先行文献である米国特許6,020,358号(以下、「’358特許」とう。)及びPCT出願WO01/034606に対して自明(obvious)であるから無効であると主張した。
特に、「’358特許」の明細書には、(+)エナンチオマーであるアプレミラスト50%と(-)エナンチオマー50%とからなるラセミ混合物が実施例12として記載されており、また、一般的にはラセミ体を個々のエナンチオマーに分離することができることも記載されていた。
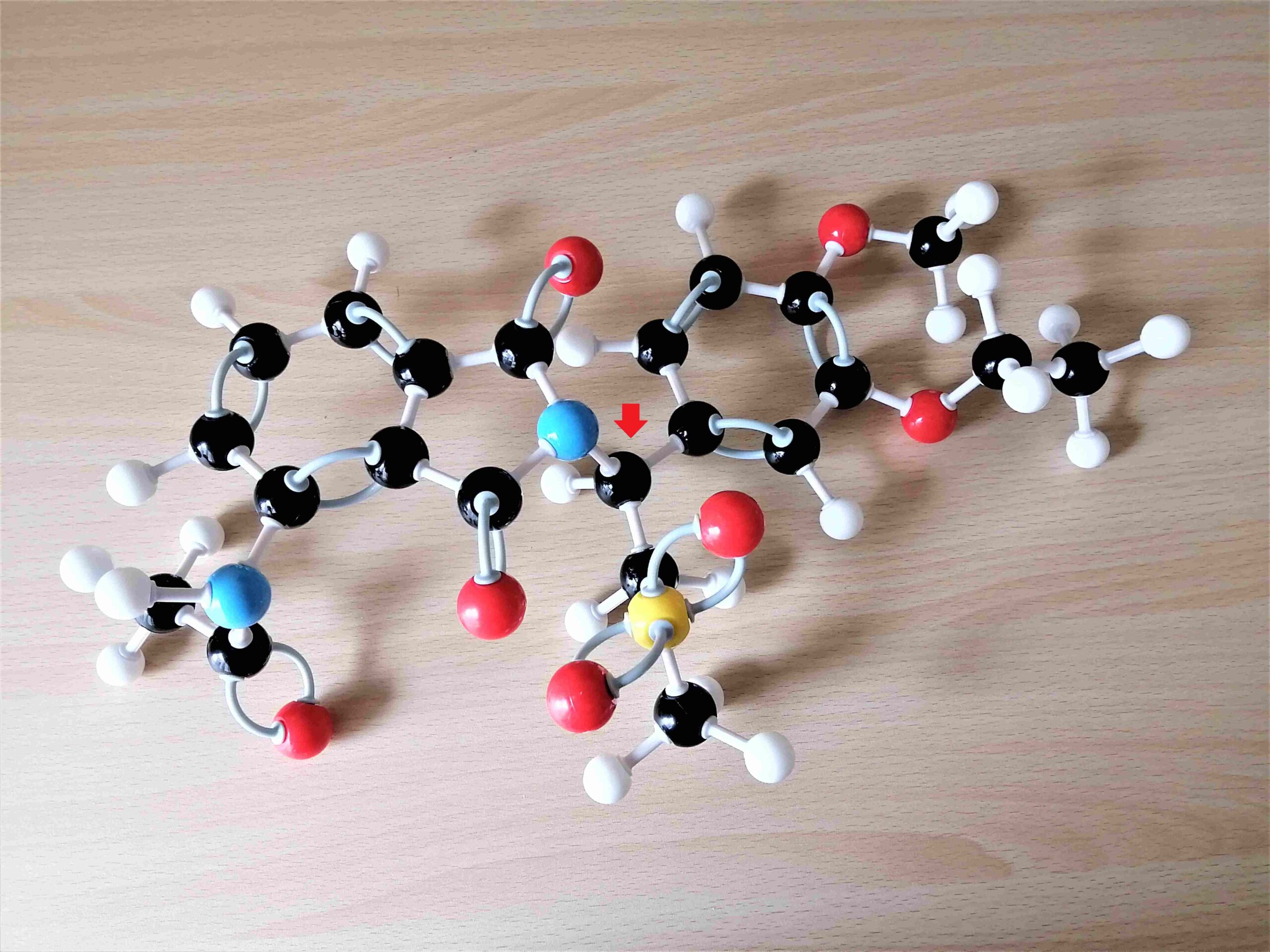
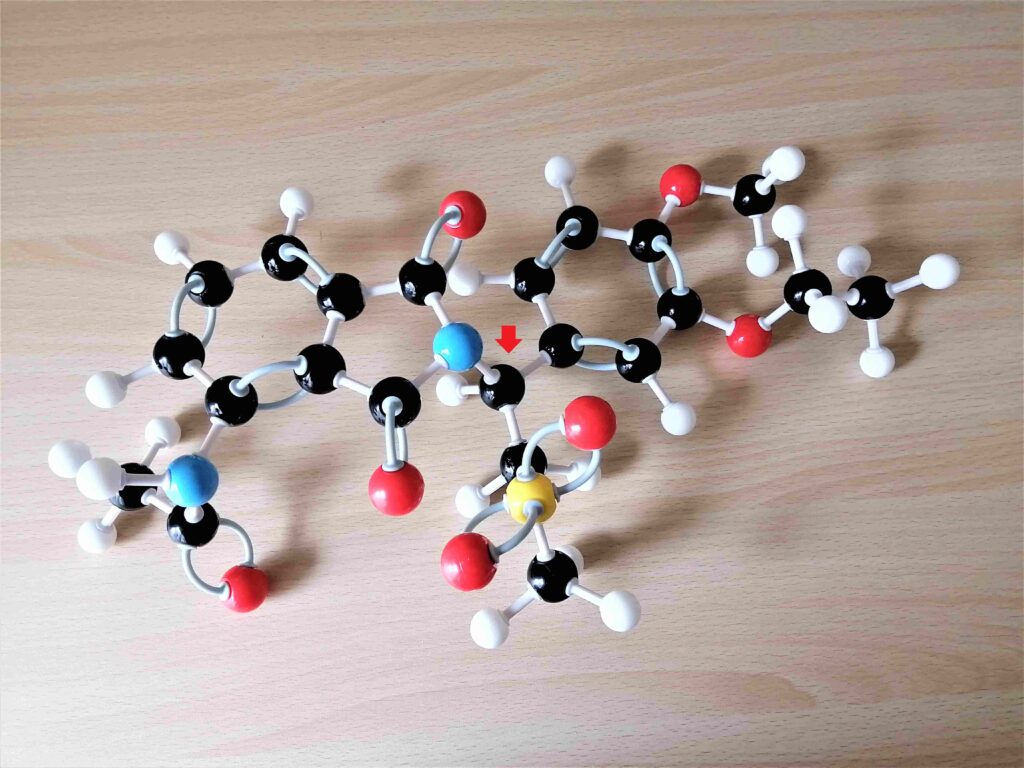
なお、アプレミラストが有する1つの不斉炭素は下の赤色矢印の位置にある。
Otezla®は、もともとセルジーン社(Celgene Corporation)の製品であったが、BMS社(Bristol Myers Squibb)によるセルジーン社の買収に伴い、アムジェン社に承継された経緯がある。
- 2019.08.26 BMS press release: Bristol-Myers Squibb Announces Agreement Between Celgene and Amgen to Divest OTEZLA® for $13.4 Billion
- 2019.08.26 Amgen press release: Amgen To Acquire Otezla® For $13.4 Billion In Cash, Or Approximately $11.2 Billion Net Of Anticipated Future Cash Tax Benefits
2.原審の判断
米ニュージャージー州連邦地方裁判所は、’358特許の実施例12に開示されたラセミ混合物からアプレミラストを分離することに十分な動機も成功への合理的期待もなかったとの判断から、’638特許は先行文献から自明(obvious)であるとするサンド社の主張を退けた(Nos. 3:18-cv-11026-MAS-DEA, 3:18-cv-11267-MAS-DEA, 3:18-cv-11269-MAS-DEA, 3:19-cv-18806-MAS-DEA, Judge Michael A. Shipp.)。
また、同地裁は、以下の点は非自明性(nonobviousness)の認定に強く有利に働くとも指摘した。
- アプレミラストの予想外の効力と副作用プロファイル
- 患者への経口投与に適した乾癬治療薬に対する長年のアンメットニーズが存在
- アプレミラストは、サリドマイドと構造的に類似し、安全性に懐疑的な意見があったこと
- FDA承認達成後のOtezla®の商業的成功
サンド社はこの連邦地裁判決を不服としてCAFC(米国連邦巡回区控訴裁判所)に控訴した。
3.CAFCの判断
2023年4月19日、CAFC(米国連邦巡回区控訴裁判所)は、サンド社が、先行技術が当業者に実施例12のラセミ混合物をエナンチオマーに分離する理由や動機を与えたことを立証する責任を果たしていない、すなわち、当業者が実施例12のラセミ混合物の望ましい特性はアプレミラスト異性体に由来するものであると信じる理由を抱いたであろう、又は当業者が実施例12の混合物を分離することで成功すると合理的に期待したであろうという明白で説得力のある証明に至っていない、とした連邦地裁の判断には明確な誤りはないと判断した(CAFC 2022-1147, 2022-1149, 2022-1150, 2022-1151)。
We find no clear error in the court’s holding that Sandoz did not meet its burden of establishing that the prior art gave a skilled artisan reason or motivation to resolve the Example 12 racemic mixture into its enantiomers, to conclude that a skilled artisan would have had reason to believe that the desirable properties of the Example 12 racemic mixture derived in whole or in part from the apremilast isomer, or that a skilled artisan would have had a reasonable expectation of success in resolving the mixture of Example 12.
また、CAFCは、二次的考慮事項(secondary considerations)としても知られる非自明性の客観的指標(objective indicia of nonobviousness)を非自明性(nonobviousness)の認定に強く有利に働かせた連邦地裁の認定に誤りはないと判断した。
In summary, the district court did not err in finding that the objective indicia of nonobviousness strongly weigh in favor of a finding that claims 3 and 6 of the ’638 patent would not have been obvious over the ’358 patent or the ’606 application.
4.コメント
CAFCは、ラセミ混合物として記載された先行文献からエナンチオマーの非自明性を認めた連邦地裁判断を支持した。
特許発明は自明(obvious)である(特許は無効である)と主張したサンド社は、「当業者であれば、乾癬を治療するために、立体的に純粋なアプレミラストを含む医薬組成物を作ろうと試みる『理由』があったであろうこと」及び「そうすることで成功するという合理的な期待」があったことを証明しなければならなかった。
CAFC及び原審(連邦地裁)は、公知ラセミ混合物には(+)と(-)のエナンチオマーが含有していることは当然であっても、そのエナンチオマーに着目した「であろう」といえる動機付けがあったのかどうかを厳格に判断したといえる。
また、本事案は、二次的考慮事項(secondary considerations)が非自明性(nonobviousness)の判断に有利に働いた例としても参考になりそうだ。
Otezla®の2022年グローバル売上は$2,288m(米国は$1,886m)(2023.02.09 10-K Annual reportより)。二次的考慮事項のひとつである「商業的成功」に疑いはないだろう。
Otezla®のOrange bookによると、本件米国特許7,427,638号(「’638特許」)は2028年2月16日まで存続する。
さて、米国では、上述のとおり、ラセミ混合物として記載された先行文献から立体的に純粋なアプレミラスト(エナンチオマー)を含む医薬組成物の発明の非自明性が認められたわけであるが、日本ではどのように判断されているのだろうか。
本件米国特許7,427,638号(’638特許)に相当する日本特許ファミリーのひとつ、特願2003-577877(国際出願PCT/US2003/008738; WO2003/080049; 特表2005-525386)においては、やはり進歩性が問題となり、拒絶審決取消訴訟において進歩性欠如の判断が下されるに至った(2014.08.07 「セルジーン v. 特許庁長官」 知財高裁平成25年(行ケ)10170)。
知財高裁の判断のとおり、立体異性体という点については、当業者は容易に想到し、顕著な効果も認められないと判断された(以下抜粋)。
「技術常識の下では,引用発明の化合物について光学異性体を得て,それらの薬理活性や薬物動態について検討をし,乾癬に適したものを選択することは,通常行うことと考えられる。そして,引用発明の化合物の光学異性体が容易に入手できるものであることやTNF-α阻害活性,PDE4阻害活性,cAMP上昇活性等の薬理活性が慣用の方法により測定できることからすると,引用発明の化合物の二つの光学異性体のうち炎症性疾患の治療により適した方を選択し,炎症性疾患の一つである乾癬に適用することとして本願補正発明に至ることについては,当業者が容易になし得たことであると認められる。
・・・
本願明細書から把握される本願補正発明の効果は,いずれも引用発明と比較して当業者が予測し得る範囲を超えた格別顕著なものとまでは認めることはできない。また,薬理作用,バイオアベイラビリティ及び低い副作用という三つの側面を総合して評価しても,本願化合物が,ラセミ体については光学異性体に分離してそれぞれの薬理作用等を検討し,目的に適したものを選択するという本願優先日当時の技術常識にのっとって,引用発明の化合物の二つの光学異性体のうちから(+)異性体を選択した結果もたらされたものにすぎないことを考慮すれば,進歩性を肯定するに足りるものではない。」
公知ラセミ混合物からエナンチオマーの非自明性(進歩性)について、米国での判断と日本での判断とが真逆の結論となった大きな理由は、
米国では、先行文献にラセミ混合物が記載されていても、アプレミラストとして分離すべきラセミ混合物(実施例12)になぜ着目するのかを明確に説明できなければ合理的な動機付けがあるとはいえない、すなわち、非自明性(nonobviousness)を判断する出発点は「引用文献」であったのに対して、日本では、進歩性を判断する出発点として、最初から着目されたのは「引用発明」(先行文献に記載されているアプレミラストとして分離すべきラセミ混合物(実施例12))であった
という点にあるのかもしれない。
なお、日本の分割出願として派生した特許5936521号は、 「ベーチェット病を治療するための」医薬用途発明として特許となっている。


コメント