フォサマックの錠剤特許: 知財高裁平成21年(行ケ)10180
【背景】
原告(メルク)が有する「4―アミノ―1―ヒドロキシブチリデン―1,1-ビスホスホン酸又はその塩の製造方法及び前記酸の特定の塩」に関する特許(特許第1931325号)を無効とした審決(無効2008-800062号)に対して原告が取消しを求めた事案。
- 請求項6:
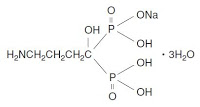
4-アミノ-1-ヒドロキシブチリデン-1,1-ビスホスホン酸モノナトリウム塩トリハイドレートを有効成分として含む,骨吸収を伴う疾病の治療及び予防のための固体状医薬組成物。 - 請求項7:
錠剤である請求項6記載の固体状医薬組成物。
審決は、本件発明6及び7はいずれも甲7発明に基づいて当業者が容易に発明をすることができたものであるから、特許法29条2項の規定に違反してされたものであると判断した。
- 本件発明6及び7と甲7発明との一致点:
「4-アミノ-1-ヒドロキシブチリデン-1,1-ビスホスホン酸モノナトリウム塩トリハイドレートを有効成分として含む,骨吸収を伴う疾病の治療及び予防のための医薬組成物。」
で一致する。 - 本件発明6及び7と甲7発明との相違点:
医薬組成物の態様について、本件発明6が「固体状医薬組成物」、本件発明7が「錠剤」と特定しているのに対し、甲7発明では、そのような特定はなされておらず、注射液やカプセル剤が示されているに止まる点。
【要旨】
裁判所は、
「甲7文献が,特許法29条2項適用の前提となる29条1項3号記載の「刊行物」に該当するかどうかがまず問題となる。」
と指摘したうえで、下記のとおり「刊行物に記載された発明」、特に、化学物質発明についての一般的な判断基準を示した。
「ところで,特許法29条1項は,同項3号の「特許出願前に‥‥頒布された刊行物に記載された発明」については特許を受けることができないと規定するものであるところ,上記「刊行物」に「物の発明」が記載されているというためには,同刊行物に当該物の発明の構成が開示されていることを要することはいうまでもないが,発明が技術的思想の創作であること(同法2条1項参照)にかんがみれば,当該刊行物に接した当業者が,思考や試行錯誤等の創作能力を発揮するまでもなく,特許出願時の技術常識に基づいてその技術的思想を実施し得る程度に,当該発明の技術的思想が開示されていることを要するものというべきである。
特に,当該物が,新規の化学物質である場合には,新規の化学物質は製造方法その他の入手方法を見出すことが困難であることが少なくないから,刊行物にその技術的思想が開示されているというためには,一般に,当該物質の構成が開示されていることに止まらず,その製造方法を理解し得る程度の記載があることを要するというべきである。そして,刊行物に製造方法を理解し得る程度の記載がない場合には,当該刊行物に接した当業者が,思考や試行錯誤等の創作能力を発揮するまでもなく,特許出願時の技術常識に基づいてその製造方法その他の入手方法を見いだすことができることが必要であるというべきである。」
上記一般的な考え方に基づき、裁判所は本件について下記のように判断した。
「(2)本件については,上記のとおり,本件発明6及び7における本件3水和物が新規の化学物質であること,甲7文献には,本件3水和物と同等の有機化合物の化学式が記載されているものの,その製造方法について記載も示唆もされていないところ,前記1(2) の記載内容を検討しても,甲7文献には製造方法を理解し得る程度の記載があるとはいえないから,上記(1) の判断基準に従い,甲7文献が特許法29条1項3号の「刊行物」に該当するというためには,甲7文献に接した当業者が,思考や試行錯誤等の創作能力を発揮するまでもなく,特許出願時の技術常識に基づいて本件3水和物の製造方法その他の入手方法を見いだすことができることが必要であるということになる。
この点,審決は~甲7文献の記載を前提として,これに接した当業者が,思考や試行錯誤等の創作能力を発揮するまでもなく,甲5及び甲12ないし甲14の各文献に記載されている特許出願時の技術常識に基づいてその製造方法その他の入手方法を見いだすことができるものと判断したと解される。
(3)そうすると,本件においては,本件出願当時,甲7文献の記載を前提として,これに接した当業者が,思考や試行錯誤等の創作能力を発揮するまでもなく,本件3水和物の製造方法その他の入手方法を見いだすことができるような技術常識が存在したか否かが問題となるが,次のとおり,本件においては,本件出願当時,そのような技術常識が存在したと認めることはできないというべきである。」
裁判所は、
特許出願時の技術常識として引用された甲5、甲12、甲14の各文献について、
「一般的な化学辞典であるなど、その記載内容が当業者の技術常識であることをうかがわせるものではないことを考慮すれば、~本件優先日当時の技術常識に属する事項であるとすることはできないというべきである。」、または、「特定の化合物の水和物の製造方法が記載されているにとどまるものであり、~これらの記載から、別途の特定の有機化合物について、当業者が思考や試行錯誤等の創作能力の発揮により、その具体的な製造条件に到達し得るとはいえても、有機化合物において、具体的な製造条件を捨象して、一律に、「結晶水は,加熱あるいは乾燥の条件を強くすることにより,順次離脱する」ことが技術常識であるとの結論を導き出すことはできないというべきである。」
として、本件においては、本件出願当時、そのような技術常識が存在したと認めることはできない判断した。
また、被告の提出した実験証明書についても、裁判所は、
「甲6実験証明書と甲10実験証明書の記載は,本件優先日以後に行われた実験結果にすぎず~甲5及び甲12ないし甲14の各文献の内容を知った上での試行錯誤の結果にすぎないものというべきである。したがって,甲6実験証明書と甲10実験証明書記載は,甲12文献記載の「順次離脱」が有機化合物の水和塩結晶における本件優先日当時の技術常識であるか否かの判断を左右するものではないというべきである。」
として技術常識の判断を左右するものではないとした。
審決を取り消す。
【コメント】
特許法29条1項3号の「刊行物に記載された発明」であるためには、特に、それが新規の化学物質である場合には、当該物質の構成が開示されていることに止まらず、その製造方法を理解し得る程度の記載があることを要する。
そして、刊行物に製造方法を理解し得る程度の記載がない場合には、当該刊行物に接した当業者が、思考や試行錯誤等の創作能力を発揮するまでもなく、特許出願時の技術常識に基づいてその製造方法その他の入手方法を見いだすことができることが必要である。
新規性を否定するかもしれない文献があったとしても、その文献に当該物質の製造方法が理解しうる程度の記載があるかどうか、引例適格性を注意深く検討する必要がある。これは進歩性の引用文献についても同じことが言えそうである。
原告はその主張の中で、下記判決を引用したが、本判決自体もこれら過去の判決例に沿うものとなっている。
4-アミノ-1-ヒドロキシブチリデン-1,1-ビスホスホン酸モノナトリウム塩トリハイドレートは日本ではMSDが販売しているフォサマック®錠(Fosamac® Tablets)(帝人ファーマはボナロン®錠(Bonalon® tablet))の有効成分である(一般名: アレンドロン酸ナトリウム水和物、alendronate sodium hydrate)。1日1回の5mg錠(フォサマック®錠5)は2001年6月20日に製造販売承認され、再審査期間も2007年6月19日に終了している。フォサマック®錠5の製造承認年月日(2001年6月20日)をもとに存続期間延長登録出願の有無をIPDLで探ってみると下記3件の特許権が見つかる。
- 医薬用途特許1589937(特公平02-013645):
存続期間延長登録出願番号2001-700093: +5年
= 本権利消滅日: 2008.4.13 - 本件特許(錠剤/製法)1931325(特公平06-062651):
存続期間延長登録出願番号2001-700094: +5年
= 存続期間満了日: 2015.6.11 - 製法特許2106424(特公平07-119229):
存続期間延長登録出願番号2001-700095: +4年7月13日
= 存続期間満了日: 2016.2.1
一方、フォサマック®錠5の後発品は既に下記の通り上市している。
- アレンドロン酸錠5mg「タイヨー」薬価収載2009年5月 大洋薬品
- アレンドロン酸錠5mg「DK」薬価収載2009年5月 日本ケミファ/大興製薬
- アレンドロン酸錠5mg「SN」薬価収載2009年5月 科研製薬/シオノケミカル
- アレンドロン酸錠5mg「マイラン」 薬価収載2010年5月 マイラン製薬
おそらく、医薬用途特許1589937の存続期間満了、又は本件特許の無効審決を待って後発品が参入してきたと考えられるが、無効審決が取り消された本判決に従えば、フォサマック®錠を保護する本件特許が2015年6月11日まで存続することになり、後発品メーカーの販売行為は特許侵害のおそれが生じることになる。しかしながら、メルク(MSD/帝人ファーマ)にとってみれば、週1回錠(フォサマック®錠35mg、2006年7月26日製造販売承認)が主流となった現在においては、1日1回の5mg錠の後発品参入はそれほど大きな打撃ではないのかもしれない。
参考:

コメント