「骨吸収を抑制する方法」に関する特許(特許第3479780号)に係る発明について、特29条2項違反を理由に無効審決が下されたため、特許権者である原告(メルク)が同審決の取消しを求めた事案。
請求項1:
アレンドロネート,薬剤として許容できるその塩およびこれらの混合物より成る群の中から選択されるビスホスホネートを,アレンドロン酸活性体基準で約35~約70mg含み,週一回の投与間隔を有する連続スケジュールに従う経口投与に用いるための,哺乳動物における骨粗鬆症を治療または予防する薬剤組成物。
請求項5:
哺乳動物における骨粗鬆症を治療または予防するためのキットであって,週一回の投与間隔を有する連続スケジュールに従う経口投与により使用すべき旨の指示を含み,単位用量としてアレンドロネート,薬剤として許容できるその塩およびこれらの混合物より成る群の中から選択されるビスホスホネートをアレンドロン酸活性体基準で約35~約70mg含み,かかる単位用量を少なくとも1回分収容する,キット。
【要旨】
原告は、
「引用例3の記載(3c)を含むパラグラフ(以下「パラグラフ1」という。)には,~用法・用量に関し,~単なるオプションが,臨床的意義についての説明もなく列挙されているにすぎず,理論的な根拠や実験による裏付けも示されていない。~したがって,当業者が,引用例3の上記記載に接したとしても,~重大な問題である上部消化管障害という副作用を軽減させるための解決手段として,その用法・用量を採用することを動機づけられることもなければ,その記載によって何かを示唆されることもあり得ない。」
と主張した。
これに対して裁判所は、
「引用例3は,確かに,原告の主張するとおり,上部消化管障害の軽減との関連において,週1回40mgのアレンドロネート投与の有用性に係る,理論的根拠の明示的な記載や実験的な裏付けを伴うものではない。しかしながら,~消化管障害の副作用は,消化管と接触する薬剤の量が多く,接触する時間が長いほど,また,接触頻度が高いほど生じやすく,悪化しやすいことは容易に理解されるところである。したがって,投与間隔を長くする(毎日投与から週2~3回,あるいは週1回投与とする)間欠投与の提案は,それ自体として,上部消化管障害軽減の理論的根拠を示唆するものであり,少なくとも,当業者がこれを試みる動機付けとなるものということができる。」
と判断した。
また、原告は、
「皮下注射による投与においては,胃腸に対する副作用は生じないことが,本件特許出願当時の技術常識であったから,副作用等を引き下げるための方法として,~皮下注射における用法・用量を論ずる引用例3の記載は首尾一貫しておらず,引用例3の著者が,文献23の内容を十分に理解して,パラグラフ1を記載したものではない」
と主張した。
しかし裁判所は、
「皮下注射実験であるとしても,パラグラフ1ないし引用例3の記載が首尾一貫していないとか,引用例3の著者が,文献23の内容を十分に理解していないなどといった非難は当たらない。」
として原告の主張を認めなかった。
さらに原告は、
「アレンドロネートを一日一回連続的に経口投与する場合には,消化管障害という副作用の懸念のために,一定の連続スケジュールに従う高用量(20mgを超える用量)投与を避けることが,優先権主張日当時,当業者の技術常識であったから,引用例2,3に,週1回40mgの投与が記載されていたとしても,当業者が,これを採用することについては,重大な阻害事由があり,容易ではない」
と主張した。
しかし裁判所は、
「原告主張の上記技術常識は,それが認められるとしても,~消化管内壁が,例えば40mgのアレンドロネートと,連続して毎日接触する状態と,接触しない日が6日間続く(その間に,自然治癒力による回復がある)状態とを同列に論ずることができないことは明らかである。したがって,原告主張の上記技術常識は,当業者が,引用例2,3記載の投与方法を試みるに当たって妨げとなるようなものということはできず,これを阻害事由とする原告の主張は失当である。」
と判断した。
また、裁判所は、
「一定の範囲内で,ビスホスホネートの投与量と骨疾患に対する治療効果との間に相関関係があることは明らかであるから,毎日投与の方法を,投与間隔を空ける間欠投与の方法に変更しようとする場合に,治療効果を維持しようとすれば,間欠投与の方法で投与するビスホスホネートの総量を,同一治療期間に係る毎日投与の方法による投与総量と同じにすること(間欠投与の方法による1回当たりの投与量を,そうなるように設定すること)は,当業者が最初に試みることであるといえる。~本来の治療効果を確保するため,間欠投与における1回当たりの投与量を,毎日投与における単位用量を基礎として,投与間隔として空ける日数に応じ比例的に設定することを検討する場合においては,参考とする上記実験例が,皮下注射による投与方法であるかどうかや,上部消化管障害の副作用を生ずるかどうかは,直接関係する事項ということはできない。」
と言及した。
請求棄却。
【コメント】
用法・用量に関して進歩性が争われたケース。
投与方法等で限定されたクレームが一定の条件のもと用途発明として認める旨を明確化した「医薬発明」の審査基準が「第VII部 特定技術分野の審査基準」の第3章として2005年4月に公表されたが、米国に比べ日本においては、まだまだこの点で争われた判決の蓄積が少ないので、本事案は今後の用法・用量に関する進歩性主張を検討する題材として参考になる。
なお、引例中の記載が理論的根拠の明示的な記載や実験的な裏付けを伴うものではない点や、引例の内容の首尾一貫性や引例著者の理解不十分といった点を理由とする、進歩性判断における引例適格性が無い旨の主張は、新規性判断における引例適格性と違ってなかなか難しいだろう。
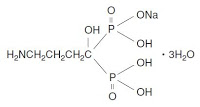
アレンドロネート、すなわちアレンドロン酸ナトリウム水和物(Alendronate sodium hydrate)を有効成分とする骨粗鬆症治療薬は日本においては万有製薬より販売されている(販売名: フォサマック、Fosamac)。
See also
- 万有製薬ホームページより
【用法・用量】
通常、成人にはアレンドロン酸として35mgを1週間に1回、朝起床時に水約180mLとともに経口投与する。 なお、服用後少なくとも30分は横にならず、飲食(水を除く)並びに他の薬剤の経口摂取も避けること。 - 2005.01.28 「Merck v. Teva」 CAFC Docket No. 04-1005
本件特許第3479780号のファミリーである米国特許もCAFCで無効とされた。

コメント