 *Case2019
*Case2019 2019.08.27 「アルコン・協和キリン v. X」 最高裁平成30年(行ヒ)69
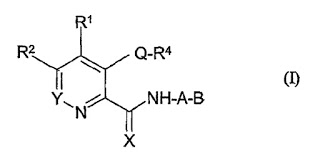
化合物の医薬用途に係る特許発明の進歩性の有無に関し当該特許発明の効果が予測できない顕著なものであることを否定した原審の判断に違法があるとされた事例: 最高裁平成30年(行ヒ)69【背景】「アレルギー性眼疾患を処置するためのドキセピン誘導体を含有する局所的眼科用処方物」に関する特許(第3068858号)に対する無効審判請求の不成立審決取消訴訟において、原審(2017.11.21 「X v. アルコン...