Summary
- 5-HT1A部分作動薬を双極性障害の「うつ病エピソード」の治療に使用できることが技術常識であるとはいえないとした本件審決の認定に誤りがあるから、その認定を前提として本件医薬用途発明の一部が実施可能要件・サポート要件違反であるとした無効審決は取り消された。
- 但し、双極性障害の「躁病エピソード」の治療に係る部分については、本件審決において実質的な判断が示されていないとして、その部分の実施可能要件・サポート要件の適否は判断されなかった。
-
本判決に対しては、上告受理申立てがされている。しかし、上告不受理により本判決が確定し審判が再審理となれば、その判断の帰趨は、無効審決を受けてエビリファイ®ジェネリックに「双極性障害における躁症状」の効能追加承認を与えた厚生労働省の判断と、当該効能追加販売に踏み切った各ジェネリックメーカーの決断が、それぞれ正しいものだったのかという問いに答えを与えることになるだろう。
1.背景
(1)エビリファイ®ジェネリック初参入は「統合失調症」のみの虫食い
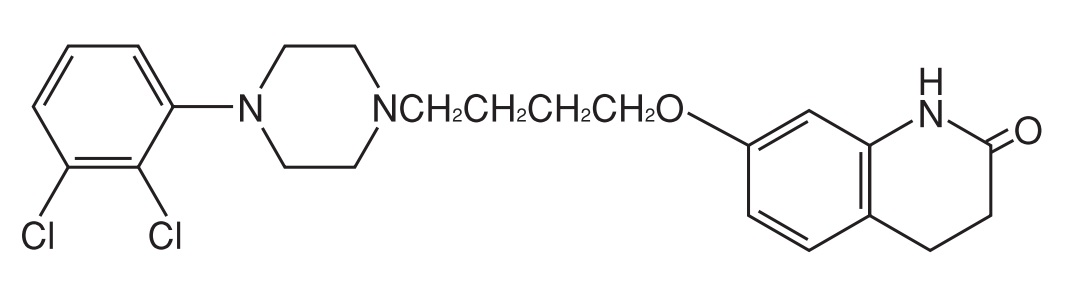 エビリファイ®は、アリピプラゾール(aripiprazole)を有効成分とする抗精神病薬である。
エビリファイ®は、アリピプラゾール(aripiprazole)を有効成分とする抗精神病薬である。
グローバル売上は 2014年度には6,542億円に達し、大塚ホールディングスの連結売上高の約4割を占めた。
現在は、ジェネリック参入により売上は落ち込んでいるが、新剤形である月1回投与回製剤「エビリファイメンテナ」が売り上げを伸ばしている。
日本では、エビリファイ®は「統合失調症」の効能・効果で2006年1月に製造販売承認となり、その後「双極性障害における躁症状」、「うつ病・うつ状態」、「小児期の自閉スペクトラム症に伴う易刺激性」の効能・効果を次々と追加し、適応症を拡大してきた。
2017年2月には、ジェネリックが初承認となったが、「双極性障害における躁症状」及び「うつ病・うつ状態」の効能・効果を保護するエビリファイ®の医薬用途特許(第4178032号)が存在していることから、ジェネリックの効能・効果は「統合失調症」のみ(いわゆる「虫食い」)となった。
この医薬用途特許は、20年の存続期間満了日が2022年1月29日であったところ、エビリファイ®の「双極性障害における躁症状」及び「うつ病・うつ状態」の効能追加承認に基づいてそれぞれ3年4月19日及び4年6月3日の期間が延長され、ジェネリックが先発品エビリファイ®と同一の効能・効果を取得することを阻止する大きな砦となっていた。
参考: 沢井製薬の戦略考察含め、ジェネリックメーカーの動きについては以下の記事を参照。
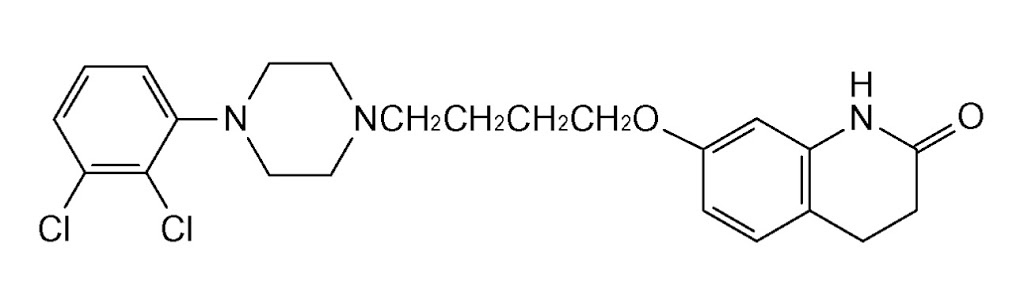

しかし、2020年5月、ジェネリックメーカー各社(共和薬品工業、ニプロ、東和薬品及びMeiji Seikaファルマ)がこの医薬用途特許に対して各々請求した特許無効審判事件(無効2018-800113、無効2018-800123、無効2018-800127、無効2018-800130)において、特許庁は、エビリファイ®の「うつ病・うつ状態」の効能・効果を保護する請求項2に係る発明についての無効の主張を退けたが、エビリファイ®の「双極性障害における躁症状」の効能・効果を保護する請求項1、4及び5に係る発明についての無効の主張を認めるという一部無効審決をした。
(2)一部無効審決を受け、ジェネリックが「双極性障害における躁症状」の効能追加
本記事で紹介する知財高裁判決により前記一部無効審決は取り消されることになるが、この審決を以って、2020年7月、厚生労働省は、エビリファイ®の効能・効果のうち「双極性障害における躁症状」についてのパテントリンケージを解除し、ジェネリックに「双極性障害における躁症状」の効能・効果の追加承認を与えることとした。
そして、各ジェネリックメーカーは、「双極性障害における躁症状」の効能・効果の追加承認取得を発表、効能追加販売に踏み切った。
- 2020.07.22 Meiji Seikaファルマ: 抗精神病薬「アリピプラゾール『明治』」「効能・効果」および「用法・用量」の追加承認取得に関するお知らせ
- 2020.07.22 日医工: アリピプラゾール錠3mg/6mg/12mg「日医工」アリピプラゾールOD錠3mg/6mg/12mg/24mg「日医工」アリピプラゾール散1%「日医工」双極性障害における躁症状の改善に対する効能・効果および用法・用量追加のお知らせ
- 2020.07.01 ニプロ: アリピプラゾール錠3mg/6mg/12mg「ニプロ」 「効能・効果」、「用法・用量」及び「使用上の注意」改訂のお知らせ
- 2020.07.29 共和薬品工業: アリピプラゾール錠/散/OD錠「アメル」-効能・効果および用法・用量追加承認取得のお知らせ-
(3)一部無効審決から審決取消訴訟へ
本記事で紹介する判決は、上記特許庁がした審決を不服として提起された審決取消訴訟(令和2年(行ケ)10077, 10078, 10079, 10080, 10081, 10082, 10083)のうち、Meiji Seikaファルマが請求した特許無効審判事件の審決取消訴訟についてのものである。
本件訴訟(知財高裁令和2年(行ケ)10080; 10081)は、発明の名称を「5-HT1A受容体サブタイプ作動薬」とする原告(大塚製薬)の特許第4178032号について、被告(Meiji Seika ファルマ、参加人として大原薬品工業)が特許無効審判を請求した事件(無効2018-800130号)において、特許庁が、原告の訂正を認めた上、請求項1、4及び5に係る発明についての特許を無効とし、請求項2に係る発明についての審判請求は成り立たないとする審決をしたため、原告が、被告両名を相手方として、本件審決のうち請求項1、4及び5に係る部分の取消しを求め(第1事件訴訟)、一方、被告Meiji Seika ファルマが、請求項2に係る部分の取消しを求め(第2事件訴訟)た事案である。
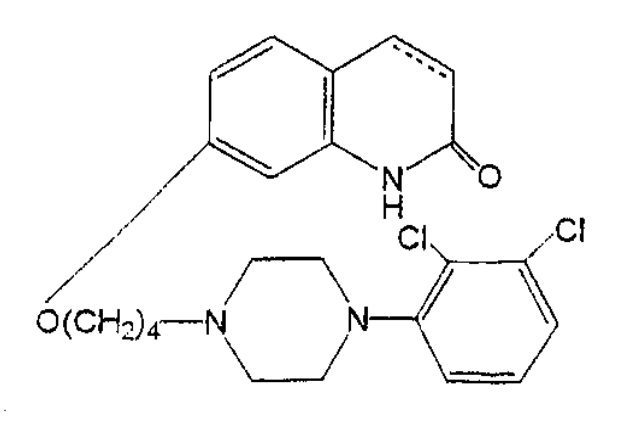
本件発明は、エビリファイ®の有効成分であるアリピプラゾールがドーパミンD2受容体に強い親和性で結合し、ドーパミンD3受容体及び5-HT7受容体に中等度の親和性で結合すること等が報告されていたところ、5-HT1A受容体サブタイプにおける作動活性を有することを発見したことに基づき、5-HT1A受容体サブタイプに関連した中枢神経系の障害に罹患した患者を治療する方法を提供するものである。本件明細書には5-HT1A受容体におけるアリピプラゾールの結合親和性を評価する薬理学的試験(in vitro試験)の結果が記載されていた。
本事件のポイントは、エビリファイ®の「うつ病・うつ状態」の効能・効果を保護する請求項2と「双極性障害における躁症状」の効能・効果を保護する請求項1、4及び5について実施可能要件・サポート要件の判断の前提となった、5-HT1A受容体部分作動薬と各疾患治療との結びつきに関する本件出願当時の技術常識の認定である。
以下の表1に各請求項についての審決と本件判決の結論を対比した。
| 本件発明 | 訂正後の請求項 | 審決の理由 | 審決 | 本件判決 |
|---|---|---|---|---|
| 1 | 鬱病,最近のエピソードが軽い躁,躁,混合状態,鬱,又は特定できない症状の発現を有する双極性I型障害,エピソードが軽い躁症状の発現を伴った再発大鬱症状の発現及び循環型を有する双極性II型障害からなる群から選ばれた5-HT1A受容体サブタイプに関連した中枢神経系の障害を治療するための医薬組成物であって,式(1)・・・(省略)・・・のカルボスチリル化合物,及び医薬として許容されるその塩又は溶媒和物の治療有効量を含む医薬組成物。 | 実施可能要件違反 サポート要件違反 | 無効 | 審決を取り消す(第1事件訴訟) |
| 2 | 5-HT1A受容体サブタイプに関連した中枢神経系の障害である鬱病を治療するための医薬組成物であって,式(1)・・・(省略)・・・のカルボスチリル化合物,及び医薬として許容されるその塩又は溶媒和物の治療有効量を含む医薬組成物。 | 実施可能要件違反及びサポート要件違反との主張は いずれも理由がない | 請求不成立 | 被告Meijiの請求を棄却(第2事件訴訟) |
| 4 | 障害が,最近のエピソードが軽い躁,躁,混合状態,鬱,又は特定できない症状の発現を有する双極性I型障害である,請求項1記載の医薬組成物。 | 実施可能要件違反 サポート要件違反 | 無効 | 審決を取り消す(第1事件訴訟) |
| 5 | 障害が,エピソードが軽い躁症状の発現を伴った再発大鬱症状の発現及び循環型を有する双極性II型障害である,請求項1記載の医薬組成物。 | 実施可能要件違反 サポート要件違反 | 無効 | 審決を取り消す(第1事件訴訟) |
2.裁判所の判断
- 第1事件の原告主張の取消事由はいずれも理由があるから、本件審決のうち、本件発明1、4及び5に係る部分は取り消す。
- 第2事件の被告Meiji主張の取消事由はいずれも理由がないから、被告Meijiの請求は棄却する。
(1)被告Meijiの本案前の主張
被告Meijiは、
- 原告は、訴状訂正申立書を提出して、第1事件訴訟に係る訴えにおいて被告Meijiのみを当事者とし、被告大原薬品工業を当事者から削除する旨の訂正をし、被告大原薬品工業に対する訴えの取下げをした。
- これにより本件発明1、4及び5に係る本件特許を無効とする本件審決は、被告大原薬品工業との関係においては、出訴期間の経過により確定しているから、被告Meijiに対する第1事件訴訟に係る訴えは、訴えの利益を欠く不適法なものとして却下されるべきである。
と主張した。
しかし、裁判所は、
- 訴えの取下げは、取り下げる旨が明確に記載されていることを要するものと解されるところ、本件訴状訂正申立書の題名及び記載内容からは、原告が被告大原薬品工業に対する訴えを取り下げる旨が明確に記載されているものとは認められないこと。
- 本件訴訟の経過に照らすと、本件訴状訂正申立書による第1事件訴状の訂正は、撤回されたものと認めるのが相当であること。
から、被告Meijiの上記主張は理由がないと判断した。
(2)「うつ病」に対する治療効果に関する技術常識
裁判所は、
- 認定事実によれば、本件出願当時、5-HT1A受容体部分作動薬が抗うつ作用を有することは技術常識であった。
- そうすると、本件出願当時、5-HT1A受容体部分作動薬一般が上記5-HT1A受容体部分作動作用に基づく抗うつ作用により「うつ病」に対して治療効果を有することは技術常識であった。
と判断した。
(3)「双極性障害のうつ病エピソード」に対する治療効果に関する技術常識
裁判所は、医薬品の開発の実情、医薬品の承認審査制度の内容、特許法の記載要件の審査は法目的を踏まえてされるべきであることを鑑み、以下のとおり、医薬用途発明について「その物の使用する行為」としての「実施」をすることができるというに足ることとはどのようなことかを判示した。
「医薬品の開発は,基礎研究として対象疾患の治療の標的分子(受容体等)を探索し,標的分子(受容体等)に対する薬理作用及び当該薬理作用を有する化合物を探索する薬理試験(in vitro 試験,動物実験)が実施され,このような薬理試験の結果として,化合物が有する薬理作用が疾患に対する治療効果を有すること(「医薬の有効性」)について合理的な期待が得られた段階で医薬用途発明の特許出願がされるのが一般的であるものと認められる。
一方で,薬機法は,医薬品の製造販売をしようとする者は,その品目ごとにその製造販売についての厚生労働大臣の承認を受けなければならない旨規定し(14条1項),その承認審査・・・では,申請に係る化合物の薬効及び安全性(副作用,有害事象の有無及び程度等)を総合的に考慮し,「医薬の有用性」について審査している。
以上のような医薬品の開発の実情,医薬品の承認審査制度の内容,特許法の記載要件(実施可能要件,サポート要件)の審査は,先願主義の下で,発明の保護及び利用を図ることにより,発明を奨励し,もって産業の発達に寄与するとの特許法の目的を踏まえてされるべきものであることに鑑みると,物の発明である医薬用途発明について「その物の使用する行為」としての「実施」をすることができるというためには,当該医薬をその医薬用途の対象疾患に罹患した患者に対して投与した場合に,著しい副作用又は有害事象の危険が生ずるため投与を避けるべきことが明白であるなどの特段の事由がない限り,明細書の発明の詳細な説明の記載及び特許出願時の技術常識に基づいて,当該医薬が当該対象疾患に対して治療効果を有することを当業者が理解できるものであれば足りるものと解するのが相当である。」
そして、裁判所は、これを本件について当てはめ、
- 本件出願当時、5-HT1A受容体部分作動薬一般がその抗うつ作用により双極性障害のうつ病エピソードに対して治療効果を有することは技術常識であった。
- したがって、「5-HT1A部分作動薬を双極性障害の「うつ病エピソード」の治療に使用できることが技術常識であるとはいえない」とした本件審決の判断は誤りである。
と判断した。
「本件審決が述べる「双極性障害の患者に抗うつ薬を使用した場合,躁病エピソードの誘発,軽躁エピソードの誘発,急速交代化の誘発,及び混合状態の悪化等」の「様々な有害事象が生じる危険性」については,本件出願当時,抗うつ薬と気分安定薬とを併用することにより,躁転のリスクコントロールが可能であり,躁転発生時には抗うつ薬の中止又は漸減により対応可能であると考えられていたこと・・・に照らすと,上記特段の事由に当たるものと認められない。そして,本件出願当時,5-HT1A受容体部分作動薬一般がその抗うつ作用により双極性障害のうつ病エピソードに対して治療効果を有することが技術常識であったことは・・・認定のとおりである。」
(4)本件発明2に係る実施可能要件・サポート要件の判断の誤り(第2事件関係)について
裁判所は、
- 本件出願当時、5-HT1A受容体部分作動薬一般が抗うつ作用により「うつ病」に対して治療効果を有することは技術常識であったことは前記のとおり。
- 本件明細書に接した当業者は、本件明細書に記載されたアリピプラゾールの薬理学的試験(in vitro試験)の結果及び上記技術常識に基づいて、請求項2に記載の「鬱病」患者に対して5-HT1A受容体部分作動薬である本件カスボスチリル化合物を投与して、当該「鬱病」を治療できることを理解できる。
- したがって、このことを前提として、本件発明2が実施可能要件及びサポート要件に適合するとした本件審決の判断に誤りはない。
と判断した。
(5)本件発明1、4及び5に係る実施可能要件の判断の誤り(第1事件関係)について
裁判所は、
- 本件出願当時、5-HT1A受容体部分作動薬一般がその抗うつ作用により双極性障害の「うつ病エピソード」に対して治療効果を有することは技術常識であったことは前記認定のとおり。
- 本件明細書に接した当業者は、本件明細書の記載されたアリピプラゾールの薬理学的試験(in vitro 試験)の結果及び上記技術常識に基づいて、請求項1に記載の双極性I型障害又は双極性II型障害の「うつ病エピソード」を発症した患者に対して5-HT1A受容体部分作動薬である本件カスボスチリル化合物を投与して、当該「うつ病エピソード」を治療できることを理解できる。
- したがって、「5-HT1A部分作動薬を双極性障害の「うつ病エピソード」の治療に使用できることが技術常識であるとはいえない」としてこれを否定し、本件発明1、4及び5が実施可能要件に適合しないとした本件審決の判断は、その前提において誤りがある。
と判断した。
これに対し、被告らは、
- 原告は、本件カルボスチリル化合物が躁ないし躁症状(原告のいう「躁病エピソード」)の治療に使用できるといった技術常識を証明していないから、本件明細書の発明の詳細な説明の記載は実施可能要件に適合しない。
と主張した。
しかし、裁判所は、
- 本件審決においては、双極性障害の「躁病エピソード」に対する治療効果について実質的な判断が示されたものとはいえないとして、被告らの上記主張は、前記判断を左右するものではない。
と判断した。
(6)本件発明1、4及び5に係るサポート要件の判断の誤り(第1事件関係)について
裁判所は、
- 本件審決が前記のとおり「うつ病エピソード」を治療できることを理解できることを否定して判断したものであるから、その前提において誤りがあるとして、本件発明1、4及び5に係る部分を取り消すことが相当である。
と判断した。
3.コメント
(1)当該医薬用途発明として有用であることが技術常識といえるに足るとは
裁判所は、医薬品の開発の実情、医薬品の承認審査制度の内容、特許法の記載要件の審査は法目的を踏まえてされるべきであることを鑑み、医薬用途発明について「その物の使用する行為」としての「実施」をすることができるというに足ること、言い換えれば、当該医薬用途発明として有用であることが技術常識といえるに足る、とはどのようなことかを判示した。
「当該医薬をその医薬用途の対象疾患に罹患した患者に対して投与した場合に,著しい副作用又は有害事象の危険が生ずるため投与を避けるべきことが明白であるなどの特段の事由がない限り,明細書の発明の詳細な説明の記載及び特許出願時の技術常識に基づいて,当該医薬が当該対象疾患に対して治療効果を有することを当業者が理解できるものであれば足りるものと解するのが相当である。」
そして、裁判所は、審決が述べたような「各種・・・薬を・・・治療に使用することができる・・・一方で,全て・・・とはいえない」という理由、すなわち例外もあるという理由、だけで、本件出願時の技術常識ではなかったとするのではなく、前記の「特段の事由」があるかどうか、そして、本件出願当時に「・・・薬一般が・・・治療効果を有することが技術常識であった」かどうかで判断すべき旨を判示した。
医薬用途の有用性についての技術常識に限ったことではないが、技術常識の主張が認められるためには、それを裏付ける当時の技術文献をどれだけ集められるか、その中から適切な証拠を提出できるかにかかっている。証拠に基づいて主張された技術常識と反する文献が存在したとしても、それが著しい副作用等の明白な特段の事由を示すものではなく、単に例外的なものであって一般的とまではいえない場合には、主張立証された技術常識を覆すほどの反証材料とはならない。
このように、医薬用途の有用性についての技術常識の認定に対して、裏付ける証拠に例外を許さない「全て」要件を課すのは杓子定規で硬直的であって妥当ではない。「一般」に認められていたかどうかで技術常識を認定した本判決の柔軟な考え方は妥当といえるのではないだろうか。
(2)知財高裁は特許庁の無効審決部分を取り消した
裁判所は、エビリファイ®の「うつ病・うつ状態」の効能・効果を保護する請求項2の無効の主張を退けた特許庁の審決を支持したが(第2事件訴訟)、「双極性障害における躁症状」の効能・効果を保護する請求項1、4及び5について無効とした審決を取り消した(第1事件訴訟)。
ア ジェネリック「うつ病・うつ状態」の効能追加承認はいつになるのか?
第2事件訴訟において、裁判所が請求項2の無効を主張するMeiji Seikaファルマの請求を棄却したことにより、エビリファイ®の「うつ病・うつ状態」の効能・効果を保護する請求項2は引き続き有効である。
厚生労働省は、エビリファイ®の効能・効果のうち「うつ病・うつ状態」についてのパテントリンケージを解除してジェネリックに「うつ病・うつ状態」の効能追加承認を与えることは現在もできない(但し、沢井製薬は例外である。参考:「エビリファイ®用途特許を巡るジェネリックメーカーの動き (2)」)。
この医薬用途特許は、エビリファイ®の「うつ病・うつ状態」の効能追加承認に基づいて存続期間が延長されているため、Meiji Seikaファルマのジェネリックが「うつ病・うつ状態」の効能追加承認を取得できるのは、当該特許の請求項2が無効と判断されるか又は先発側が許諾しない限り、2026年8月以降になると考えられる。
イ 効能・効果「双極性障害における躁症状」の攻防は続きそう
本件判決に対しては、既に上告受理申立てがされている(上告受理申立事件番号: 令04行ノ10011)。
上告受理申立てが認められるかは不明だが、仮に受理されれば事件の決着はまだまだ先になりそうである。しかし、不受理となり本判決が確定すれば、本件判決による請求項1、4及び5の無効審決の取り消しに係る部分(第1事件関係)については審判が再審理となる。
審判事件が再審理となり、現在の請求項のまま本件特許の無効審判事件(第1事件関係)が請求不成立審決との結論に至れば、「双極性障害における躁症状」の効能・効果を追加してエビリファイ®のジェネリックを販売しているMeiji Seikaファルマその他ジェネリックメーカーの行為は本件特許に係る特許権の侵害に該当する可能性が出てくる。
そのような結果となれば、ジェネリックの効能効果削除、そして先発品との効能・効果不一致がさらに顕著となり、医療現場での混乱が生じる可能性、別の見方で言えば、「先発医薬品の特許が存在する効能・効果については承認しない」との方針に事後的に反することとなる当該効能追加を承認した厚生労働省のパテントリンケージの運用が抱える問題によって医療現場に混乱を招くおそれ・・・がまさに顕在化する可能性も出てきた。
ジェネリック承認時に先発医薬品の有効特許を考慮する仕組みであるパテントリンケージを規定する医療用後発医薬品の薬事法上の承認審査及び薬価収載に係る医薬品特許の取扱いについて(平成21年6月5日付医政経発第0605001号/薬食審査発第0605014号)」及び「承認審査に係る医薬品特許情報の取扱いについて(平成6年10月4日付け薬審第762号)において、ジェネリックの承認審査にあたっては、以下の点を定めている。
- 先発医薬品の有効成分に特許が存在する場合には後発医薬品を承認しないこと
- 先発医薬品の特許が存在する効能・効果、用法・用量(効能・効果等)については承認しない方針であること
- 特許の存否は承認予定日で判断するものであること
パテントリンケージとは何かについては以下の記事参照:

知財高裁は、本件審決においては、双極性障害の「うつ病エピソード」に対する治療について判断されたものであるが、双極性障害の「躁病エピソード」に対する治療については実質的な判断が示されたものとはいえないとしている。
従って、特許庁での再審理となれば、「躁病エピソード」に対する治療についての出願当時の技術常識や実施可能要件・サポート要件の適否、すなわち効能・効果「双極性障害における躁症状」に関わる事件の核心、が争われると思われる。
その判断の帰趨は、無効審決を受けてエビリファイ®ジェネリックに「双極性障害における躁症状」の効能追加承認を与えた厚生労働省の判断と、効能追加販売に踏み切った各ジェネリックメーカーの決断が、それぞれ正しいものだったのかという問いに答えを与えることになるだろう。
今後の審理の進展に注目したい。
>関連判決②へ


コメント