・・・特許6150846(「増悪椎体骨折抑制のための」を発明特定事項とする医薬用途発明)の進歩性を認めた審決を取り消す。
前回記事: 2021.12.09 「沢井製薬 v. 旭化成ファーマ」 知財高裁令和2年(行ケ)10069 骨粗鬆症治療剤テリボン®(テリパラチド酢酸塩)の週1回投与特許を巡る裁判⑤

1.はじめに
旭化成ファーマが製造販売する週1回皮下投与の骨粗鬆症治療剤「テリボン®皮下注用56.5μg」(以下、「テリボン®」と略す。)のジェネリック参入障壁となっていると考えられるのが、テリパラチドの週1回投与を特徴とする発明に係る7つの特許(存続期間満了は2030年9月8日)である(表1)。
旭化成ファーマは、2021年6月21日付の「【謹告】テリパラチド酢酸塩に関する特許権について」(日刊薬業)において、テリボン®を製造販売しており、テリパラチド酢酸塩を有効成分とする骨粗鬆症治療剤ないし予防剤に関する特許権7件(日本特許第6522715号、同第6150846号、同第6043008号、同第6198346号、同第6275900号、同第6274634号、同第6301524号)を保有していると発信している(テリパラチド酢酸塩に関する特許権について(3))。
いずれの特許に対してもジェネリックメーカーが無効審判を請求し、それらいずれの事件も審決の取消しを求めて知財高裁での訴訟にまで発展した。昨年8月から、それら判決が次々と出てきている。
本記事では、これまでの5つの記事:
- 特許第6274634号についての記事「2021.08.31 「旭化成ファーマ v. 沢井製薬」 知財高裁令和2年(行ケ)10004 骨粗鬆症治療剤テリボン®(テリパラチド酢酸塩)の週1回投与特許を巡る裁判①」
- 特許第6043008号についての記事「2021.08.31 「沢井製薬 v. 旭化成ファーマ」 知財高裁令和2年(行ケ)10056 骨粗鬆症治療剤テリボン®(テリパラチド酢酸塩)の週1回投与特許を巡る裁判②」
- 特許第6275900号についての記事「2021.08.31 「沢井製薬 v. 旭化成ファーマ」 知財高裁令和2年(行ケ)10132 骨粗鬆症治療剤テリボン®(テリパラチド酢酸塩)の週1回投与特許を巡る裁判③」
- 特許第6301524号についての記事「2021.09.28 「沢井製薬 v. 旭化成ファーマ」 知財高裁令和2年(行ケ)10038 骨粗鬆症治療剤テリボン®(テリパラチド酢酸塩)の週1回投与特許を巡る裁判④」
- 特許第6198346号についての記事「2021.12.09 「沢井製薬 v. 旭化成ファーマ」 知財高裁令和2年(行ケ)10069 骨粗鬆症治療剤テリボン®(テリパラチド酢酸塩)の週1回投与特許を巡る裁判⑤」
に続く6回目として、特許第6150846号の無効審判請求事件を判断した知財高裁判決(知財高裁令和2年(行ケ)10071)について紹介する。
この事件は、旭化成ファーマの7つの特許の無効審判請求のうち、特許発明の進歩性を認めた審決の取消しを求めて沢井製薬が提訴したものである。
これまでの他の特許に対する知財高裁判断と同様に、進歩性を肯定した審決が取消されるという結果となった。

2.背景
本件(知財高裁令和2年(行ケ)10071)は、旭化成ファーマ(被告)が特許権の設定登録を受けた発明の名称を「1回当たり100~200単位のPTHが週1回投与されることを特徴とする,PTH含有骨粗鬆症治療/予防剤」とする特許第6150846号に対して沢井製薬(原告)がした無効審判請求(無効2018-800080号事件)を請求不成立とした審決の取消訴訟である。
本件発明1:
(1)年齢が65歳以上である
(2)既存椎体骨折がある
(3)骨密度が若年成人平均値の80%未満である,および/または,骨萎縮度が萎縮度I度以上である。
本件発明2:
(1)年齢が65歳以上である
(2)既存椎体骨折がある
(3)骨密度が若年成人平均値の80%未満である,および/または,骨萎縮度が萎縮度I度以上である。
本件審決は、①本件発明は明確性要件に違反しない、②本件発明の発明の詳細な説明の記載は実施可能要件に違反しない、③本件発明は、甲第7号証「ヒト副甲状腺ホルモン(1-34)の骨粗鬆症に対する間欠週1回投与の効果:3種類の投与量を用いた無作為化二重盲検前向き試験」(Osteoporosis International vol. 9, p296–306 (1999))(以下「甲7文献」という。)に記載された発明(以下「甲7発明」という。)及び本件発明の特許要件判断の基準日(平成22年9月8日。以下「本件基準日」という。)当時の技術常識を踏まえても当業者が容易に発明をすることができたものとはいえない旨判断した。
特に、進歩性欠如(無効理由3)の有無については、以下のとおり判断した。
ア 甲7発明の認定
ヒトPTH(1-34)酢酸塩の200単位を毎週皮下注射する,ヒトPTH(1-34)酢酸塩を有効成分として含有する骨粗鬆症治療剤であって,厚生省による委員会が提唱した診断基準で骨粗鬆症と定義された,年齢範囲が45歳から95歳の被験者のうち,複数の因子をスコア化することによって評価して骨粗鬆症を定義し,スコアの合計が4以上の場合の患者に対し,投与される,骨粗鬆症治療剤。
イ 本件発明1及び2と甲7発明との一致点
1回当たり200単位のPTH(1-34)又はその塩(酢酸塩)が週1回投与されることを特徴とする,PTH(1-34)又はその塩(酢酸塩)を有効成分として含有する,骨粗鬆症治療ないし予防剤であって,特定の骨粗鬆症患者に投与されることを特徴とする,骨粗鬆症治療剤ないし予防剤。
ウ 本件発明1及び2と甲7発明との相違点
(ア) 相違点1
特定の骨粗鬆症患者が,本件発明1及び2では
「下記(1)~(3)の全ての条件を満たす骨粗鬆症患者
(1)年齢が65歳以上である
(2)既存椎体骨折がある
(3)骨密度が若年成人平均値の80%未満である,および/または,骨萎縮度が萎縮度I度以上である」であるのに対し,
甲7発明では
「厚生省による委員会が提唱した診断基準で骨粗鬆症と定義された,年齢範囲が45歳から95歳の被験者のうち,複数の因子をスコア化することによって評価して骨粗鬆症を定義し,スコアの合計が4以上の場合の患者」
である点
(イ) 相違点2
骨粗鬆症治療剤ないし予防剤が,本件発明1では,「増悪椎体骨折抑制のための」ものであることが,本件発明2では「Grade3への増悪椎体骨折抑制」のためのものであることが特定されているのに対し,甲7発明では,そのような特定がない点
エ 相違点1及び相違点2の容易想到性
・・・いずれの引用文献にも,本件発明1及び2の「(1)年齢が65歳以上である,(2)既存椎体骨折がある,(3)骨密度が若年成人平均値の80%未満である,および/または,骨萎縮度が萎縮度I度以上である」(以下「本件3条件」といい,各条件を番号に従い「本件条件(1)」のようにいう。)を満たす骨粗鬆症患者に対して,「増悪椎体骨折抑制のため」及び「Grade3への増悪椎体骨折抑制」のために投与をすることは記載も示唆もされておらず,また,・・・本件3条件の全てを満たす患者において,優れた増悪椎体骨折抑制効果(Grade3への増悪椎体骨折抑制効果も含む。)が奏されることを当業者が予測し得たとは認められない。
よって,相違点1及び相違点2に係る,本件3条件の全てを満たす患者に増悪椎体骨折抑制のため(Grade3への増悪椎体骨折抑制のためも含む。)に甲7発明の治療剤を投与することを,本件基準日において当業者が容易に想到し得たと認めることはできないから,本件発明1及び2のいずれにも進歩性が認められる。
3.裁判所の判断
裁判所は、本件発明の進歩性に関する判断の誤りの有無について、相違点1及び2に係る本件発明1及び2の構成を想到することは容易と認められ、本件発明1及び2の効果も当業者において予測できない顕著なものとは認められないから、結局、相違点1及び2は当業者が容易に想到し得たものというべきであり、相違点1及び相違点2が容易に想到できないと認定した本件審決の判断には誤りがあると判断し、審決を取消した。
以下に、本件発明1及び2の進歩性に関する判断の誤りの有無についての裁判所の判断を紹介する。
(1)相違点1の容易想到性について
裁判所は、これまでの上記他の関連判決と同様に、甲7発明に接した当業者が、投与対象患者を本件3条件を全て満たす患者と特定することは、当業者に格別の困難を要することではない、と判断した。
(2)相違点2の容易想到性について
裁判所は、以下のとおり、当業者が相違点2に係る本件発明1及び2の構成を想到することは容易であると判断した。
「骨粗鬆症は,骨強度の低下を特徴とし,骨折の危険性が増大した骨疾患であること,骨強度は骨密度と骨質の2つの要因からなり,骨密度は骨強度のほぼ70%を説明することが,本件基準日における技術常識であったから,当業者は,骨密度の増加は,骨折の予防に寄与すると理解する。このような理解は,甲7文献の「ここに挙げた薬剤を投与することによって骨密度(BMD)が増加するため,骨折予防は飛躍的に進歩した」・・・との記載とも合致するものである。
そして,甲7文献には,甲7発明の200単位週1回投与が,48週で腰椎骨密度を8.1%増大させたことが記載されているから・・・,当業者であれば,そのような骨密度の増大は,椎体(椎体は,腰椎を含む。)の骨折予防に寄与すると理解し,骨粗鬆症の治療の目的は骨折を予防することであるとの技術常識,及び,骨粗鬆症で最も頻度の高い骨折は椎体骨折であるとの技術常識・・・を踏まえ,その用途を,椎体骨折抑制のためのものとすることは,容易に想到し得たものといえる。
そして,本件基準日において,・・・本件発明と同一のPTH製剤であり,用量用法が異なる連日投与のフォルテオは,新規椎体骨折,増悪椎体骨折,及び,新規椎体骨折及び増悪椎体骨折・・・について,プラセボ投与群に対して有意な骨折抑制効果を有することが知られていた・・・。そうであれば,甲7発明の治療剤についても,連日投与のPTH製剤と同様に,新規椎体骨折に対しても,増悪椎体骨折に対しても抑制効果を有すると予測し,これらのうちの増悪椎体骨折を抑制するためのものとしたことは,当業者が容易に想到し得たものである。
・・・甲7発明の治療剤を増悪椎体骨折抑制のためのものとすることは容易に想到できるところ,増悪椎体骨折はGrade3への増悪椎体骨折を含み,そして,連日投与のフォルテオについて,新規椎体骨折及びGrade3への増悪椎体骨折(SQ3)について,プラセボ投与群に対して有意な骨折抑制効果を有することが知られていたから・・・,甲7発明の骨粗鬆症治療剤についても,連日投与のPTH製剤と同様に,Grade3への増悪椎体骨折に対しても抑制効果を有すると予測し,これに限定したものとすることは,当業者が容易に想到し得たものといえる。」
(3)発明の効果について
裁判所は、最高裁判決を引用して、予測できない顕著な効果について検討する観点を判示した。
「発明の効果が予測できない顕著なものであるかについては,当該発明の特許要件判断の基準日当時,当該発明の構成が奏するものとして当業者が予測することのできなかったものか否か,当該構成から当業者が予測することのできた範囲の効果を超える顕著なものであるか否かという観点から検討する必要がある(最高裁判所平成30年(行ヒ)第69号令和元年8月27日第三小法廷判決・集民262号51頁参照)。
もっとも,当該発明の構成のみから,予測できない顕著な効果が認められるか否かを判断することは困難であるから,当該発明の構成に近い構成を有するものとして選択された引用発明の奏する効果や技術水準において達成されていた同種の効果を参酌することは許されると解される。
なお,予測できない顕著な効果の立証責任は特許権者にあるから,当該発明の構成から奏する効果が不明であるからといって,直ちに予測できない顕著な効果があるとすることはできない。」
前示のとおり、相違点1及び2の構成は容易想到であるが、これに対し、被告は、以下の3点について当業者が予測をすることができなかった顕著な効果がある旨主張した。
- ①増悪椎体骨折抑制効果は新規椎体骨折抑制効果よりも低いと予測されるところ,本件発明の構成では新規椎体骨折抑制効果と同等以上に増悪椎体骨折抑制効果が高いこと(効果①)
- ②本件発明の構成による増悪椎体骨折の相対リスク減少率(RRR)が連日投与のフォルテオの同RRRと比較して予想外に高いこと(効果②)
- ③増悪椎体骨折抑制効果がPTH連日投与から想定されるBMD増加率から予測できないか,又は本件発明の構成から想定されるBMD増加率から予測されるものよりも高いこと(効果③)
しかし、裁判所は、以下のとおり、被告が主張する各効果は認められないと判断した。
ア 効果①について
「本件明細書の記載からでは,本件3条件の全てを満たす患者と定義付けられる高リスク患者に対する新規椎体骨折抑制効果が,本件3条件の全部又は一部を欠く者と定義付けられる低リスク患者に対する新規椎体骨折抑制効果よりも高いということを理解することはできない。
すなわち,・・・低リスク患者において,100単位週1回投与群の新規椎体骨折の発生率が5単位週1回投与群のそれらの発生率に対して有意差がなかったとの結論が,上記のような少ない症例数を基に導かれている以上,高リスク患者における新規椎体骨折発生の抑制の程度を低リスク患者における新規椎体骨折発生の抑制の程度と比較して,前者が後者よりも優れていると結論付けることはできない。
・・・PTH200単位週1回投与群のプラセボ投与群に対する新規椎体骨折の相対リスク減少率が79%と,同増悪椎体骨折の相対リスク減少率が83%と算定されるからといって,単純に,本件発明における増悪椎体骨折抑制効果が新規椎体骨折抑制効果と同等又はそれ以上であるとは即断できるものではなく,さらに,本件明細書全体をみても,本件発明における増悪椎体骨折抑制効果が新規椎体骨折抑制効果と同等又はそれ以上であるとする記載はなく,それを説明する作用機序についての技術的説明等もない。そうすると,増悪椎体骨折について,予測できない顕著な効果として効果①を認めることはできない。」
イ 効果②について
「前記・・・のとおり,・・・文献に記載されたPTH連日投与のフォルテオ(テリパラチド)の相対リスク減少率との対比により本件発明の予想外の顕著な効果を裏付けることはできない。
・・・本件明細書には本件発明の骨粗鬆症治療剤がGrade3への増悪椎体骨折抑制に特に優れた効果を奏する旨の記載は無いから,甲99証明書は明細書に記載のない効果を明らかにしようとするものであって,これを参酌することはできない。そして,甲99証明書を除くと,本件発明の治療剤とGrade3への増悪椎体骨折抑制効果との関係について摘示する証拠はない。
したがって,Grade3への増悪椎体骨折について,予測できない顕著な効果として効果②を認めることはできない。」
ウ 効果③について
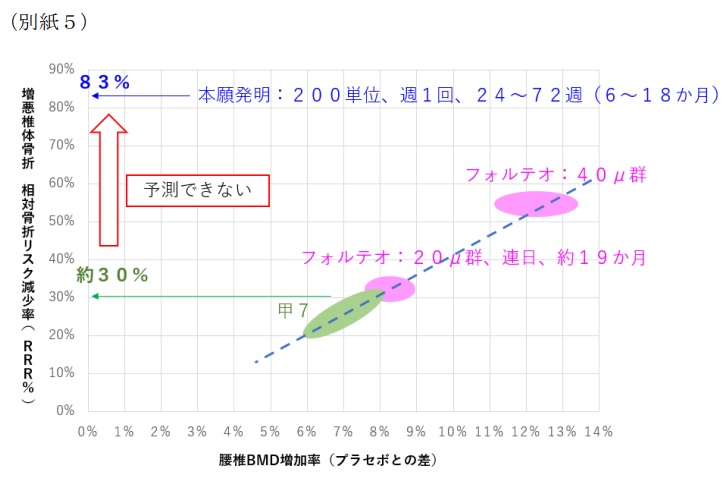
「被告は,・・・PTHの連日投与から想定されるBMD増加率に対する骨折相対リスクと対比して,BMD増加率が低くてもより低い骨折相対リスクが得られるとの効果が生ずるとして,これを本件発明の予測できない顕著な効果とする。
しかしながら,被告の上記主張は,本件訴訟における原告の主張に対抗して,本件明細書とは異なる文献に記載された試験の結果と本件明細書の記載を被告が独自に組み合わせて予測したものであり,当然ながら,本件明細書には,PTHの連日投与から想定されるBMD増加率と骨折相対リスクとの関係を記載した部分は見当たらず,上記主張は,明細書に記載されていない効果を主張するものであって失当というほかない。」
4.コメント
(1)7つの特許、旭化成ファーマの0勝6敗(残るは1特許)
本事件で争われた特許第6150846号は元をたどると特願2011-530844(出願日2010年9月8日; 再表2011/030774; WO2011/030774)を原出願とするものであり、テリパラチドの週1回投与を特徴とする発明に係る7つの特許により構成される特許ファミリーのうちのひとつである。
既に以下のファミリー特許についての判決も出されており、進歩性を否定し、いずれも旭化成ファーマの敗訴という点で共通する。いずれの事件も現在最高裁に上告受理申立がされている。
- 2021.08.31 「旭化成ファーマ v. 沢井製薬」 知財高裁令和2年(行ケ)10004・・・特許第6274634号(参照:2021.08.31 「旭化成ファーマ v. 沢井製薬」 知財高裁令和2年(行ケ)10004 骨粗鬆症治療剤テリボン®(テリパラチド酢酸塩)の週1回投与特許を巡る裁判①)
- 2021.08.31 「沢井製薬 v. 旭化成ファーマ」 知財高裁令和2年(行ケ)10056・・・特許第6043008号(参照:2021.08.31 「沢井製薬 v. 旭化成ファーマ」 知財高裁令和2年(行ケ)10056 骨粗鬆症治療剤テリボン®(テリパラチド酢酸塩)の週1回投与特許を巡る裁判②)
- 2021.08.31 「沢井製薬 v. 旭化成ファーマ」 知財高裁令和2年(行ケ)10132・・・特許第6275900号(参照:2021.08.31 「沢井製薬 v. 旭化成ファーマ」 知財高裁令和2年(行ケ)10132 骨粗鬆症治療剤テリボン®(テリパラチド酢酸塩)の週1回投与特許を巡る裁判③)
- 2021.09.28 「沢井製薬 v. 旭化成ファーマ」 知財高裁令和2年(行ケ)10038・・・特許第6301524号(参照:2021.09.28 「沢井製薬 v. 旭化成ファーマ」 知財高裁令和2年(行ケ)10038 骨粗鬆症治療剤テリボン®(テリパラチド酢酸塩)の週1回投与特許を巡る裁判④)
- 2021.12.09 「沢井製薬 v. 旭化成ファーマ」 知財高裁令和2年(行ケ)10069・・・特許第6198346号(参照:2021.12.09 「沢井製薬 v. 旭化成ファーマ」 知財高裁令和2年(行ケ)10069 骨粗鬆症治療剤テリボン®(テリパラチド酢酸塩)の週1回投与特許を巡る裁判⑤)
残る最後の特許第6522715号に係る令和3年(行ケ)第10069号審決取消請求事件の知財高裁判決言渡期日は現時点で未定である。
(2)沢井製薬がジェネリックの承認を取得。パテントリンケージは?
2022年2月15日、沢井製薬が「テリボン®皮下注用56.5μg」のジェネリックとなる「テリパラチド皮下注用56.5μg「サワイ」」の製造販売承認を取得したと発表した。
- 2022.02.15 沢井製薬 press release: ジェネリック医薬品7成分14品目の製造販売承認を取得
2019年2月に、子会社の旭化成シンメッドが、「テリボン®皮下注用56.5μg」のオーソライズド・ジェネリック(AG)の承認を得ているが(薬価未収載)、他のジェネリックメーカーからのジェネリックは未だ承認されていなかった。AG以外でのテリボン®ジェネリックの承認は、沢井製薬が単独一番手となった。
しかし、前述のテリボン®に関する7つの特許のうち残る特許第6522715号に係る審決取消請求事件はまだ判決が出ていない(特許維持審決に対して日医工が提訴)。
当該特許に係る発明も効能・効果又は用法・用量に関するものであるから(表1)、パテントリンケージの対象となり得る特許である。
そして、当該特許が無効審決となっていたわけではない(むしろ特許維持の審決)。
にもかかわらず、厚労省は沢井製薬のジェネリックに承認を与えたことになる。
ジェネリック承認時に先発医薬品の有効特許を考慮する仕組みであるパテントリンケージを規定する医療用後発医薬品の薬事法上の承認審査及び薬価収載に係る医薬品特許の取扱いについて(平成21年6月5日付医政経発第0605001号/薬食審査発第0605014号)」及び「承認審査に係る医薬品特許情報の取扱いについて(平成6年10月4日付け薬審第762号)において、ジェネリックの承認審査にあたっては、以下の点を定めている(パテントリンケージについては記事「日本のパテントリンケージの現状の課題とその解決に向けた提案」参照)。
- 先発医薬品の有効成分に特許が存在する場合には後発医薬品を承認しないこと
- 先発医薬品の特許が存在する効能・効果、用法・用量(効能・効果等)については承認しない方針であること
- 特許の存否は承認予定日で判断するものであること
したがって、なぜ、先発医薬品「テリボン®皮下注用56.5μg」の特許第6522715号がまだ存在する(無効判断もされていない)にもかかわらず、沢井製薬のジェネリックが承認されたのか・・・例えば、旭化成ファーマがパテントリンケージの対象特許として裁判所の判断が待たれる特許第6522715号を特許情報報告票に記載していなかったのか(想定しにくい)、厚労省が当該特許は「テリボン®皮下注用56.5μg」の効能・効果等についての特許ではないと判断したのか(想定しにくい)、厚労省がパテントリンケージの定められた運用を無視して承認を与えたのか(こちらも想定しにくい)、旭化成が沢井製薬だけに実施許諾したのか(あり得ない)・・・そのメカニズムには疑問がある。
もし、パテントリンケージが定められたとおりに運用されていなかったのであれば、旭化成ファーマはもちろん、出し抜かれた他のジェネリックメーカーにとっても不利益を被ることになる。
厚労省のパテントリンケージの取扱いに過誤があったのであれば、旭化成ファーマは、沢井製薬のジェネリックに製造販売承認を与えた厚労省を相手に、その行政処分を差し止める訴訟を提起すること等も、本気で考えていいのかもしれない。
これまでの記事での主なコメント:
- 旭化成ファーマの敗因
- 効果の程度についての判断に参酌できる観点
- 進歩性のための明細書記載要件
- 特許庁は進歩性を認めていた
- 主張立証責任を負う出願人は比較試験の妥当性を慎重に検討すべき
- 欧州特許庁での審査
- 被告製品(対象患者)の一部が発明の技術的範囲に属する場合の問題点
5.おわりに
骨粗鬆症治療剤テリボン®は旭化成ファーマの主力品である。
ジェネリックの市場参入を許せば、テリボン®の売上に極めて大きなインパクトを与えることになる。
沢井製薬と旭化成ファーマとの攻防の動向、そして残り1つの特許に関する裁判の行く末も目が離せない。

コメント
いつも興味深く拝見して勉強させて頂いております一弁理士です。
特許第6522715号があるにも関わらず後発品が承認されている点について、いくつかの可能性をご説明頂いており、いずれも考えにくいとのこと。おっしゃるとおりと思いますが、一つだけ気になりましたのは、先発品企業は特許情報報告票を通常いつ頃提出するものであるのか、という点です。後発品対策で必要になるのでしょうから、先発品の再審査期間が終わる頃であるのだとすると、本件の場合、特許第6522715号はまだ出願さえされていない時期になると思うのですが、このような場合には新たに特許が登録された時点で特許情報報告票を追加提出するということになるものなのでしょうか?
また、2019年2月にAGの承認がされているということですが、やはりこの時期にはまだ特許第6522715号は登録に至っておりませんので、もし厚労省(PMDA)の有している特許の情報がこの時点のままでストップしているとなると、特許第6522715号の存在がスルーされてしまうという可能性もあったのではないかと思った次第です。企業の経験はないので憶測でしかありませんが、可能性としてはいかがなものでしょうか。
コメントありがとうございました。
特許情報報告票は提出すればPMDA/厚労省が受け付けてくださると理解しています。アップデートが有りましたら必要に応じて先発メーカーから積極的に都度連絡・提出・説明するというのが実務かと思います(平成6年10月4日付け薬審第762号審査課長通知「承認審査に係る医薬品特許情報の取扱いについて」(全般的留意事項(2)「報告票提出後、特許出願の審査の進行等により報告内容を変更する必要が生じた場合には、速やかに変更後の内容を記入した報告票を提出すること。」))。ただし、受け付けいただいてもPMDA/厚労省内部でどのように考慮・検討して下さるのかどうかはブラックボックスですが。先発メーカーが何もしなければ情報は古いままでPMDA/厚労省は判断するのかもしれません。
御教授頂きありがとうございます。アップデートあれば先発メーカーから積極的に都度連絡・提出・説明するという実務とのことで、審決取消の6件の方も上告受理申立中ということも含め、本件はどういった事情で後発品の承認がされたのか魔訶不思議ですね。日本のこのような運用における恐さというか危うさがよくわかりました。
興味深い事案を極めてタイムリーにご解説頂き、感謝申し上げます。
【その後の差戻審決情報】
無効2018-800080
審決日:2024年3月25日
「特許第6150846号「1回当たり100~200単位のPTHが週1回投与されることを特徴とする、PTH含有骨粗鬆症治療/予防剤」の特許無効審判事件についてされた令和2年4月30日付審決に対し、知的財産高等裁判所において、審決を取り消す判決(令和2年(行ケ)第10071号、令和4年22月2日判決言渡)があり、当該判決はその後確定したので、更に審理のうえ、次のとおり審決する。
結 論
特許第6150846号の特許請求の範囲を、訂正請求書に添付された特許請求の範囲のとおり、訂正後の請求項〔1、2〕について訂正することを認める。
特許第6150846号の請求項1及び2に係る発明についての特許を無効とする。
審判費用は被請求人の負担とする。」