・・・特許6198346(投与期間を発明特定事項とする医薬用途発明)の進歩性を認めた審決を取り消す。
前回記事: 2021.09.28 「沢井製薬 v. 旭化成ファーマ」 知財高裁令和2年(行ケ)10038 骨粗鬆症治療剤テリボン®(テリパラチド酢酸塩)の週1回投与特許を巡る裁判④

1.はじめに
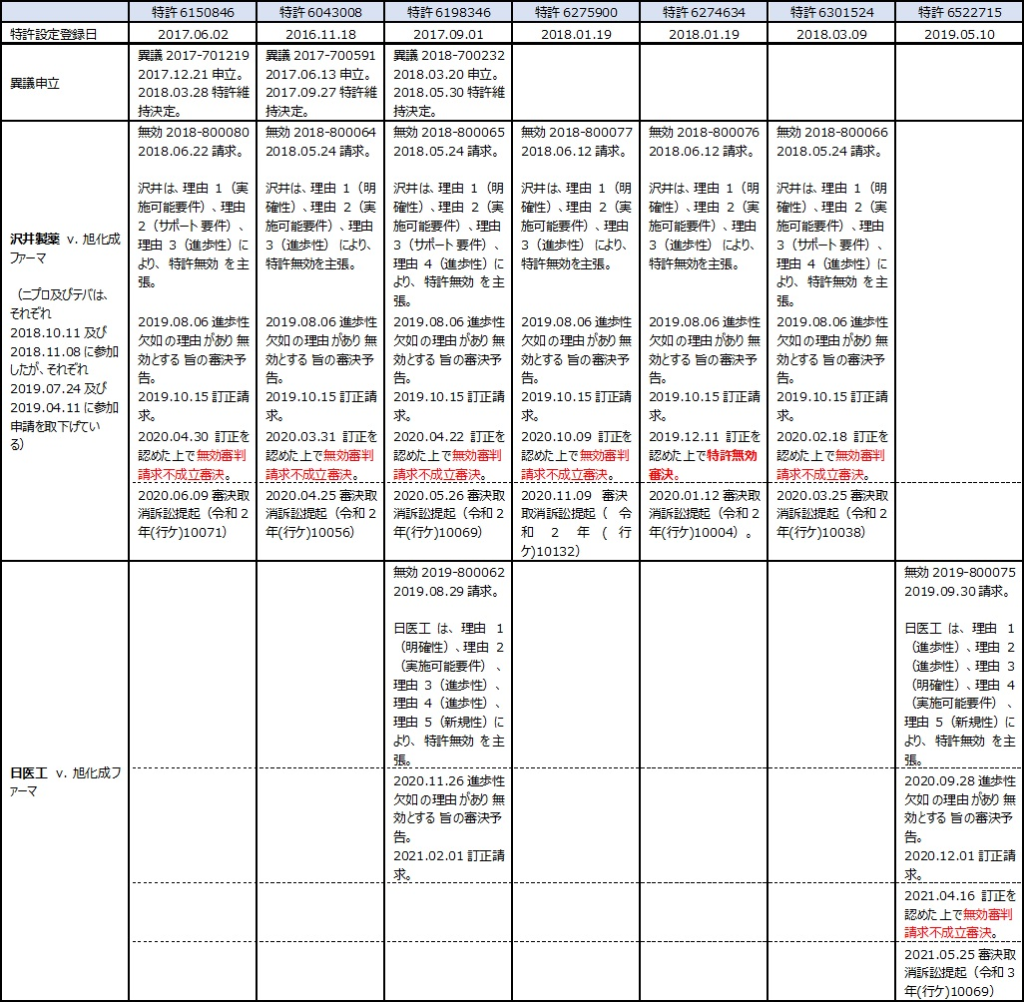
旭化成ファーマが製造販売する週1回皮下投与の骨粗鬆症治療剤「テリボン®皮下注用56.5μg」(以下、「テリボン®」と略す。)のジェネリック参入障壁となっていると考えられるのが、テリパラチドの週1回投与を特徴とする発明に係る7つの特許(存続期間満了は2030年9月8日)である(表1)。
旭化成ファーマは、2021年6月21日付の「【謹告】テリパラチド酢酸塩に関する特許権について」(日刊薬業)において、テリボン®を製造販売しており、テリパラチド酢酸塩を有効成分とする骨粗鬆症治療剤ないし予防剤に関する特許権7件(日本特許第6522715号、同第6150846号、同第6043008号、同第6198346号、同第6275900号、同第6274634号、同第6301524号)を保有していると発信している(テリパラチド酢酸塩に関する特許権について(3))。
いずれの特許に対してもジェネリックメーカーが無効審判を請求し、それらいずれの事件も審決の取消しを求めて知財高裁での訴訟にまで発展した(表2)。最近になり、それら判決が次々と出てきている。
本記事では、これまでの4つの記事:
- 特許第6274634号についての記事「2021.08.31 「旭化成ファーマ v. 沢井製薬」 知財高裁令和2年(行ケ)10004 骨粗鬆症治療剤テリボン®(テリパラチド酢酸塩)の週1回投与特許を巡る裁判①」
- 特許第6043008号についての記事「2021.08.31 「沢井製薬 v. 旭化成ファーマ」 知財高裁令和2年(行ケ)10056 骨粗鬆症治療剤テリボン®(テリパラチド酢酸塩)の週1回投与特許を巡る裁判②」
- 特許第6275900号についての記事「2021.08.31 「沢井製薬 v. 旭化成ファーマ」 知財高裁令和2年(行ケ)10132 骨粗鬆症治療剤テリボン®(テリパラチド酢酸塩)の週1回投与特許を巡る裁判③」
- 特許第6301524号についての記事「2021.09.28 「沢井製薬 v. 旭化成ファーマ」 知財高裁令和2年(行ケ)10038 骨粗鬆症治療剤テリボン®(テリパラチド酢酸塩)の週1回投与特許を巡る裁判④」
に続く5回目として、特許第6198346号の無効審判請求事件を判断した知財高裁判決(知財高裁令和2年(行ケ)10069)について紹介する。この事件は、旭化成ファーマの7つの特許の無効審判請求のうち、特許発明の進歩性を認めた審決の取消しを求めて沢井製薬が提訴したものである。
これまでの他の特許に対する知財高裁判断と同様に、進歩性を肯定した審決が取消されるという結果となった。

2.背景
本件(知財高裁令和2年(行ケ)10069)は、旭化成ファーマ(被告)が特許権の設定登録を受けた発明の名称を「1回当たり100~200単位のPTHが週1回投与されることを特徴とする、PTH含有骨粗鬆症治療/予防剤」とする特許第6198346号に対して沢井製薬(原告)がした無効審判請求(無効2018-800065号事件)を請求不成立とした審決の取消訴訟である。
本件発明1:
(1)年齢が65歳以上である
(2)既存の骨折がある
(3)骨密度が若年成人平均値の80%未満である,および/または,骨萎縮度が萎縮度I度以上である。
本件発明2:
(1)年齢が65歳以上である
(2)既存の骨折がある
(3)骨密度が若年成人平均値の80%未満である,および/または,骨萎縮度が萎縮度I度以上である。
本件審決は、①本件発明は明確性要件に違反しない、②本件発明の発明の詳細な説明の記載は実施可能要件に違反しない、③サポート要件に違反しない、④本件発明は、甲第7号証「ヒト副甲状腺ホルモン(1-34)の骨粗鬆症に対する間欠週1回投与の効果:3種類の投与量を用いた無作為化二重盲検前向き試験」(Osteoporosis International vol. 9, p296–306 (1999))(以下「甲7文献」という。)に記載された発明(以下「甲7発明」という。)及び本件発明の特許要件判断の基準日(平成22年9月8日。以下「本件基準日」という。)当時の技術常識を踏まえても当業者が容易に発明をすることができたものとはいえない旨判断した。
特に、進歩性欠如(無効理由4)の有無については、以下のとおり判断した。
ア 甲7発明の認定
ヒトPTH(1-34)酢酸塩の200単位を毎週皮下注射する,ヒトPTH(1-34)酢酸塩を有効成分として含有する骨粗鬆症治療剤であって,厚生省による委員会が提唱した診断基準で骨粗鬆症と定義された,年齢範囲が45歳から95歳の被験者のうち,複数の因子をスコア化することによって評価して骨粗鬆症を定義し,スコアの合計が4以上の場合の患者に対し,48週にわたり投与される,骨粗鬆症治療剤。
イ 本件発明1と甲7発明との一致点
1回当たり200単位のPTH(1-34)又はその塩が週1回投与されることを特徴とする,PTH(1-34)又はその塩を有効成分として含有する,骨粗鬆症治療ないし予防剤であって,特定の骨粗鬆症患者に投与されることを特徴とする,骨粗鬆症治療剤ないし予防剤。
ウ 本件発明1と甲7発明との相違点
(ア) 相違点1
特定の骨粗鬆症患者が,
本件発明1では
「下記(1)~(3)の全ての条件を満たす骨粗鬆症患者
(1)年齢が65歳以上である
(2)既存の骨折がある
(3)骨密度が若年成人平均値の80%未満である,および/または,骨萎縮度が萎縮度I度以上である」であるのに対し,甲7発明では,
「厚生省による委員会が提唱した診断基準で骨粗鬆症と定義された,年齢範囲が45歳から95歳の被験者のうち,複数の因子をスコア化することによって評価して骨粗鬆症を定義し,スコアの合計が4以上の場合の患者」である点(イ) 相違点2
骨粗鬆症治療剤ないし予防剤が,本件発明1では,「骨折抑制のための」ものであることが特定されているのに対し,甲7発明では,そのような特定がない点
(ウ) 相違点3
骨粗鬆症治療剤ないし予防剤が,本件発明1では,「48週を超過して72週以上までの間」投与されるものであるのに対し,甲7発明では,「48週にわたり」投与されるものである点。
エ 相違点1及び相違点3の容易想到性
・・・いずれの文献にも,本件発明1の「(1)年齢が65歳以上である」,「(2)既存の骨折がある」,「(3)骨密度が若年成人平均値の80%未満である,および/または,骨萎縮度が萎縮度I度以上である」との全ての条件(以下「本件3条件」といい,各条件を番号に従い「本件条件(1)」のようにいう。)を満たす骨粗鬆症患者に対し,48週を超過して72週以上までの間投与をすること(以下,この期間の投与を「本件条件(4)」ということがある。)は記載も示唆もされておらず,また,本件3条件の全てを満たす患者に対して本件条件(4)の用法に特定することにより,・・・顕著な骨折抑制効果が奏されることを当業者が予測し得たとは認められない。
よって,相違点1及び相違点3に係る,本件3条件を満たす患者に本件条件(4)の用法で甲7発明の骨粗鬆症治療剤を投与することは,本件基準日において,当業者が容易に想到し得たとは認めることはできないから,相違点2の容易想到性について検討するまでもなく,本件発明1に進歩性が認められる。
3.裁判所の判断
裁判所は、本件発明の進歩性に関する判断の誤りの有無について、相違点1及び3に係る本件発明の構成を想到することは容易と認められ、本件発明の効果も当業者において予測できない顕著なものとは認められないから、結局、相違点1及び3は当業者が容易に想到し得たものというべきであり、相違点1及び相違点3が容易に想到できないと認定した本件審決の判断には誤りがあると判断し、審決を取消した。
以下に、本件発明1の進歩性に関する判断の誤り(取消事由4-1)の有無についての裁判所の判断を抜粋する。
(1)相違点1の容易想到性について
・・・骨粗鬆症による骨折の複数の危険因子として,低骨密度及び既存骨折に並んで年齢が掲げられていることに着目して投与する骨粗鬆症患者を65歳以上として,本件条件(2)及び本件条件(3)に加えて本件条件(1)のように設定することはごく自然な選択であって,何ら困難を要しない。
そうすると,甲7発明に接した当業者が,投与対象患者を本件3条件を全て満たす患者と特定することは,当業者に格別の困難を要することではない。
(2)相違点3の容易想到性について
・・・「48週」及び「72週以上」に臨界的意義を認めることは困難であり,本件発明の「48週を超過して72週以上までの間」との特定の時期をもって始期及び終期とする限定には格別の技術的意義を見いだすことができず,単に,適宜の区間についてPTHの投与継続につれて骨折発生率が低下していることを示すためだけのものにすぎないというのが相当である。
・・・連日投与のPTHに関して48週を超えての投与がされ,それによる骨密度の上昇及び骨折発生の減少が報告されていたことを踏まえ,甲7発明の骨粗鬆症治療剤においても,骨密度の上昇と骨折の予防のために48週を超えて投与するようにすることは,当業者として容易に想到することといえ,これにより本件発明1に至るものというべきである。
・・・前示のとおり,本件発明1の構成は容易想到であるが,これに対し,被告は,・・・本件発明1は,本件3条件の全てを満たす患者に対する顕著な骨折抑制効果(効果①),本件条件(4)を充足することにより,骨折発生率を0%まで低減させる骨折抑制効果(効果②),PTHの連日投与から想定されるBMD増加率に対する骨折相対リスクと対比して,BMD増加率が低くても,より低い骨折相対リスクが得られる効果(効果③)という,当業者が予測をすることができなかった顕著な効果を奏するものである旨主張する。
ア 効果①について
効果①を確認するためには,高リスク患者に対する骨折抑制効果と低リスク患者に対する骨折抑制効果とを対比する必要があり,単に高リスク患者とプラセボを対比して高リスク患者に対する骨折抑制効果を示しただけでは,高リスク患者がPTH投与群の中で特に効果を奏する患者群であることを明らかにしたことにはならないところ,・・・本件明細書には,実施例1において,高リスク患者では,100単位週1回投与群における新規椎体骨折及び椎体以外の部位の骨折発生率は,いずれも実質的なプラセボである5単位週1回投与群における発生率に対して有意差が認められるが,低リスク患者では,100単位週1回投与群における新規椎体骨折及び椎体以外の部位の骨折の発生率は,いずれも,5単位週1回投与群における発生率に対して有意差が認められなかったと記載されているのにとどまる・・・。そして,・・・有意差がなかったとの結論が,上記のような少ない症例数を基に導かれたことからすると,高リスク患者における骨折発生の抑制の程度を低リスク患者における骨折発生の抑制の程度と比較して,前者が後者よりも優れていると結論付けることはできない。
したがって,実施例1をみても,高リスク患者に対するPTHの骨折抑制効果が,低リスク患者に対するPTHの骨折抑制効果よりも高いということを理解することはできず,さらに,本件明細書のその他の部分をみても,高リスク患者に対するPTHの骨折抑制効果が,低リスク患者に対するPTHの骨折抑制効果よりも高いということを理解することはできない。
以上によれば,効果①は,本件明細書の記載に基づかないものというべきである。
・・・被告は,効果①を明らかにするものとして,甲88証明書及び甲95証明書を提出する。しかしながら,本件明細書の記載から,高リスク患者に対するPTHの骨折抑制効果が,低リスク患者に対するPTHの骨折抑制効果よりも高いということを理解することができず,また,これを推認することもできない以上,効果①は対外的に開示されていないものであるから,上記各実験成績証明書を採用して,効果①を認めることは相当でない。
仮に,上記各実験成績証明書を参酌するにしても,・・・本件3条件を全て満たす患者に対するPTHの骨折抑制効果が,本件3条件を満たさない患者に対するPTHの骨折抑制効果よりも高いということを理解することはできない。
以上によれば,いずれにしても効果①を認めることはできないから,その他の点について判断するまでもなく,効果①を予測することのできない顕著な効果という余地はない。
イ 効果②について
効果②の骨折抑制効果とは,本件3条件の全てを満たす患者に本件発明1に係るPTH200単位週1回投与を48週を超えて少なくとも72週まで投与した場合に骨折発生率を0%に低減するというものであるが,前記・・・のとおり,「48週」及び「72週」という数値それ自体には格別の技術的意義を見いだすことはできない。
この点をさておいても,・・・甲7発明において,同等の骨折抑制の効果が48週を超過してもある程度継続すると考えるのが自然であるところ,試験の結果を示す事実にすぎないとはいえ,甲7発明でも,48週間の投与において椎体骨折が発生していなかったことに鑑みると,本件発明1において,48週を超えて72週までの区間での骨折発生数は0件であり,骨折発生率が0%であったとしても,その骨折抑制効果が当業者にとって意外なものとまではいえず,予測し得る範囲内のものであるといえる。
・・・被告は,効果②を明らかにするものとして,甲95証明書を提出する。しかしながら,・・・効果②を明らかにするものとはいえはない。
ウ 効果③について
被告は,PTHの連日投与から想定されるBMD増加率に対する骨折相対リスクと対比して,BMD増加率が低くてもより低い骨折相対リスクが得られるとの効果が生ずるとして,これを本件発明の予測できない顕著な効果とするが,本件明細書には,PTHの連日投与から想定されるBMD増加率と骨折相対リスクとの関係を記載した部分は見当たらず,上記主張は,明細書に記載されていない効果を主張するものであって失当というほかない。
エ まとめ
そのほか被告がるる主張するところも,前記アないしウの判断を左右するものではなく,効果の程度等につき更に検討を加えるまでもなく,本件発明1が,当業者が予測をすることができなかった顕著な効果を奏するものであると認めることはできない。
4.コメント
7つの特許、旭化成ファーマの0勝5敗(残るは2特許)
本事件で争われた特許第6198346号は元をたどると特願2011-530844(出願日2010年9月8日; 再表2011/030774; WO2011/030774)を原出願とするものであり、テリパラチドの週1回投与を特徴とする発明に係る7つの特許により構成される特許ファミリーのうちのひとつである。
既に以下のファミリー特許についての判決も出されており、進歩性を否定し、いずれも旭化成ファーマの敗訴という点で共通する。
- 2021.08.31 「旭化成ファーマ v. 沢井製薬」 知財高裁令和2年(行ケ)10004・・・特許第6274634号(参照:2021.08.31 「旭化成ファーマ v. 沢井製薬」 知財高裁令和2年(行ケ)10004 骨粗鬆症治療剤テリボン®(テリパラチド酢酸塩)の週1回投与特許を巡る裁判①)
- 2021.08.31 「沢井製薬 v. 旭化成ファーマ」 知財高裁令和2年(行ケ)10056・・・特許第6043008号(参照:2021.08.31 「沢井製薬 v. 旭化成ファーマ」 知財高裁令和2年(行ケ)10056 骨粗鬆症治療剤テリボン®(テリパラチド酢酸塩)の週1回投与特許を巡る裁判②)
- 2021.08.31 「沢井製薬 v. 旭化成ファーマ」 知財高裁令和2年(行ケ)10132・・・特許第6275900号(参照:2021.08.31 「沢井製薬 v. 旭化成ファーマ」 知財高裁令和2年(行ケ)10132 骨粗鬆症治療剤テリボン®(テリパラチド酢酸塩)の週1回投与特許を巡る裁判③)
- 2021.09.28 「沢井製薬 v. 旭化成ファーマ」 知財高裁令和2年(行ケ)10038・・・特許第6301524号(参照:2021.09.28 「沢井製薬 v. 旭化成ファーマ」 知財高裁令和2年(行ケ)10038 骨粗鬆症治療剤テリボン®(テリパラチド酢酸塩)の週1回投与特許を巡る裁判④)
コメントについては上記記事を参照してほしい。コメントの主な点は以下のとおり。
- 旭化成ファーマの敗因
- 効果の程度についての判断に参酌できる観点
- 進歩性のための明細書記載要件
- 特許庁は進歩性を認めていた
- 主張立証責任を負う出願人は比較試験の妥当性を慎重に検討すべき
- 欧州特許庁での審査
- 被告製品(対象患者)の一部が発明の技術的範囲に属する場合の問題点
残る特許2つのうちのひとつ特許6150846号に係る令和2年(行ケ)第10071号審決取消請求事件の知財高裁判決言渡期日は2022年2月2日に設定されている。もうひとつの特許6522715号に係る令和3年(行ケ)第10069号審決取消請求事件の判決言渡期日は現時点で未定である。
5.おわりに
骨粗鬆症治療剤テリボン®は旭化成ファーマの主力品である。
ジェネリック参入の障壁となっていると考えられる本件特許について発明の進歩性を認めた審決を取消した今回の知財高裁判決は、まだ判決が出されていない他の2つのファミリー特許で争われている進歩性の判断、さらにそれらの結果次第ではジェネリック参入可能性に極めて大きなインパクトを与えることになるかもしれない。
残り2つの特許に関する裁判の行く末も目が離せない。
次回記事「骨粗鬆症治療剤テリボン®(テリパラチド酢酸塩)の週1回投与特許を巡る裁判⑥」


コメント