1.はじめに
ヘルシン社のアロキシ®で訴訟と言えば、2019年初めに出された米国最高裁判決を連想する方もいるかも知れませんが、今回取り上げるのは日本の話、ヘルシン社が保有する「パロノセトロン液状医薬製剤」に関する特許5551658の無効審決取消訴訟です。被告(無効審判請求人)はニプロであり、原告である特許権者(ヘルシン社)側には実施権者である大鵬薬品が補助参加しました。
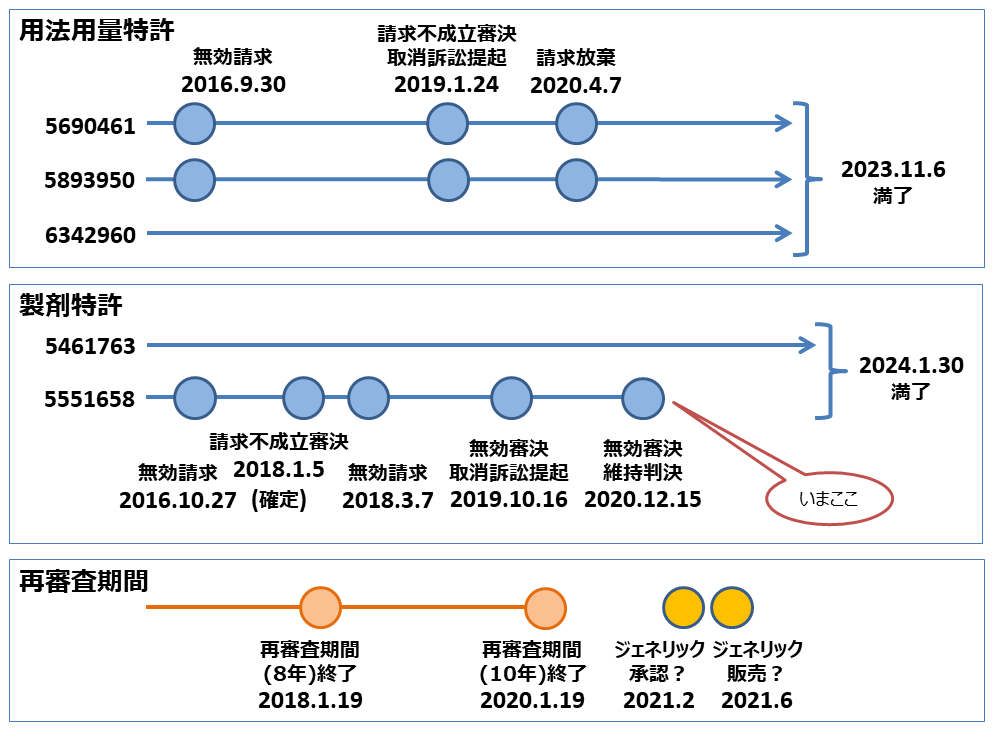
本件特許権は、ヘルシン社からライセンスを受けた大鵬薬品が国内販売している5-HT3受容体拮抗型制吐剤アロキシ®(有効成分: パロノセトロン塩酸塩)を保護すると考えられ、その存続期間満了日は2024年1月30日(延長なし)となっています。
アロキシ®の再審査期間は終了しているため、ジェネリックの承認申請は既に可能であり、早ければ2021年2月承認、同年6月販売開始となる可能性があります。本件特許の有効性についての知財高裁判決次第ではアロキシ®のジェネリック参入時期がどうなるか、また本件特許とは別にいくつかの用法用量または製剤に関する特許が存在することや、再審査期間延長による参入計画への影響等、ジェネリックメーカーの動きが気になっていました。
2.5-HT3受容体拮抗型制吐剤アロキシ®
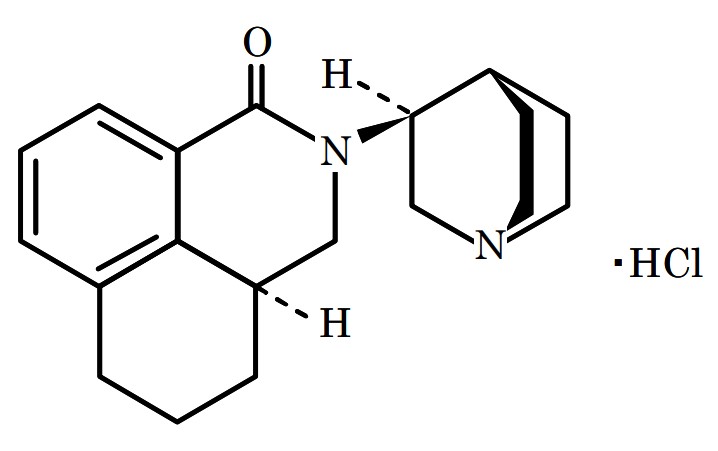 パロノセトロン塩酸塩(palonosetron Hydrochloride)は、Syntex社により創製された5-HT3受容体拮抗作用を有する化合物であり、がん化学療法剤投与後の悪心、嘔吐及び手術後の悪心、嘔吐の予防を目的に開発が進められ、1998年にSyntex社からヘルシン(Helsinn)社に開発が継承されました。
パロノセトロン塩酸塩(palonosetron Hydrochloride)は、Syntex社により創製された5-HT3受容体拮抗作用を有する化合物であり、がん化学療法剤投与後の悪心、嘔吐及び手術後の悪心、嘔吐の予防を目的に開発が進められ、1998年にSyntex社からヘルシン(Helsinn)社に開発が継承されました。
国内においては、大鵬薬品が、2004年1月に締結したヘルシン社とのライセンス契約に基づき、国内での臨床開発・販売権を取得し、抗悪性腫瘍剤(シスプラチン等)投与に伴う消化器症状(悪心、嘔吐)(遅発期を含む)を適応症として、2010年1月20日に「アロキシ®静注0.75mg」(バイアル製剤 5mL)、2012年8月16日に「アロキシ®点滴静注バッグ0.75mg」(バッグ製剤 50mL)の製造販売承認を取得、販売しています。
| アロキシ®静注0.75mg | アロキシ®点滴静注バッグ0.75mg | |
| 活性成分の含量 | 1 瓶(5mL)中にパロノセトロンとして0.75mgを含有 | 袋(50mL)中にパロノセトロンとして0.75mgを含有 |
| pH | 4.5~5.5 | 4.3~5.3 |
| 添加物 | 5mL中 D-マンニトール 207.5mg エデト酸ナトリウム水和物 2.5mg クエン酸ナトリウム水和物 18.5mg クエン酸水和物 7.8mg 水酸化ナトリウム 適量 塩酸 適量 | 50mL中 塩化ナトリウム 450.0mg エデト酸ナトリウム水和物 2.5mg クエン酸ナトリウム水和物 18.5mg クエン酸水和物 7.8mg 水酸化ナトリウム 適量 塩酸 適量 |
| 長期保存試験 | 36箇月変化なし | 36箇月変化なし |
| 効能又は効果 | 抗悪性腫瘍剤(シスプラチン等)投与に伴う消化器症状(悪心、嘔吐)(遅発期を含む) | 抗悪性腫瘍剤(シスプラチン等)投与に伴う消化器症状(悪心、嘔吐)(遅発期を含む) |
| 用法及び用量 | 通常、成人にはパロノセトロンとして0.75mgを1日1回静注又は点滴静注する。 | 通常、成人にはパロノセトロンとして0.75mgを1日1回静注又は点滴静注する。 |
2019年度の大鵬薬品によるアロキシ®国内売上収益は155億円であり、2020年度も155億円と予想されています(大塚ホールディングスFACT BOOK-2020年度3Q決算 補足資料)。
アロキシ®の再審査期間は既に終了しているため(10年: 2010年1月20日~2020年1月19日)、その後ジェネリックが承認申請され、2021年2月には承認、同年6月には販売開始となる可能性があります。
では、アロキシ®ジェネリックの参入障壁となり得る特許はどうなっているのでしょうか。
アロキシ®を保護すると思われる特許のひとつが、ヘルシン社が保有する「パロノセトロン液状医薬製剤」に関する特許5551658です。今回、その特許についての無効審決取消請求事件・ 知財高裁判決(令和元年(行ケ)10136)が2020年12月15日に言渡されましたので以下に取り上げます。
3.パロノセトロンの製剤に関する特許の無効審決取消訴訟
2020.12.15 「ヘルシン・大鵬薬品 v. ニプロ」 知財高裁令和元年(行ケ)10136
【背景】
ヘルシン社が保有する「パロノセトロン液状医薬製剤」に関する特許5551658に対してニプロがした無効審判請求について、発明特定事項である「24ケ月」要件について無効理由1(サポート要件非充足)及び3(実施可能性要件非充足)は成り立つと判断して特許を無効とした審決(無効2018-800028)の取消訴訟。原告(ヘルシン社)には実施権者である大鵬薬品が補助参加しました。
特許5551658の請求項1:
b)薬学的に許容される担体
を含む、嘔吐を抑制又は減少させるための、少なくとも24ケ月の貯蔵安定性を有する溶液であって、
当該薬学的に許容される担体はマンニトールを含む、前記溶液。
【裁判所の判断】
裁判所は、本件各発明はサポート要件を充足しない旨の本件審決の判断に誤りがないから、取消事由2(実施可能要件充足性に関する判断の誤り)について判断するまでもなく、本件各発明に関する特許を無効とした本件審決の結論に誤りはないとして、原告の請求を棄却しました。
以下、裁判所の判断からの抜粋。
「実施例4,5に代表的なの医薬製剤が示されているが,実施例4,5においては,実際に安定性試験が行われていないため,そこに記載された医薬製剤が少なくとも24ケ月の貯蔵安定性を有することが記載されているとはいえない。また,その他の箇所をみても,安定化に資する要素は挙げられてはいるものの,それらが24ケ月の貯蔵安定性を実現するものであることについての直接的な言及はないし,どのような要素があればどの程度の貯蔵安定性を実現することができるのかを推論する根拠となるような具体的な指摘もなく,結局,具体的な裏付けをもって,具体的な医薬製剤が少なくとも24ケ月の貯蔵安定性を有することが記載されているとはいえない。
なお,・・・実施例4,5の代表的な医薬製剤は処方化研究(製剤設計)に該当するといえるとしても,上記のとおり,本件明細書には,pH,賦形剤,マンニトール及びキレート剤の濃度を調整することで,安定性向上に関し,どのような作用・機序があるのか,どの程度の安定性の向上,安定性への貢献が見込めるのかが記載されていないため,実施例4,5の医薬製剤が少なくとも24ケ月の貯蔵安定性を有することが記載されているとはいえないし,その他の箇所をみても,合理的な説明をもって,具体的な医薬製剤が少なくとも24ケ月の貯蔵安定性を有することが記載されているとはいえない。
そうすると,本件明細書には,24ケ月要件を備えたパロノセトロン製剤が記載されているとはいえないし,本件出願時の技術常識に照らしても,当業者が,本件各発明につき,医薬安定性が向上し,24ケ月以上の保存を可能にするパロノセトロン製剤とその製剤を安定化する許容される濃度範囲を提供するという本件各発明の課題(上記⑴ア)を解決できると認識できる範囲のものであるとはいえない。
・・・原告は,サポート要件適合性が認められるためには,当業者において,技術常識も踏まえて課題が解決できるであろうとの合理的な期待が得られる程度の記載があれば足りると主張するが,上記⑴~⑶に説示したとおり,本件明細書が24ケ月要件に即した具体的な記載を一切欠く以上,これに接する当業者において,課題(24ケ月以上の保存安定性)が解決できるであろうとの合理的な期待が得られる程度の記載があるとは認められない。」
【コメント】
本件特許発明は、発明特定事項に、課題解決手段の効果自体(「24カ月の貯蔵安定性を有する」)を含む医薬製剤発明であり、明細書に、具体的な実施例(医薬製剤)が当該発明特定事項の要件を満たす(「24カ月の貯蔵安定性を有する」=課題解決効果を実現する)ことを合理的な説明をもって記載されていないとされ、サポート要件を充足しないと判断されました。
医薬製剤発明においては、本件の例のように、発明特定事項に、課題解決手段というよりも課題解決手段の(期待される又は奏する)効果自体を付加する場合が少なくありません。そのような表現でしか発明を特定しにくいという事情や敢えてそのような機能的表現で他社製品を抑えてしまおうといった積極的な理由である場合はあるかもしれませんが、そもそもそのような特定事項を入れなくて済むところ先行技術からの差別化(新規性や進歩性)を主張するためにそのような構成を付加せざるを得ない場合も多いでしょう。
本件も、出願の審査において、拒絶理由(進歩性等違反)を解消するために当該発明特定事項「24カ月の貯蔵安定性を有する」を加える補正を行った経緯があります。進歩性を主張するためにした補正は拒絶理由を解消し特許という成功を得ましたが、結果としてサポート要件違反を抱え込み、結果、ニプロはそこを突いて無効審判を請求してきたわけです。
本件は、サポート要件は、明細書に発明の構成が記載されているだけでは足りず、明細書中に合理的な説明、すなわち、合理的な期待を当業者に抱かせる程度の裏付けが記載されていることを要する、ということを示した典型的なサポート要件判断事例ではないかと思います。

当時の審査において、その特定事項を加える補正はせずに他の補正や反論でもう少し粘れなかったかな・・・明細書の記載内容を考えれば拒絶理由解消のためにこの補正は致し方なかったか・・・
ニプロは、本件特許無効審判請求事件の前に、本件特許5551658に対して別の無効審判請求を2016年10月27日にしていました(無効2016-800125)。こちらの別件無効審判では、新規性及び進歩性欠如についての無効理由によって本件特許を無効にすることはできないと判断されて請求不成立審決(2018年1月5日)となり、そのまま確定しています。
4.ジェネリックメーカーの動き
(1)ジェネリックメーカーによる出願
ニプロの他、以下のジェネリックメーカーが、パロノセトロンの製剤に関する特許出願をしている又は特許を保有していることが、J-PlatPatでのキーワード検索により分かります。少なくともこれらメーカーがアロキシ®のジェネリックの開発を進めているか、既に承認申請していると推測されます。
- ニプロ株式会社
- 武田テバファーマ株式会社
- サムヤン バイオファーマシューティカルズ コーポレイション
- 光製薬株式会社
- 株式会社柳英製薬
- 日本化薬株式会社
- 高田製薬株式会社
(2)ヘルシン社が保有するアロキシ®静注/点滴静注に関連する特許の存在
アロキシ®の有効成分であるパロノセトロン塩酸塩を保護する物質特許(特公平06-062607; 登録1935956、出願日1990.11.27)は、既に有効に存続していません(5年の期間延長(特願2010-700072)されたが、年金不納による抹消)。
しかし、ヘルシン社が保有するアロキシ®静注/点滴静注に関連する以下のいくつかの特許が登録され、特許権として存続しています。
パロノセトロンの液体製剤に関する特許
ヘルシン社の「パロノセトロン液状医薬製剤」に関する特許5551658は、上記のとおり、知財高裁において無効審決を維持する旨の判決(請求棄却判決)が出されました。
特許5551658は分割出願であり、その原出願(特願2006-501686)は特許5461763として登録され、その特許権は有効に存続しています。
特許5461763の請求項1:
b)4.0~6.0のpH に緩衝化された0.005~1.0mg/mlのEDTAを含んでなる薬学的に許容される担体;
を含む、嘔吐を抑制又は減少させるための薬学的に安定な静脈内投与用溶液。
興味深いことに、こちらの特許に対しては無効審判が請求されていません。二プロ等が承認申請しているかもしれないジェネリックはこの特許発明の技術的範囲を回避した(添加物としてEDTAを含有しない)製剤なのでしょうか・・・。こちらの特許権もアロキシ®を保護すると考えられ、その存続期間満了日は2024年1月30日(延長なし)となっています。
パロノセトロンの用法用量に関する特許群
「化学療法誘導嘔吐を治療するためのパロノセトロン」に関するヘルシン社の特願2004-553037(出願日2003年11月6日)に係る特許5690461、そこから派生した分割出願に係る特許5893950及び特許6342960が、現在有効に存続しており、いずれも存続期間満了日は2023年11月6日(延長なし)となっています。
特許5690461の請求項1(訂正後):
(a)高度に嘔吐発生性の化学療法により誘導された悪心及び嘔吐(CINV)からの遅延嘔吐の治療のためのものであって、パロノセトロンの量が患者の体重kg当り約10μgであり;
(b)患者の体重kg当り10μgのパロノセトロンの量で、患者の体重の範囲にわたって規定量のパロノセトロン塩酸塩を投与するためのものであり;そして
(c)嘔吐誘導事象の前1時間より短い時間内に、パロノセトロン塩酸塩を投与するためのものであり、そして嘔吐誘導事象に続く5日間にパロノセトロン塩酸塩の更なる投与を行わない;
ことを特徴とする医薬組成物。
特許5893950の請求項1:
(a)高度に嘔吐発生性の化学療法からの嘔吐及びむかつきの5日間の治療が可能であり;
(b)患者の体重kg当り10μg~30μgの量でパロノセトロンを投与するためのものであり;そして
(c)化学療法の前1時間より短い時間内に、10秒~60秒の期間にわたり静脈内ボーラスでパロノセトロンを単一投与するためのものである;
ことを特徴とする医薬組成物。
特許6342960の請求項1:
(a)高度に嘔吐発生性の化学療法からの嘔吐及びむかつきの5日間の治療のためのものであり;
(b)患者の体重kg当り3μg~30μgの量でパロノセトロンを投与するためのものであり;そして
(c)化学療法の前10時間より短い時間内にパロノセトロンを投与するためのものである;
ことを特徴とする医薬組成物。
ニプロは、上記3つの特許のうちの2つ(特許5690461及び特許5893950)について、それぞれ無効審判を請求(2016.09.30)しました(無効2016-800116及び無効2016-800117)が請求不成立審決となりました。ニプロは、それぞれの請求不成立審決に対して取消訴訟(平成31年(行ケ)10007及び平成31年(行ケ)10008)を提起(2019.01.24)しましたが、いずれも請求放棄したことで、それら不成立審決は確定した(2020.04.07)という経緯があります。
ニプロが特許5690461及び特許5893950についての無効審判請求不成立審決の取消訴訟を請求放棄した理由はわかりませんが、考えられることとして、ニプロはヘルシン社からこれら特許権の実施許諾を得て一定時期(2021年6月かそれ以降?)になってからジェネリックを販売するといった和解をした可能性、または、ニプロが予定しているかもしれないジェネリックの製造販売がこれら特許権を侵害しない又は無効理由の抗弁により争うことが可能とニプロは判断し、at riskで承認・販売に踏み切る可能性があるのかもしれません。
アロキシ®の用法及び用量には以下の記載があります。もし、ジェネリックが承認・販売され、上記用法・用量に関する特許権の侵害訴訟に発展することとなった場合には、アロキシ®の用法及び用量(下記記載)やその用法及び用量についてのアロキシ®審査報告書等から了承された事項・観点を踏まえて、アロキシ®自体(結果そのジェネリック)がこれら特許発明の技術的範囲に属するのかどうかが議論になるかもしれません。
アロキシ®の用法及び用量:
<用法・用量に関連する使用上の注意>
1. 本剤は、30秒以上かけて緩徐に投与し、抗悪性腫瘍剤投与前に投与を終了すること。
2. 本剤の消失半減期は約40時間であり、短期間に反復投与を行うと過度に血中濃度が上昇するおそれがある(「薬物動態」の項参照)。1週間未満の間隔で本剤をがん患者へ反復投与した経験はないため、短期間での反復投与は避けること。
3. バッグ製剤は静脈内に点滴注射すること。
残る1つの特許6342960に対しては、無効審判は請求されていません。二プロが特許5690461及び特許5893950について無効審判請求をした経緯を踏まえれば、ニプロは特許6342960も登録後すぐに後追いで無効審判請求していてもおかしくはないと思われますが・・・特許5690461及び特許5893950の無効審判請求の結末を見極めるまで敢えて静観することにしたか、特許6342960はジェネリック参入の障壁にはならないと判断したか、ということなのでしょうか。
(3)再審査期間の延長
アロキシ®の再審査期間は当初8年(承認日2010年1月20日から2018年1月19日まで)でしたが、2017年3月3日、「小児集団における使用経験の情報を集積するため、小児の用量設定に関する治験を実施する必要がある」と認められ、再審査期間は2020年1月19日まで延長されました。つまり、ジェネリックが承認申請できない期間が2年延長されました。
- 2017.02.09薬事・食品衛生審議会 医薬品第一部会 議事録
- 2017.03.03 薬生薬審発0303第9号
- 大鵬薬品 press release: 2020.06.15 「5-HT3受容体拮抗型制吐剤「アロキシ®」小児への用法・用量 追加承認申請のお知らせ」
ニプロは、上記のとおり再審査期間が2年延長されることが決まるまでは、再審査期間が終了するはずだった2018年1月19日の後に承認申請をして2019年2月にはアロキシ®にとって初のジェネリックの承認取得という想定で計画を進めていたのではないでしょうか。その承認想定時期(2019年2月)の約2年以上前となる2016年10月27日には前述したように本件特許5551658に対して別の無効審判請求をしていました(無効2016-800125)。
前述の通り、10年に延長されたアロキシ®の再審査期間は既に終了しています(~2020年1月19日)。その後、アロキシ®のジェネリックが承認申請されているとしたら、早ければ2021年2月には承認、同年6月には販売開始となる可能性があります。
(4)アロキシ®のジェネリックの承認時期は?
前述のとおり、アロキシ®に関連する特許権がいくつか存在します。ジェネリックメーカーは、それら特許権を回避してアロキシ®のジェネリックを申請している(申請してくる)のか、それともジェネリックの承認取得・販売後にヘルシン社と特許侵害訴訟で争うことも辞さない覚悟で承認申請しており、承認取得後に薬価収載・販売に踏み切るのか・・・2021年2月に承認となるジェネリックのリストの中に、ニプロや他のジェネリックメーカーからのアロキシ®初ジェネリックがあるのかどうか、見守りたいと思います。
5.その他

ヘルシン社のALOXI®といえば、昨年話題になったOn-Sale Barに関する米国最高裁判決(2019.01.22「HELSINN v. TEVA」SUPREME COURT OF THE UNITED STATES No.17-1229)があったね・・・
- エーザイ press release: 2018.01.18「制吐剤「ALOXI®」に関する米国の特許侵害訴訟について」
- Helsinn press release: 2018.06.26 「The US Supreme Court Grants Review for Certiorari of a Federal Circuit Panel Ruling that US Patent Protection for Aloxi® in the US Market was Invalid」
- 2019.01.22「HELSINN v. TEVA」SUPREME COURT OF THE UNITED STATES No.17-1229


コメント