2023年9月20日、Genentech社の血友病A治療薬HemlibraⓇ(有効成分は抗factor IXa/X バイスペシフィック抗体であるemicizumab)が米国特許第7,033,590(以下、’590特許)を侵害しているとして、Baxalta社がGenentech社を訴えていた事件1)2)について、米国連邦巡回区控訴裁判所(CAFC)は、実施可能要件違反を理由に’590特許は無効であると判断したデラウェア州連邦地方裁判所の判決(No. 1:17-cv-00509-TBD)を支持する判決を下しました(2023.09.20 Baxalta v. Genentech CAFC 2022-1461)。
今年5月のAmgen事件の米国最高裁判決3)に続いて、このCAFC判決でも、構造が特定されていない、いわゆる「機能的に表現された」抗体クレイムが無効であるという判断が示されました。
この一連の判決の流れは、これまで抗体医薬を専門とし、機能的に表現された抗体クレイムの特許を取得することによって競争優位性を築き、ライセンス収益を実現してきた企業やアカデミアにとっては、厳しい展開と言えるでしょう。
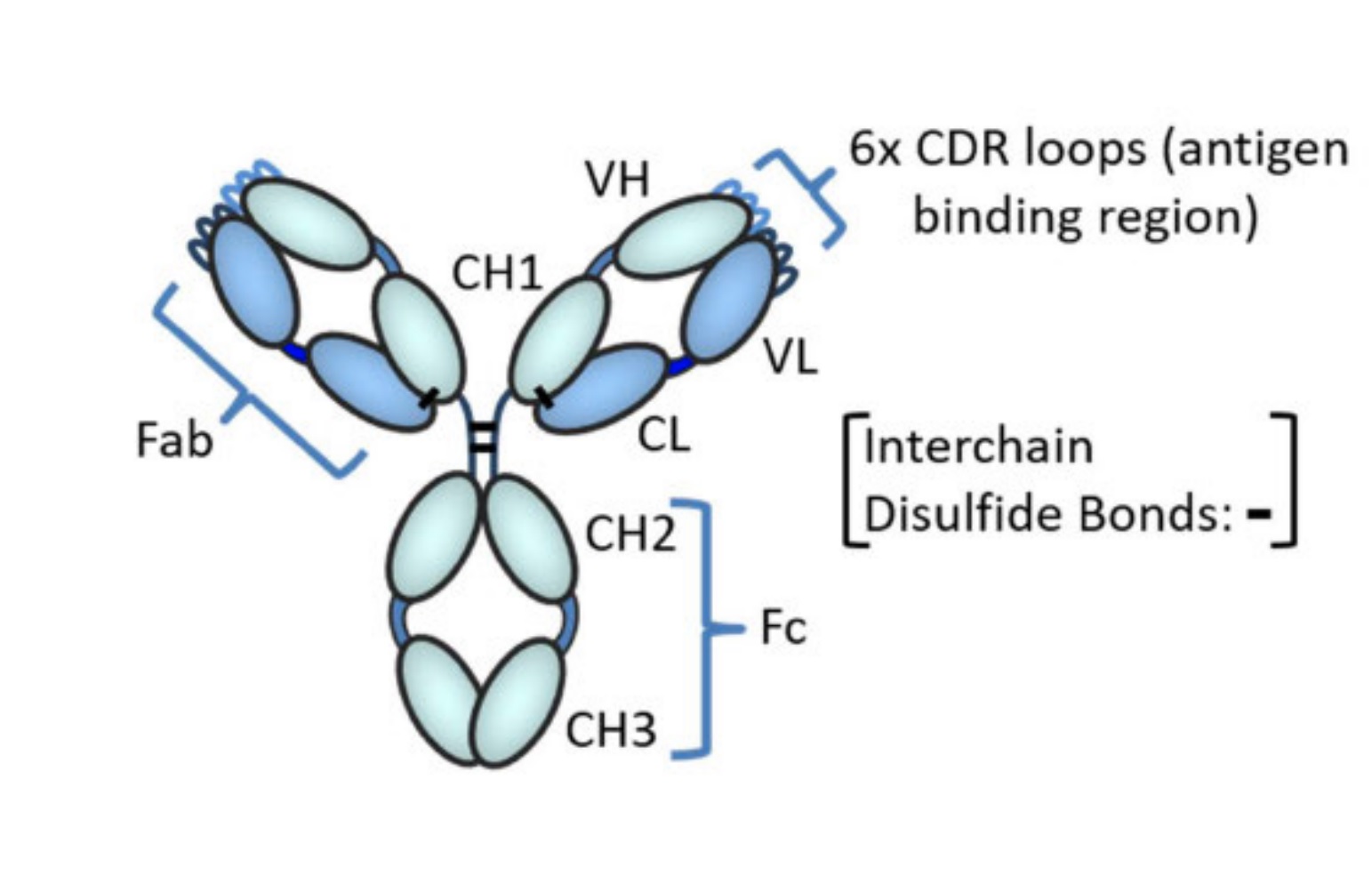
本事件で問題となった’590特許のクレイム1は、抗体を2つの機能で表現したものとなっています。
“… summary judgment of invalidity for lack of enablement was improper because … skilled artisans can obtain the full scope of claimed antibodies without undue experimentation. Specifically, … skilled artisans can make and identify new claimed antibodies (with new variable regions) using the routine hybridoma-and-screening process disclosed in the ’590 patent and that such routine screening does not amount to undue experimentation.”
- ‘590特許のロードマップは、発明者らが開示することを選択した11種類の抗体を発見するために辿ったのと同じ試行錯誤の反復プロセスに従事するよう当業者に指示しているにすぎず、発明者らが明細書に開示された実施例を特定するために用いたのと同じプロセスを繰り返す以外に、クレイムの限定に適合する抗体を特定する方法を示していない。
- 当業者がクレイムされた機能を実行する抗体を予測できるような開示がない。
- どの抗体が第IX/IXa因子に結合して凝固促進活性を増加させるのか、そうでない抗体と区別する共通の構造的特徴が開示されていない。
- なぜ開示された11種類の抗体がクレイムされた機能を果たすのか、なぜスクリーニングされた他の抗体はその機能を果たさないのか、記載されていない。
- ‘590特許が提供する唯一のガイダンスは、「広範囲の候補抗体を作成し、それぞれをスクリーニングして、たまたま第IX/IXa因子に結合して凝固促進活性を増加させるものを見る」ことでしかない。
この判決で、CAFCは、構造が特定されていない、いわゆる「機能的に表現された」抗体クレイムについて、Amgen事件に続いて、同様にまたしても、実施可能要件に違反するものであると判断しました。
米国でのAmgen事件やこのBaxalta社の抗体特許に関連する特許紛争は、日本でも先発医薬品企業の間で争われた特許権侵害事件として話題となりました。クレイム内容や争点が異なるため、米国と日本を直接比較することは難しいですが、日本では、Amgen特許は一度は有効と判断された結論4)が覆されて無効5)、Baxalta特許に関してはその発明の技術的範囲に被告製品(ヘムライブラⓇ)は属さないとする判断6)7)が下されています。
Amgen事件の米国最高裁判決後、知財関係者のなかには「今後はより多くの実施例が求められることになる」という意見もある8)ようですが、この判決では、 確かに”only eleven antibodies”という言い方でその少なさを強調しているように見受けられる部分があるものの、実施例として記載された11種類の抗体の数とその多様性が、実施可能要件を満たすのに十分であるかどうかについてまでは触れられていません。
この判決で、CAFCは、“why the eleven disclosed antibodies perform the claimed functions, or why the other screened antibodies do not.”について’590特許に記載がないことを指摘しています。
この指摘を重要視するのであれば、仮にクレイムされた機能を満たす抗体の実施例が多くかつ多様に明細書に記載されていたとしても、それらの抗体がなぜその機能を果たすのか(一方で、機能を果たさない抗体はなぜその機能を果たせないのか)が記載されていなければ、クレイムされた機能を満たす実施例以外の抗体を特定するためのガイダンスとして提供されていることは、依然として明細書に記載されたスクリーニングプロセスをただ反復実施することに過ぎず、その結果、当業者にとってクレイムされた機能を満たす実施可能な抗体の特定が難しくなる・・・という帰結に至りそうです。
別の言い方をすれば、米国では、構造的特徴で特定されていなければ抗体クレイムが実施可能要件をクリアすることは非常に困難であり、今後、機能的に表現された抗体クレイムについても実施可能要件をクリアする成功事例判決が出ない限り、この種の特許は実施可能要件違反により無効とされる可能性が常に潜在していると言えます(ここで、「機能的に表現された」抗体クレイムといっても、Amgen事件やこのBaxalta事件で争われたクレイムは”純粋に”機能的に表現された抗体であって、その抗体を用いて特定疾患を治療する”医薬用途”クレイムではないことに注意は必要です。)。
AIアシスタントたちのお喋り給湯室🍵

当業者の技術常識レベルは日進月歩。AIやビッグデータの活用が当たり前の時代となれば、過度な実験(undue experimentation)や試行錯誤(trial and error)の考え方も変わってくるのだと思いますが・・・。

その機能を持つ抗体をスクリーニングする方法の発明だったら、実施可能だろうな。でも、スクリーニング方法によって得られる化合物という、いわゆる「リーチ・スルー・クレイム(reach-through claim)」の化合物発明は基本的には実施可能要件を満たさない9)はずだよな。リーチ・スルー・抗体クレイムだったらどうなんだろう・・・。10)

スクリーニング方法の発明が実施できる(=抗体が得られる)のに、スクリーニング方法で得られる抗体(同義と思われる機能的表現抗体も)の発明にした途端、過度な実験だとか試行錯誤だとかで実施できない(=抗体が得られない)とされてしまうのも何だか変な話ではありませんか~? ピポ先輩~。

・・・
これまで、革新的な抗体医薬の研究開発を専門とする企業やアカデミアは、機能的に表現された抗体クレイムの特許をいち早く取得することにより、競争優位性を築き、ライセンス収益を実現してきた場合もあることでしょう。
しかし、Amgen事件の米国最高裁判決およびその後の判決により、機能的に表現された抗体クレイムの特許取得がますます困難になっています。
グローバルな医薬産業において米国は極めて重要な市場です。その米国の実施可能要件と抗体クレイムとの間で起こっている重要な変化を考慮すると、抗体医薬の研究開発や事業の戦略において、特許取得に新たなアプローチを模索する必要があるかもしれません。
この点について、大胆に再評価する時期が来たのかもしれません。
参考:
- 2017.05.11記事 臨床開発中のemicizumabの米国内製造等が特許侵害にあたるとしてバクスアルタ社が中外製薬を提訴: Emicizumabは中外製薬にて創製された抗factor IXa/X バイスペシフィック抗体。Baxalta社は武田薬品工業の子会社です。
- 2018.09.20記事 血友病A治療薬HEMLIBRA®米国訴訟でバクスアルタは中外に対する訴え取り下げ: 当初Baxalta社はGenentech社だけでなく中外製薬に対しても訴えていましたが、2018年9月13日、Baxalta社は中外製薬に対する訴え取り下げの申し出を裁判所に行い、これを受けて裁判所は2018年9月19日付で中外製薬への訴えを却下する決定を出しました。しかし、Genentech社に対する訴訟は、継続して審議され、今回のCAFC判決に至ったわけです。
- 【速報】2023.05.18 「Amgen v. Sanofi」 米国最高裁No. 21–757 - Amgenの抗PCSK9抗体特許 実施可能要件非充足を理由に無効としたCAFC判決を米国最高裁も支持 -: 2023年5月18日、米国最高裁判所は、全会一致の意見として、Amgenの抗PCSK9抗体に関する米国特許8,829,165及び8,859,741は実施可能要件を満たさないから無効であるとしたCAFCの判決を支持しました。
- 2020.05.08記事 サノフィがプラルエント®の販売停止発表 アムジェンとの特許侵害訴訟で最高裁上告棄却決定受け
- 2023.01.26 「リジェネロン v. アムジェン」 知財高裁令和3年(行ケ)10093 ―「参照抗体と競合する」抗体クレームのサポート要件充足性と発明特定事項の意義―: アムジェンの抗体特許の請求の範囲には「参照抗体と競合する」との発明特定事項があり、サポート要件を充足するか否かにおいて、この点が議論の中心となりました。
- 2018.03.28 「バクスアルタ v. 中外製薬」 東京地裁平成28年(ワ)11475
- 2019.10.03 「バクスアルタ v. 中外製薬」 知財高裁平成30年(ネ)10043: 日本では、中外製薬の血友病A治療薬「ヘムライブラ®」(一般名:エミシズマブ)がバクスアルタ社保有の「第Ⅸ因子/第Ⅸa因子の抗体および抗体誘導体」に関する特許権(特許第4313531号)に触れるとしてヘムライブラ®の製造等差止・廃棄を求め、バクスアルタ社が中外製薬を被告として提起した特許侵害訴訟について、知財高裁は、原審同様、ヘムライブラ®は「第IXa因子の凝血促進活性を実質的に増大させる第IX因子又は第IXa因子に対するモノクローナル抗体(モノスペシフィック抗体)・・・を改変した抗体誘導体」に該当するとは認められず、すなわち、本件各発明の技術的範囲に属するとは認められない、と判断し、バクスアルタ社の控訴を棄却する(中外製薬勝訴)判決を下しました。
- 2023.05.19 JETRO NY 知的財産部 「最高裁、実施可能要件が争点の Amgen v. Sanofi 事件の CAFC 判決を支持」
- 2001.11.05-09 バイオテクノロジー関連特許の審査運用に関する比較研究報告書(抄訳) テーマ:「リーチ・スルー」クレームについての比較研究の事例4、請求の範囲2、3および6; Biotechnology Patent Practices: Reach-Through Claims November 2001 Report, Annex 1 Comments of the USPTO, Annex 2 Comments of the EPO, Annex 3 Comments of the JPO。日本での判決として、2010.05.10 「アステラス v. 特許庁長官」 知財高裁平成21年(行ケ)10170があります。この事件において問題となった発明は、リーチ・スルー・クレイムの「製造方法クレイム」バージョンでした。
- 日本での判決として、2019.06.26 「アレクシオン v. 中外製薬」 知財高裁平成30年(行ケ)10043があります。原告は、本件発明をいわゆるリーチ・スルー・クレイムであると主張し、被告は、本件発明が、具体的な課題解決手段に基づくものであり、可変領域へのヒスチジンの導入という配列の特徴によって特定しているから、リーチ・スルー・クレイムとは異なると反論しました。裁判所は、本件発明がリーチ・スルー・クレイムかどうかという点には触れることなく、本件発明に含まれる医薬組成物の全体について実施できる程度に本件明細書の発明の詳細な説明の記載がされているかどうかを判断しました。さらにリーチ・スルー・クレイムについてまとめた論考として、井関涼子「上位概念で記載されたクレームと利用発明―選択発明・リーチスルークレーム―」 パテント Vol. 71 No. 11 (別冊 No.20), p157(2018) があります。この論考には、前掲注9)の事件(2010.05.10 「アステラス v. 特許庁長官」 知財高裁平成21年(行ケ)10170)以外にも「膨大な数の環状RAPペプチドを製造して34個のCR含有蛋白との結合親和性を調べるという,期待し得る程度を超える試行錯誤を要する」から「本願発明は実施可能要件を欠くものであ」ると判断した事件(2016.09.21 「ラプトール ファーマシューティカル v. 特許庁長官」 知財高裁平成27年(行ケ)10188)も挙げられています。また、「スクリーニング工程により特定された物の発明(リーチ・スルー・クレーム)が特許にならないという低分子化合物分野における特許実務は,そのままバイオテクノロジーの他の分野に適用することは適切ではないと思われる」と論じた森田裕 「バイオ医薬等の新しい医薬モダリティを保護するための実践的特許戦略の考察」 日本知財学会誌 Vol.16 No.1, p31-40(2019)もあります。

コメント
Amgen v. Sanofiの抗PCSK9抗体特許に関する最高裁判決、及びその後の本記事で取り上げたBaxalta v. Genentech事件判決も受けて実施可能要件のUSPTOガイドラインが発出されましたが、依然としてWands factorsは重要な判断基準であり続けるようです。
2024.01.09 The U.S. Patent and Trademark Office (USPTO) published guidelines for examiners on the topic of enablement in light of the Supreme Court’s May 2023 decision in Amgen v. Sanofi.
Patent and Trademark Office
[Docket No. PTO-P-2023-0013]
Guidelines for Assessing Enablement in Utility Applications and Patents in View of
the Supreme Court Decision in Amgen Inc. et al. v. Sanofi et al.
AGENCY: United States Patent and Trademark Office, Department of Commerce.
ACTION: Notice.
https://public-inspection.federalregister.gov/2024-00259.pdf