1.はじめに
「PIVKA-IIを特異的に認識して結合する抗体」に関するアボット・ラボラトリーズの特許に対する無効審判請求を不成立とした審決を不服としてロシュ ダイアグノスティックスが提起した審決取消訴訟(知財高裁令和4年(行ケ)10082)で、知財高裁は、本件審決の判断に誤りはなく、ロシュ ダイアグノスティックスが主張する取消事由(新規性、進歩性、拡大先願との同一性、明確性要件、サポート要件及び実施可能要件の有無に関する誤り)はいずれも理由がないと判断した。
アボット・ラボラトリーズとロシュ ダイアグノスティックスは、日本において、それぞれ体外診断用医薬品であるPIVKA-IIキットを製造販売しており、この競合関係に今回の特許紛争の火種があるのだろうと想像される。
本稿は、本件の裁判所の判断を簡単に紹介しつつ、「抗原Xに結合する抗体クレイム」に関するサポート要件及び実施可能要件について、最近の判決、論考、欧米での動向等を参照しながら、まとまりのない思いついたままの感想を述べるものである。
2.背景
本件(知財高裁令和4年(行ケ)10082)は、アボット・ラボラトリーズ及びその日本法人であるアボットジャパン株式会社(以下、あわせて「被告」又は「アボット」と略すことがある)が特許権者であり、発明の名称を「PIVKA-IIに関する抗体およびその使用」とする特許第5981914号の本件各発明に対して、ロシュ ダイアグノスティックス ゲーエムベーハー(以下、「原告」又は「ロシュ ダイアグノスティックス」という)がした無効審判請求(無効2019-800091号事件)を不成立とした審決の取消訴訟である。
例えば、訂正後の本件発明3(本件訂正発明3)は以下のとおりである。
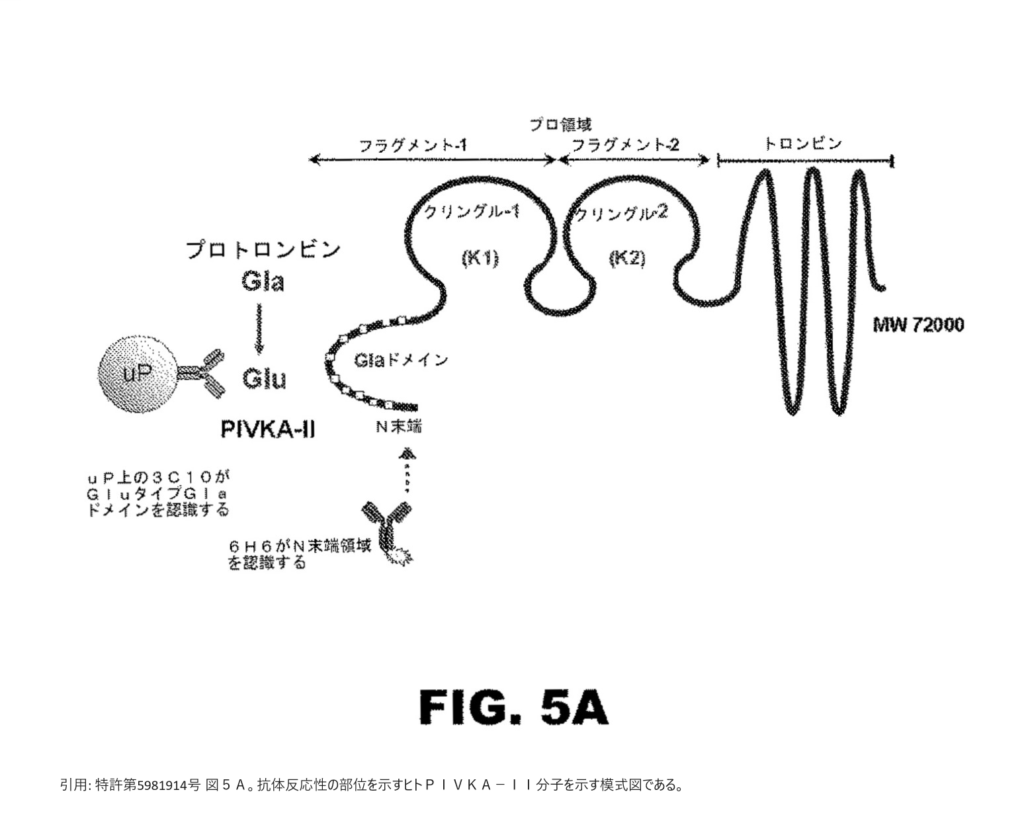
プロトロンビン誘導ビタミンKアンタゴニストII(PIVKA-II)のアミノ酸1-13に結合する抗原結合性部分を含み、PIVKA-IIを特異的に認識して結合する、単離された結合性タンパク質(但し、受託番号FERM BP-11259で特定されるハイブリドーマにより産生されるモノクローナル抗体を除く)。
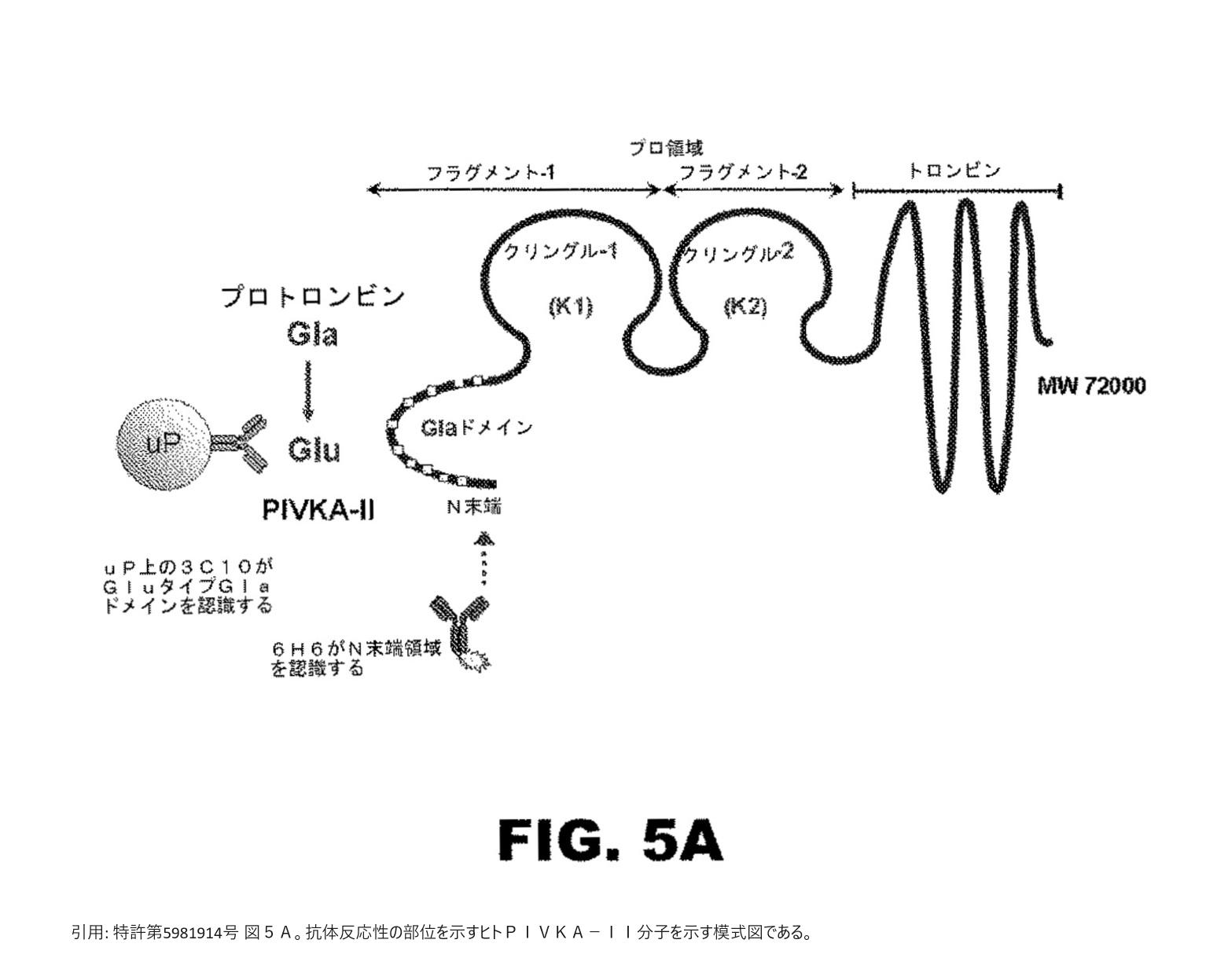
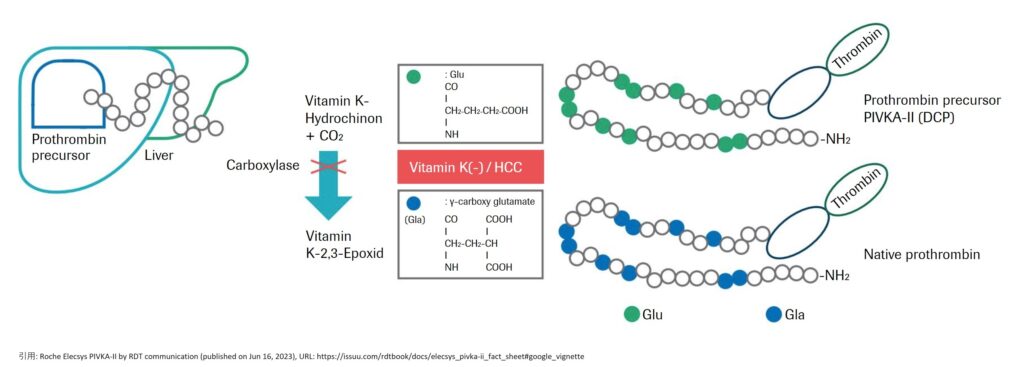
通常、プロトロンビン前駆体は、血漿中に分泌される前に、肝臓内でγ-グルタミルカルボキシラーゼによる翻訳後修飾カルボキシル化(カルボン酸基の付加)を受け、N末端領域にある10個のグルタミン酸残基がγ-カルボキシル化されたプロトロンビンが生成される(以下、この領域を「Glaドメイン」又はそのγ-カルボキシル化されたグルタミン酸残基を「Gla」という)。
しかし、病気等でビタミンKが欠乏すると、プロトロンビンは、γ-カルボキシル化されずに「PIVKA-II」(Protein induced by vitamin K absence or antagonist-II、別名des-gamma-carboxy prothrombin(DCP))として出現することになる(以下、γ-カルボキシル化されなかったグルタミン酸残基を「Glu」という)。
特に、肝細胞癌(HCC)の場合にPIVKA-IIは上昇することが知られている。
本件各発明は、従来、肝細胞癌(HCC)、肝癌の診断等に利用可能なPIVKA-IIに対するイムノアッセイでは不可能であったPIVKA-IIのアミノ酸17-23のグルタミン酸残基の外側(N末端側)の検出を可能にした新たな抗体として、「PIVKA-IIのアミノ酸1-13に結合する抗原結合性部分」を含む単離された抗体及びイムノアッセイ方法に関するものである。
本件特許明細書の発明の詳細な説明に、本件訂正発明3の「結合性タンパク質」として、調製例及び使用例が具体的に開示されているのは、ATCC受託番号PTA-10541によって特定されるハイブリドーマから産生されるモノクローナル抗体である「6H6モノクローナル抗体」のみである。
実施例1には、「6H6モノクローナル抗体」の調製方法、実施例2には、同抗体のPIVKA-IIペプチド(1-13)又はプロトロンビンペプチド(1-13)に対する親和性の比較、実施例3には、自動化イムノアッセイにおける同抗体の使用例が記載されている。
 無効審判では、特許庁は、訂正を認めたうえで、請求項3~5、13、15~22、25~31、33~38、40、45~53、55、57~69、71、72に係る発明(以下、「本件訂正発明」という)についての無効審判請求は成り立たないと審決した。
無効審判では、特許庁は、訂正を認めたうえで、請求項3~5、13、15~22、25~31、33~38、40、45~53、55、57~69、71、72に係る発明(以下、「本件訂正発明」という)についての無効審判請求は成り立たないと審決した。
原告が主張した取消事由は、
- 本件訂正発明3に対する新規性の有無に関する判断の誤り(取消事由1)
- 本件各訂正発明に対する進歩性の有無に関する判断の誤り(取消事由2)
- 本件各訂正発明と拡大先願との同一性に関する判断の誤り(取消事由3)
- 本件各訂正発明の明確性要件違反の有無に関する判断の誤り(取消事由4)
- 本件各訂正発明のサポート要件違反の有無に関する判断の誤り(取消事由5)
- 本件各訂正発明の実施可能要件違反の有無に関する判断の誤り(取消事由6)
である。
3.裁判所の判断
知財高裁第3部(以下、「裁判所」と略す)は、本件審決の判断に誤りはなく、原告が主張する取消事由はいずれも理由がないから、原告の請求は棄却されるべきであるとして、主文のとおり判決した。
1 原告の請求を棄却する。
2 訴訟費用は、原告の負担とする。
3 この判決に対する上告及び上告受理申立てのための付加期間を30日と定める。
以下、本件訂正発明3に絞って裁判所の判断を紹介する。
(1)「PIVKA-IIを特異的に認識して結合する」の意義について
原告は、各取消事由に関する主張において、本件訂正発明3の「PIVKA-IIを特異的に認識して結合する」の意義に関する本件審決の解釈に誤りがあり、この誤りが各取消事由に係る本件審決の判断の誤りにつながっているという趣旨の主張をした。
しかし、裁判所は、本件明細書等の記載及び特許出願当時の技術常識を踏まえれば、当業者であれば、本件訂正発明3の「PIVKA-IIを特異的に認識して結合」するとは、下記のとおり、本件訂正発明3の「結合性タンパク質」が、PIVKA-IIにおける6位及び/又は7位のGluを含む構造と、プロトロンビンにおける6位及び7位のGlaを含む構造とを識別し、両者の構造の違い(すなわち、PIVKA-IIにおける6位及び/又は7位のGluを含む特異的な構造部位の有無)に依存して、その両者に対する反応性が異なることを意味すると解するのが相当であり、単にPIVKA-IIのアミノ酸1-13に存在するエピトープを認識してPIVKA-IIに結合することを意味すると解することはできないとして、原告の上記主張は採用することができない、と判断した。
「本件明細書等の段落【0029】の「抗体はこのように、PIVKA-IIを特異的に認識し結合することができる」の「このように」とは、「抗体」ないし「結合性タンパク質」が、アミノ酸1-13のカルボキシル化されたアミノ酸残基(プロトロンビン)よりも、アミノ酸1-13の脱炭酸されたアミノ酸残基(PIVKA-II)と強力に反応する特性を有することにより、従来、利用可能なPIVKA-IIに対するイムノアッセイでは不可能であったPIVKA-IIの「アミノ酸17-23のGLAの外側(脱炭酸されたGLAを含む。)」の検出を可能にし、「高レベルの特異性」で、すなわち抗体(結合性タンパク質)のPIVKA-IIとプロトロンビンとの反応性の違いに基づいて、プロトロンビンと十分に識別してPIVKA13-27及びPIVKA1-27の両方を検出することを指すものと認められる。そして、このように、抗体のPIVKA-IIとプロトロンビンとの反応性の違いに基づいて、PIVKA-IIをプロトロンビンと識別して結合することが「PIVKA-IIを特異的に認識し結合する」ことを意味するものと解される。」
(2)新規性・進歩性の有無に関する判断の誤り(取消事由1及び2)
裁判所は、甲4(The Journal of Biological Chemistry, Vol.263, No.13, p6259-6267 (1988))の記載によれば、甲4-1発明の抗体H-11は、抗原決定基のグルタミン酸残基がγ-カルボキシル化されたプロトロンビンであっても、γ-カルボキシル化が不完全なPIVKA-IIであっても認識し、結合すると認められるから、「PIVKA-IIを特異的に認識して結合」するものとは認められないから、本件訂正発明3と甲4-1発明との一致点及び相違点は、本件審決が認定したとおりであるとし、したがって、本件訂正発明3と甲4-1発明とが同一であるとは認められないと判断した。
- 〔一致点〕
「単離された結合性タンパク質(但し、受託番号FERM BP-11 259で特定されるハイブリドーマにより産生されるモノクローナル抗体を除く)。」 - 〔相違点〕
単離された結合性タンパク質が、本件訂正発明3では、「プロトロンビン誘導ビタミンKアンタゴニストII(PIVKA-II)のアミノ酸1-13に結合する抗原結合性部分を含み、PIVKA-IIを特異的に認識して結合する」ものであるのに対して、甲4-1発明では、そのような特定がない点。
そして、裁判所は、甲4には、「PIVKA-IIを特異的に認識して結合する」ものが記載も示唆もされているとは認められないから、甲4-1発明の抗体H-11を、「PIVKA-IIを特異的に認識して結合する」ものとすることは、当業者が容易に想到できたものとはいえないと判断した。
(3)拡大先願との同一性に関する判断の誤り(取消事由3)
裁判所は、甲11-1発明にある「モノクローナル抗体P-16」は「受託番号FERM BP-11259で特定されるハイブリドーマにより産生されるモノクローナル抗体」であるところ、当該抗体は本件訂正発明3から明示的に除かれており、そして、甲11-1発明を原告の主張する「甲11-1’発明」(精製したPIVKA-IIをマウスに注射することによって生産される、モノクローナル抗体P-16を一例とする、PIVKA-IIに特異的に結合するモノクローナル抗体。)と認定することはできない、すなわち、甲11-1発明にモノクローナル抗体P-16以外の抗体が含まれているとは認められず、甲11-1発明は本件訂正発明3と同一ではないとした本件審決の判断に誤りはないと判断した。
(4)明確性要件違反の有無に関する判断の誤り(取消事由4)
裁判所は、以下のとおりの判断基準を示した。
「特許を受けようとする発明が明確であるか否かは、特許請求の範囲の記載だけではなく、願書に添付した明細書の記載及び図面を考慮し、また、当業者の出願当時における技術常識を基礎として、特許請求の範囲の記載が、その技術的範囲に属するか否かの判断が困難となることにより第三者の利益が不当に害されるほどに不明確であるか否かという観点から判断するのが相当である。」
そして、本件訂正発明3の明確性について、裁判所は、前説示のとおり、本件明細書等の記載及び特許出願当時の技術常識を踏まえれば、本件訂正発明3の「PIVKA-IIを特異的に認識して結合」するとは、本件訂正発明3の「結合性タンパク質」が、PIVKA-IIにおける6位及び/又は7位のGluを含む構造と、プロトロンビンにおける6位及び7位のGlaを含む構造とを識別し、両者の構造の違い(すなわち、PIVKA-IIにおける6位及び/又は7位のGluを含む特異的な構造部位の有無)に依存して、その両者に対する反応性が異なることを意味すると当業者は理解することができるから、本件訂正発明3について、特許請求の範囲の記載が、その技術的範囲に属するか否かの判断が困難となることにより第三者の利益が不当に害されるほどに不明確であるとは認められない、と判断した。
(5)サポート要件違反の有無に関する判断の誤り(取消事由5)
裁判所は、以下のとおりの判断基準を示した。
「特許請求の範囲の記載がサポート要件に適合するか否かは、特許請求の範囲の記載と発明の詳細な説明の記載とを対比し、特許請求の範囲に記載された発明が、発明の詳細な説明に記載された発明で、発明の詳細な説明の記載により当業者が当該発明の課題を解決できると認識できる範囲のものであるか否か、また、発明の詳細な説明に記載や示唆がなくとも当業者が出願時の技術常識に照らし当該発明の課題を解決できると認識できる範囲のものであるか否かを検討して判断すべきものと解される。」
そして、裁判所は、本件明細書等の記載によれば、本件各訂正発明は、肝細胞癌(HCC)又は肝癌を検出するのに有効に用いられ得るモノクローナル抗体を提供することを課題とするものであると認められ、本件各訂正発明の課題を解決するために、PIVKA-IIにおける6位及び/又は7位のGluを含む構造と、プロトロンビンにおける6位及び7位のGlaを含む構造とを識別し、両者の構造の違い(すなわち、PIVKA-IIにおける6位及び/又は7位のGluを含む特異的な構造部位の有無)に依存して、その両者に対する反応性が異なるという特徴を有する「結合性タンパク質」を提供することが記載されていると認めることができること、そして、実施例2によれば、本件訂正発明3の「結合性タンパク質」の具体例である6H6モノクローナル抗体は、プロトロンビンペプチド(1-13)に比してPIVKA-IIのアミノ酸1-13ペプチドに高い親和性を有しており、実施例3によれば、6H6モノクローナル抗体を試薬として用いた自動イムノアッセイについて、ヒト血清中のPIVKA-IIを検出するアッセイの能力を実証したことが記載されており、HCC患者の場合に上昇することが知られているPIVKA-IIを実際に検出できたことが裏付けられていることを総合すれば、本件訂正発明3の「結合性タンパク質」は前記課題を解決できるものと認められるとし、したがって、本件明細書等の発明の詳細な説明の記載及び本件特許の出願時における技術常識に照らし、本件訂正発明3は、当業者が前記課題を十分に解決できると認識できる範囲のものであり、かつ、発明の詳細な説明に記載されたものといえる、と判断した。
(6)実施可能要件違反の有無に関する判断の誤り(取消事由6)
裁判所は、以下のとおりの判断基準を示した。
「特許法36条4項1号に規定する実施可能要件については、明細書の発明の詳細な説明が、当業者において、その記載及び出願時の技術常識に基づいて、過度の試行錯誤を要することなく、特許請求の範囲に記載された発明を実施できる程度に明確かつ十分に記載されているかを検討すべきである。」
そして、裁判所は、発明の詳細な説明の記載事項によれば、PIVKA-IIにおける6位及び/又は7位のGluを含む特異的な構造部位に高い反応性を示す抗体を得るために、対応するPIVKA-IIのアミノ酸1-17の配列を有するペプチドを免疫原として用いた一般的な製造方法により、本件訂正発明3の所定の「抗原結合性部分」を有する「結合性タンパク質」(抗体)を調製すること、その抗体が、PIVKA-IIにおける6位及び/又は7位のGluを含む構造とプロトロンビンにおける6位及び7位のGlaを含む構造とを識別して反応性が異なることを利用して、従来の競合的又は非競合的イムノアッセイにより、生物学的試料中のPIVKA-IIの量を検出及び/又は定量するのに使用することやHCC又は肝癌の診断に使用することは、当業者が過度の負担なくなし得ることといえるとして、明細書の発明の詳細な説明は、当業者においてその記載及び出願時の技術常識に基づいて過度の試行錯誤を要することなく本件訂正発明3を実施できる程度に明確かつ十分に記載されているといえる、と判断した。
4.コメント
本件は、アボット・ラボラトリーズ及びその日本法人であるアボットジャパン株式会社(以下、あわせて「アボット」と略すことがある)が特許権者であり、肝細胞癌(HCC)の診断に有用なPIVKA-IIに対する抗体及びイムノアッセイ方法に関する特許第5981914号の本件各発明に対して、ロシュ ダイアグノスティックスがした無効審判請求を不成立とした審決の取消訴訟である。
最初にアボットとロシュ ダイアグノスティックスとの関係に触れ、それから、本件における「抗原Xに結合する抗体クレイム」に関するサポート要件及び実施可能要件を中心に、最近の判決、論考、欧米での動向等を参照しながら、まとまりのない思いついたままの感想を述べたい。
(1)PIVKA-Ⅱキットでの競合
アボットとロシュ ダイアグノスティックスは、体外診断薬業界においてグローバルな主要プレーヤーであり、互いにシェアを奪い合うライバル関係にある。
日本において、両社は、それぞれ体外診断用医薬品であるPIVKA-IIキットを製造販売しており、この競合関係に今回の特許紛争の火種があるのだろうと想像される。
- アボットジャパン合同会社は、体外診断用医薬品であるPIVKA-Ⅱキット「PIVKA-II・アボット」(アーキテクト®F5-Y309-1/J06/R03)を製造販売している(添付文書)。
- ロシュ・ダイアグノスティックス株式会社は、体外診断用医薬品であるPIVKA-Ⅱキット「エクルーシス®試薬 PIVKA-II」(コバス®システム)を製造販売している(例えば、添付文書(第4版))。
添付文書によれば、ロシュ・ダイアグノスティックスのPIVKA-IIキット製品は、ビオチン化抗PIVKA-II抗体及びRu(bpy)3標識抗 PIVKA-II抗体を用いて血清又は血漿中の異常プロトロンビン(PIVKA-II)を測定するものであるが、本件特許権に係る発明を実施するものかどうかは定かではない。
日本で本件を含む特許紛争が起きているのであれば、欧米でも同様に両者間で特許紛争が並行して起きているのではないかと想像されるところ、アボットの本件特許第5981914号の欧米ファミリーの現在の状況は以下のとおりであった。
- 欧州(EP2598534A1)では、審査の段階で補正等手続きはしたものの、その後renewal feeを支払わず、権利化を断念したようである。
- 米国では、US9,120,862として登録に至っている。しかし、そのクレイムは、例えば、”A method of detecting PIVKA-II antigen in a test sample, the method comprising…のような方法クレイムであり、さらにクレイムを構成する抗体は、ATCC受託番号PTA-10541によって特定されるハイブリドーマから産生されるモノクローナル抗体に限定されている。すなわち、米国特許は、本件特許明細書の発明の詳細な説明に唯一抗体の実施例として調製例及び使用例が具体的に開示されている「6H6モノクローナル抗体」に限定されている。
したがって、ロシュ ダイアグノスティックスは、欧米でのPIVKA-IIキット製品の製造販売においては、このアボット特許を問題視していないかもしれない。
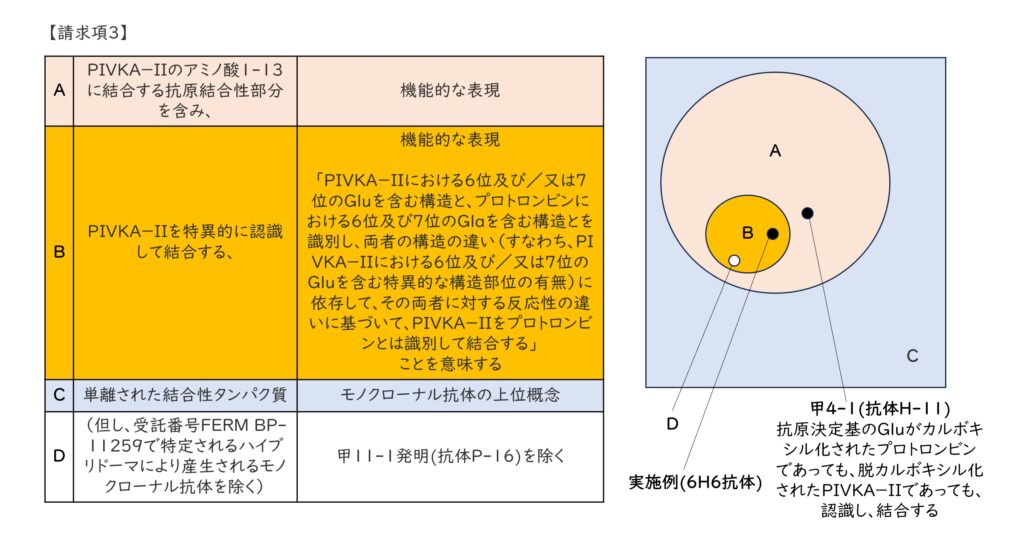
(2)抗体を特徴づける二つの発明特定事項
日本において、本件訂正発明3は、除くクレイムの構成部分を除けば、「PIVKA-IIのアミノ酸1-13に結合する抗原結合性部分を含み、PIVKA-IIを特異的に認識して結合する」という機能的な表現により「単離された結合性タンパク質」を特定しているものであって、その「タンパク質」の具体的な構造を一切表現していないという点で、唯一の実施例である「6H6モノクローナル抗体」に限定されている米国のクレイムに比べると、極めて広範な範囲に及ぶクレイムとなっている。
上表は、本件訂正発明3を発明特定事項A~Dに区分し、その意義を併記したものであり、右上図は、それら発明特定事項A~D、実施例及び引用発明の関係性を表現してみたものである。
裁判所は、甲4-1発明は、Bの特徴を有するものとは認められないから本件訂正発明3と甲4-1発明とが同一であるとは認められないと判断した。
すなわち、Aの特徴を有する抗体ならば当然にBの特徴を備えているわけではないというわけである。
したがって、抗体が結合する相手タンパク質の特定部位への比較反応性(特異性)を機能的に表現したBの発明特定事項は、Aの特徴を有する抗体をさらにその特徴により限定する実質的な意義があるといえるだろう。
さらに一般化するとすれば、本件訂正発明3は、「抗原X(又はエピトープ)に結合する抗体」をさらに「特異的に認識して結合する」という特徴により限定されたクレイムであると表現することができるだろう。
(3)「抗原Xに結合する抗体クレイム」のサポート要件
「抗原X(又はエピトープ)に結合する抗体クレイム」は、具体的な構造を一切特定せずに、作用する相手(標的抗原又はエピトープ)のみで特定した物の発明であるから、まず第一に、サポート要件の充足性が問題となるところだろう。
サポート要件について判断した有名な「偏光フィルムの製造法」事件大合議判決(2005.11.11知財高裁平成17年(行ケ)10042)は、
「本件発明は,特性値を表す二つの技術的な変数(パラメータ)を用いた一定の数式により示される範囲をもって特定した物を構成要件とするものであり,いわゆるパラメータ発明に関するものであるところ,このような発明において,特許請求の範囲の記載が,明細書のサポート要件に適合するためには,発明の詳細な説明は,その数式が示す範囲と得られる効果(性能)との関係の技術的な意味が,特許出願時において,具体例の開示がなくとも当業者に理解できる程度に記載するか,又は,特許出願時の技術常識を参酌して,当該数式が示す範囲内であれば,所望の効果(性能)が得られると当業者において認識できる程度に,具体例を開示して記載することを要するものと解するのが相当である。」
と説示した。
この大合議判決が説示したサポート要件に適合する二つの場合について、田村善之先生は、前者を、特許発明に係る技術的思想を演繹的に記載することによってサポート要件を充足させることから「技術的意味型」、後者を、実施例を多数揃えることにより帰納的に記載することによってサポート要件を充足させることから「具体例型」と呼び、そして、このような方策はパラメータ特許に限られるものではないから、一般的な通有性を誇るものと理解できるとし、その後の「被覆硬質部材」事件判決(2008.06.12知財高裁平成19(行ケ)10308)も、この大合議判決を踏襲しつつ、実施例の記載が不十分であるために「具体例型」に当たらない場合、「技術的意味型」として救済されるのは「特許請求の範囲に記載された発明によって課題解決若しくは目的達成等が可能となる因果関係又はメカニズムが、明細書に開示されいているか又は当業者にとって明らかであるなどの場合」であることを明らかにしたものであると指摘する。
この考察を踏まえて、「抗原Xに結合する抗体クレイム」についてサポート要件が争点となった最近の二つの判決及び本件を紹介する。
「プロタンパク質コンベルターゼスブチリシンケクシン9型(PCSK9)に対する抗原結合タンパク質」事件(ブログ記事「2023.01.26 「リジェネロン v. アムジェン」 知財高裁令和3年(行ケ)10093 ―「参照抗体と競合する」抗体クレームのサポート要件充足性と発明特定事項の意義―」参照)では、 裁判所は、クレイムは「参照抗体と競合する」と「結合を中和する」という発明特定事項を兼ね備えた抗体であるとする特許権者側の主張を退け、当該発明の技術的意義は「参照抗体と競合する」抗体であれば「結合を中和する」抗体としての機能的特性を有することを特定した点にあると認定し、明細書にはその因果関係が成り立つことについて説明がないことからサポート要件を充足しないと判断した。
この判決は、その機能的な特徴を有する抗体と課題解決・目的達成との因果関係が成立しないから「技術的意味型」としても救済することができないと裁判所が判断した事例と理解することができそうだ。現在、差し戻し審判が係属中であり、最終的にどのようなクレイムの訂正が許容されるのかが注目される。
「低比重リポタンパク質受容体関連タンパク質6(LRP6)を調節するための分子および方法」事件(ブログ記事「2018.09.18 「ノバルティス v. 特許庁長官」 知財高裁平成29年(行ケ)10045」参照)では、裁判所は、「本件明細書には・・・具体的なFabの構造(アミノ酸配列)も,当該抗原結合断片が認識するエピトープ・・・も記載されていない。・・・そして,特許請求の範囲には,「モノクローナル抗体の抗原結合部分がWnt1特異的であり,優先的にWnt1誘導シグナル伝達経路を阻害するが,Wnt3a誘導シグナル伝達経路を阻害しない」という機能的な特徴を有することが記載されているものの,これらの機能と得られたFabの構造上の特徴等を関連づける情報も何ら記載されていない」からサポート要件を充足しないと判断した。

この判決は、「具体的な構造も・・・記載されていない」ことから「具体例型」としてサポート要件を充足しないと判断し、なおかつ、クレイムで表現された抗体のそれら機能と抗体の「構造上の特徴」との関係について説明が不足しているから「技術的意味型」としても救済することができない、と判断した事例と理解することができそうだ。
そして本件であるが、裁判所は、肝細胞癌(HCC)又は肝癌を検出するのに有効に用いられるモノクローナル抗体を提供することが課題であること、そして、この課題を解決するために、PIVKA-IIにおける6位及び/又は7位のGluを含む特異的部位に依存して反応する(すなわち「PIVKA-IIを特異的に認識して結合する」)という特徴を有する「結合性タンパク質」(本件訂正発明3)を提供することが本件明細書に記載されていると認め、本件訂正発明3についてサポート要件を充足すると判断した。
裁判所が、PIVKA-IIにおける特異的部位(6位及び/又は7位のGlu)に結合する抗体によって、HCCを検出するのに有効な抗体を提供したいという課題を解決若しくは目的を達成することが可能になるという因果関係が明細書に開示されていると判断したのだと理解すれば、この判断は、少なくとも「技術的意味型」として、又は、「6H6モノクローナル抗体」の実施例一つでその因果関係を補ったという点では「技術的意味型」を「具体例型」により補った「相補型」として、サポート要件を充足していると認めたものと理解できる。
前述の「低比重リポタンパク質受容体関連タンパク質6(LRP6)を調節するための分子および方法」事件と違い、本件の判断では、クレイムで表現された抗体の機能とその抗体の「構造上の特徴」とを関連づける説明が明細書に記載されているかどうかを問題としていないところは注目すべき点かもしれない。
しかし、「PIVKA-IIを特異的に認識して結合する」との発明特定事項は、裁判所が「PIVKA-IIにおける6位及び/又は7位のGluを含む構造と、プロトロンビンにおける6位及び7位のGlaを含む構造とを識別し、両者の構造の違いに依存して、その両者に対する反応性が異なる」ことを意味すると解釈したように、発明(抗体)が奏すべき効果を特定しているようでもあり、もし「効果を奏すべき発明であればそのような効果をもたらす(課題が解決若しくは目的達成される)」というトートロジーにすぎない発明の課題と解決手段の関係性なのだとしたら、サポート要件を判断するうえでそのような実体のない関係性を認定することは、サポート要件を形骸化することとなり、妥当ではないだろう。
前田健先生は、「奏すべき効果を特定する構成要件を含んいる場合、何が解決すべき課題で何がその解決手段かを把握することは簡単でない。」と述べておられる(参考: 前田 健 「対象物を新着眼の特性で特定したクレームの特許性 : 発見かそれとも発明か? : 機能的に表現された抗体の発明のサポート要件及び進歩性要件を題材として : 知財高判令和元年10月30日平成31年(ネ)第10014号〔PCSK9に対する抗原結合タンパク質〕」 神戸法学雑誌 Vol.70(1) p63-116 (2020))。
本件における「PIVKA-IIを特異的に結合する」との発明特定事項を有する本件発明において、前述の「技術的意味型」でいうところの「特許請求の範囲に記載された発明によって課題解決若しくは目的達成等が可能となる因果関係又はメカニズム」とは何と何との関係なのかは、もっと深く検討されるべきなのかもしれない。
(4)「抗原Xに結合する抗体クレイム」の実施可能要件
特許・実用新案審査ハンドブック 附属書B第2章 生物関連発明によると、
「抗体は、抗体が認識する抗原、交差反応性等により特定して記載することができる。特に、モノクローナル抗体の場合は、モノクローナル抗体が認識する抗原、モノクローナル抗体を産生するハイブリドーマ、交差反応性やモノクローナル抗体の CDR のアミノ酸配列等により特定して記載することができる。
例 1:抗原 A に対する抗体。
(注)抗原 A は物質として特定して記載されている必要がある。
例 2:抗原 A に反応し、抗原 B に反応しない抗体。
(注)抗原 A 及び抗原 B は物質として特定して記載されている必要がある。」
と説明されている(明確性要件(第 36 条第 6 項第 2 号))が、実施可能要件を充足する場合とそうでない場合については、事例を挙げて説明されている(事例27、29)。
特に、事例29において、【請求項 1】を「ウイルスYの表面抗原Pに対して解離定数:10-11M以上、10-10M以下で反応することを特徴とする、IgM型モノクローナル抗体。」とする実施可能要件に関して、
「一般に、限定的な条件を満たすモノクローナル抗体を産生するハイブリドーマを取得することは、再現性がない場合が多いとの技術常識がある。しかしながら、発明の詳細な説明には、ウイルスYの表面抗原Pのアミノ酸配列から、ある特定の部分アミノ酸配列を選択することによって、「ウイルスYの表面抗原Pに対して解離定数:10-11M以上、10-10M以下で反応する」という限定的な条件を満たすIgM型モノクローナル抗体を産生するハイブリドーマを複数株取得することができたことが記載されている。そうすると、当業者が追試をした時に、再現性をもって請求項1に係るモノクローナル抗体及びそれを産生するハイブリドーマを取得することができる。したがって、請求項1及び2に係る発明は、実施可能要件を満たしている。」
と説明されている。
これは、「再現性がない場合が多いとの技術常識」のもと、複数の例を取得できたことをもって再現性があるとみなし、実施可能要件を満たすとした仮想事例であるが、逆に、複数の例を取得できると明細書に記載されていたとしても、当業者は当該発明に含まれるだろう他の具体例を入手するために多大な試行錯誤を要する場合もあり得るだろうことには注意が必要であろう。
ましてや、本件は、結合相手(標的抗原又はエピトープ)との限定的な特異性を手掛かりにそのような抗体を入手したといえる実施例は一つのみであり、一つだけ取得できれば、あとはそのような特性を有する抗体を当業者が試行錯誤することなく取得できるといえるのかどうかはやや疑問である。
裁判所は、
「PIVKA-IIのアミノ酸1-17の配列を有するペプチドを免疫原として用いた一般的な製造方法により、所定の「抗原結合性部分」を有する「結合性タンパク質」(抗体)を調製すること、その抗体が、PIVKA-IIにおける6位及び/又は7位のGluを含む構造とプロトロンビンにおける6位及び7位のGlaを含む構造とを識別して反応性が異なることを利用して、従来の競合的又は非競合的イムノアッセイにより、生物学的試料中のPIVKA-IIの量を検出及び/又は定量するのに使用することやHCC又は肝癌の診断に使用することは、当業者が過度の負担なくなし得ることといえる」
と判断しているが、これはあくまでそのような抗体を産生するハイブリドーマを選別するスクリーニング方法を実施することは可能であること(入手手段の試行可能性)を述べているにすぎず、そのスクリーニング方法を実施することの先にある目的とする物の発明としての抗体を過度な負担なく入手できるのか(入手の実現可能性)、そしてどのような「構造上の特徴」を有する抗体なら実施可能なのかについて、判決文を読む限りにおいて実は深く検討していないように見える。
ここで、「抗原Xに結合する抗体クレイム」は実施可能要件を満たさないものとして全て否定すべき、と言いたいのではない。
「抗原Xに結合する抗体」は上記のように標的抗原を用いた一般的手法により容易に入手できるかもしれないが、その結合の性質や特徴をさらに限定することにより精緻を極めた優れた抗体発明になればなるほど、そのような優れた特性をさらに選別するために当業者はさらなる試行錯誤が必要とされるだろうし、そのような精緻さを要するさらなる工程についても当業者にとって試行錯誤を要するものなのか(過度な負担なのか)はさらに深く検討されるべきではないだろうか。
このような抗体の優れた特性について特定した発明の実施可能要件が争われた例として、例えば、「複数分子の抗原に繰り返し結合する抗原結合分子」事件(ブログ記事「2019.06.26 「アレクシオン v. 中外製薬」 知財高裁平成30年(行ケ)10043」参照)がある。
原告(アレクシオン)が当該発明をいわゆるリーチ・スルー・クレイムであると主張したのに対し、被告は発明が具体的な課題解決手段に基づくものであり可変領域へのヒスチジンの導入という配列の特徴によって特定しているからリーチ・スルー・クレイムとは異なると反論したが、裁判所は、発明がリーチ・スルー・クレイムかどうかという点には触れることなく、発明に含まれる医薬組成物の全体について実施できる程度に明細書の発明の詳細な説明の記載がされているかどうかを判断した。
複雑な抗体の特性について特定した抗体クレイムを許すことは、「スクリーニング方法によって得られる抗体」というような、構造上の特徴としては全く予測できない抗体のリーチ・スルー・クレイムを容認することに等しいのではないかという原告の主張は興味深い。
リーチ・スルー・クレイムについてまとめた論考として、井関涼子「上位概念で記載されたクレームと利用発明―選択発明・リーチスルークレーム―」 パテント Vol. 71 No. 11 (別冊 No.20), p157(2018) があり、「膨大な数の環状RAPペプチドを製造して34個のCR含有蛋白との結合親和性を調べるという,期待し得る程度を超える試行錯誤を要する」から「本願発明は実施可能要件を欠くものであ」ると判断した事件(ブログ記事「2016.09.21 「ラプトール ファーマシューティカル v. 特許庁長官」 知財高裁平成27年(行ケ)10188」参照)も挙げられている。

「スクリーニング工程により特定された物の発明(リーチ・スルー・クレーム)が特許にならないという低分子化合物分野における特許実務は,そのままバイオテクノロジーの他の分野に適用することは適切ではないと思われる」と論じた森田裕 「バイオ医薬等の新しい医薬モダリティを保護するための実践的特許戦略の考察」 日本知財学会誌 Vol.16 No.1, p31-40(2019)もある。

昨今の、技術常識レベルの発展や予測、試行錯誤レベルの改善を鑑みれば、現在の当業者の技術常識は昔と違うのかもしれない。当業者の技術常識レベルは日進月歩。技術の自動化、AIやビッグデータの活用が当たり前の時代となれば、過度な実験(undue experimentation)や試行錯誤(trial and error)の考え方、リーチ・スルー・クレイムの考え方も、自ずと変わってくるかもしれませんが・・・。
(5)「抗原Xに結合する抗体クレイム」を巡る米国での最近の判決
米国では、「抗原Xに結合する抗体クレイム」のような機能的に表現された抗体クレイムが実施可能要件が満たされるかどうかは、最近の下記判決から難しい方向に揺れている。

これら判決の内容に従えば、機能的に表現された抗体クレイムについては、仮にクレイムされた機能を満たす抗体の実施例が明細書に記載されていたとしても、それらの抗体がなぜその機能を果たすのか、一方で、機能を果たさない抗体はなぜその機能を果たせないのか、が記載されていなければ、クレイムされた機能を満たす実施例以外の抗体を特定するためのガイダンスとして明細書に提供されていることは、依然として明細書に記載されたスクリーニングプロセスをただ反復実施することに過ぎず、その結果、当業者にとってクレイムされた機能を満たす実施可能な抗体の特定が難しくなるという帰結に至りそうである。
別の言い方をすれば、米国では、構造的特徴で特定されていなければ抗体クレイムが実施可能要件をクリアすることは非常に困難な方向に揺れており、今後、機能的に表現された抗体クレイムについて実施可能要件をクリアする成功事例判決が出ない限り、この種の特許は実施可能要件違反により無効とされる可能性が常に潜在しているといえる。
機能的に表現された抗体クレイムの実施可能要件に関して、日本と米国の比較研究が待たれる。
(6)「抗原Xに結合する抗体クレイム」とEPO審査ガイドライン
本件訂正発明3がEuropean Patent Office(EPO)ではどのように判断されたかについては、前述のとおり、その欧州出願(EP2598534A1)は、審査の段階で補正等手続きはされたものの、その後renewal feeが支払われず、権利化が断念され、その審査攻防が見られることはなかった。
ところで、抗体クレイムに関連した話題として、2024年3月1日から、EPOの審査ガイドラインが更新されている。
- 2024.03.01 EPO news: Guidelines for Examination 2024 enter into force
- Guidelines for Examination in the European Patent Office
- Download EPC Guidelines (hyperlinked, showing modifications)
このガイドラインの更新には、抗体に関する発明(G-II, 6)に関連するいくつかの興味深い変更が盛り込まれている。
特に注目すべき変更点は、抗体の定義方法として「エピトープによる定義」を削除し、これを「標的抗原及びその他の機能的特徴による定義(Definition by target antigen and further functional features)」というセクション(G-II 6.1.3)に統合したことである。
この変更により、特定のエピトープに結合すると表現された抗体クレイムは、標的抗原及びその他の機能的特徴により表現された抗体クレイム(6.1.3)と同様に評価されることになった。
さらに、標的抗原及びその他の機能的特徴により表現された抗体クレイム(6.1.3)について、出願は、当業者が過度の負担をかけることなく、クレイムされた機能特性を有する抗体をさらに製造できるものでなければならないこと、さらに、機能的な定義は、当業者がクレームの範囲内で作業しているのか、範囲外で作業しているのかを容易かつ明確に確認できるものでなければならなず、したがって、クレイムには通常、機能特性を決定し定義するために使用される方法の関連する特性を含めるべきであることが求められている。
EPOの審査ガイドラインの更新は、抗体を定義する手法における近年の多様化に伴い、その審査判断の明確化への要望に応えたものであると捉えれることができる。
抗体クレイムの多様な表現手法とそれに対応した審査動向については今後も注視していく必要がありそうだ。
5.おわりに
本件(知財高裁令和4年(行ケ)10082)の裁判所の判断は、実施例が一つのみであっても、本件明細書等の記載及び特許出願当時の技術常識を踏まえて、機能的に表現された抗体クレイムが実施可能要件及びサポート要件を満たすものとして認められた実例であり、最近の抗体クレイムへの逆風となる判決が続いていた中において、機能的に表現された抗体クレイムの特許をいち早く取得することにより競争優位性を築きたいスタートアップを含む研究開発型企業やアカデミアにとってはグッドニュースかもしれない。
しかし、「抗原X(又はエピトープ)に結合する抗体」をさらに「特異的に認識して結合する」という特徴により限定された本件訂正発明3がサポート要件を満たす理由として、発明によって課題解決若しくは目的達成等が可能となる開示されるべき因果関係は何と何との関係なのか、その関係はトートロジーとなっていないかは、もっと深く検討されるべきだったのではないだろうか。
また、実施可能要件の判断においても、実施例は一つのみであり、一つだけ取得できれば、あとはそのような特性を有する抗体を当業者が試行錯誤することなく取得できるといえるのかどうかはやや疑問が残るものであり、抗体の入手手段の試行可能性についてよりも、むしろその入手手段を実施することの先にある目的とする物の発明としての抗体、特に「特異的に認識して結合する」という優れた特徴を有する抗体を過度な負担なく入手できるのか(入手の実現可能性)についてはもっと深く検討されるべきだったのではないだろうか。
抗体クレイムの多様な表現手法とそれに対応した判決や審査動向については今後も注視していく必要がありそうだ。


コメント