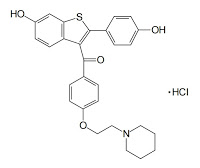
イーライリリーは、骨粗鬆症治療剤エビスタ®(一般名:ラロキシフェン塩酸塩(Raloxifene Hydrochloride)、選択的エストロゲン受容体モジュレーター(SERM))の用途特許(特許第2749247号)に関する特許庁の特許無効審決(2015.04.15 無効2013-800139)に対し、これを不服として、同審決の取り消しを求め、知財高裁へ審決取消訴訟を提訴しました。
沢井製薬が無効審判請求人であり、特許庁が本件特許を無効と判断した理由は進歩性の問題でした。
訂正発明1(請求項1):
ラロキシフェンまたはその薬学上許容し得る塩を活性成分として含む、ヒトの骨粗鬆症の治療または予防用医薬製剤であって、タモキシフェンより子宮癌のリスクの低い医薬製剤。
特許庁は、本件訂正発明1と引用発明との一致点を「ラロキシフェンまたはその薬学上許容し得る塩を活性成分として含む医薬製剤」、相違点のひとつを、本件訂正発明1は「タモキシフェンより子宮癌のリスクの低い」のに対し、引用発明はこの点についての記載がない点(相違点2)であると認定した上で、上記「タモキシフェンより子宮癌のリスクの低い」との記載は、単に、「ラロキシフェンまたはその薬学上許容し得る塩を活性成分として含む医薬製剤」が本来備えている性質を記載したものであると認められ、引用発明のラロキシフェンを活性成分として含む医薬製剤も、当然、備えている性質であると認められることから、この点で、本件訂正発明1が引用発明と異なる発明である、とすることはできないとするなど、本件訂正発明1は、引用発明および優先日における技術常識に基づいて、当業者が容易に発明をすることができたものであり、特許法第29条第2項の規定により特許を受けることができないと判断しました。
2015年8月17日付け沢井製薬のpress releaseによれば、エビスタ®錠60mgの後発品(ラロキシフェン塩酸塩錠 60mg「サワイ」)は承認され、本年12月に薬価収載し、販売を開始する予定とのことです。
とはいえ、知財高裁で審決が取り消され、特許が有効であるとの判断が下された場合には販売中止となる可能性もあり、知財高裁の判断を待たずに12月に薬価収載して販売に踏み切るのかどうか、状況を見守りたいと思います。
テバ、東和薬品も同特許に対して無効審判を請求していました(無効2013-800209(請求日2013.11.05、審判請求取下2014.07.16)、無効2014-800140(請求日2014.08.27))。
この用途特許の存続期間満了日は、5年の存続期間延長登録が認められたため、2018年7月28日となっています。
エビスタ®の2014年度の日本売上高は205億円(日本イーライリリー press release: 2015.04.08 「日本イーライリリー 2014年度 売上高は2,105億円を達成 ~対前年比売上7%増、既存製品好調で成長路線を継続~」)。2014年通年の「エビスタ」の世界全体での売上は、前年比 60%減の4億1,980万ドル、米国での売上は2014年3月にエビスタの特許期間が満了したために73%減の2億720万ドルとなっています(日本イーライリリー press release: 2015.02.10 「米国イーライリリー社、2014年第4四半期および通年の業績を報告」)。
参考:
- 日本イーライリリー press release: 2015.08.21 「骨粗鬆症治療剤エビスタ®用途特許に関する特許庁の特許無効審決に対する審決取消訴訟の提起について」
- 沢井製薬 press release: 2015.08.17 「ジェネリック医薬品 9 成分 17 品目の製造販売承認を取得」


コメント