フェブキソスタット結晶形特許の進歩性否定: 知財高裁平成29年(行ケ)10147
【背景】
原告(帝人)が保有する「2-(3-シアノ-4-イソブチルオキシフェニル)-4-メチル-5-チアゾールカルボン酸の結晶多形体およびその製造方法」に関する特許(第3547707号)に対して被告(日本ケミファ)が請求した無効審判において、無効とされた部分の審決(無効2016-800037号)を不服として原告が提起した審決取消訴訟。本件発明である結晶多形体(及びその製法)の進歩性(特許法29条2項、容易想到性判断)が争点。引用例は本件化合物の結晶である記載(一致点)にとどまり、X線粉末解析パターン等により具体的に特定する記載はなかった(相違点)。
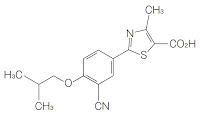
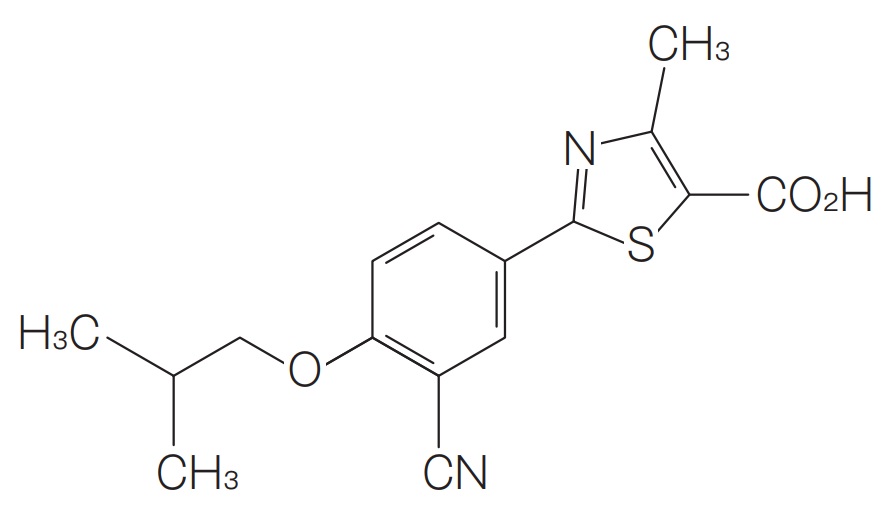
請求項3(本件発明3、C晶):
反射角度2θで表して,ほぼ6.62°,10.82°,13.36°,15.52°,16.74°,17.40°,18.00°,18.70°,20.16°,20.62°,21.90°,23.50°,24.78°,25.18°,34.08°,36.72°,および38.04°に特徴的なピークを有するX線粉末回折パターンを示す,2-(3-シアノ-4-イソブチルオキシフェニル)-4-メチル-5-チアゾールカルボン酸の結晶多形体。
【要旨】
裁判所は、本件各発明は引用発明等に基づき当業者が容易に発明をすることができたと認められるから、この点に関する本件審決の認定・判断に誤りはないと判断し、原告の請求を棄却した。以下、裁判所の判断の抜粋。
1.相違点について
「結晶多形が存在する医薬品においては,本件優先日当時の当業者の技術常識として,上記技術課題を解決するべく,再結晶条件につき検討を加えることでバイオアベイラビリティ(生体内での有用性),結晶状態における安定性及び製剤特性等の種々の要因を考慮して最適と思われる結晶形を探求し,これを得ようとすることは,当業者が当然に行うことということができる。そして,上記のとおり,本件化合物は,引用例1~3の記載により結晶多形の存在を認識し得る。
そうすると,引用発明1-1,2-1及び3の結晶について,当業者には,再結晶条件につき検討を加えることで,安定性や製剤化に優れる結晶多形体を得ることについての動機付けがあるということができる。さらに,本件優先日当時,結晶多形の存在はX線回折法,赤外吸収スペクトル法等により知ることができたのであるから,他の結晶多形体と識別するために,X線回折法パターンのピーク又は赤外吸収スペクトルの特徴的吸収で特定することにより,得られた結晶多形体を特定することも,格別の創意工夫を要するものではなかったということができる。
・・・したがって,引用発明2-1の本件化合物のエタノールを溶媒とする再結晶において,本件優先日当時の技術常識に基づいて再結晶条件を選定し,安定性に優れる結晶多形体,例えばC晶を得ることは,当業者が容易になし得たものというべきである。」
2.本件発明の効果について
「固体医薬品の大部分は結晶であり,多くの医薬品で結晶多形の存在が見出されていること,結晶多形を有する医薬品においては,結晶多形体ごとに種々の物性の違いがあるため,バイオアベイラビリティ(生体内での有用性),結晶状態における安定性及び製剤特性などの種々の要因を考慮して,最適な結晶形が選択されていることは,本件優先日当時の技術常識である。換言すれば,本件化合物を医薬品として用いようとする以上,医薬の承認のために必要な安定性を有することを追求することは当然のことであり,特別な課題とはいえない。また,本件優先日当時の技術常識を前提とした場合,本件各発明に係る結晶形により,従来の結晶よりも格段に優れた効果が示されたことをうかがわせる記載は,本件明細書には見当たらない。したがって,本件発明3及び8について,当業者が予測し得ない顕著な効果を奏するものということはできない。」
【コメント】
1.本件特許の製品保護意義について
本件化合物は、帝人(現・帝人ファーマ)が、1991年に発見した非プリン型選択的キサンチンオキシダーゼ阻害剤であるフェブキソスタット(febuxostat)、高尿酸血症治療剤フェブリク®錠(Feburic®tablet)(北米販売名はUloric®)の有効成分である。フェブリク®錠は、2011年1月21日に「痛風、高尿酸血症」の効能・効果で日本で製造販売承認された。
フェブリク®錠の医薬品インタビューフォーム(2016年5月第7版)によると、フェブリク®錠の再審査期間は、痛風、高尿酸血症については8年(2011年1月21日~2019年1月20日)、がん化学療法に伴う高尿酸血症については4年(2016年5月23日~2020年5月22日)となっているが、2018年7月27日付の薬事・食品衛生審議会医薬品第一部会議事録、2018年9月7日付の帝人プレスリリース「高尿酸血症・痛風治療剤「フェブリクⓇ」再審査期間延長の通知発出について」及び2018年11月5日付の帝人2018年度第2四半期決算説明会資料によると、フェブリク®錠の小児に対する用法・用量設定及び小児集団における有効性・安全性を把握する目的で治験を実施する必要があると認められ、国内再審査期間の2年間延長(2021年1月20日まで)が決定され、国内では2022年度前半まで後発品の参入は想定されないと発表されている。
J-PlatPatからの情報によると、2011年1月21日の製造販売承認(販売名「フェブリク®錠10, 20, 40mg」、有効成分「フェブキソスタット」、用途「痛風、高尿酸血病」)に基づき特許存続期間延長出願されたものは下記6件の特許のようである。本件特許(第3547707号)は、上記承認に基づいて5年間の存続期間延長登録(2011-700073(10mg); 2011-700098(20mg); 2011-700092(40mg))が認められていることから、フェブリク®錠を保護するものであり、その満了日は2024年6月18日となっていた。もし本件特許が有効に存続しつづけていたとしたら、本件特許発明の結晶形であるフェブキソスタットを有効成分とする後発品の参入時期を再審査期間(2021年1月20日後の後発品申請・承認を想定)を超えて2024年まで遅らせる効果が期待されていたと考えられる。下記延長登録した特許のうち本件特許以外で今だ現存している特許となると、製法特許(特許3202607)と製剤特許(特許4084309)である。しかし、製法特許(特許3202607)は再審査期間後の後発品承認想定時期より前に満了するため役に立たないと思われる。また、製剤特許(特許4084309)についても、そのクレームの構成要件の限定の多さからすると後発メーカーは当該特許範囲を回避した製剤で参入してくる可能性が高そうである(現時点で無効審判請求はされていない)。
特許2725886(物質特許)
- 延長登録出願2011-700069: 10mgで延長登録・・・満了日=出願日1991年11月29日+20年+延長5年=2016年11月29日・・・満了消滅
- 延長登録出願2011-700088: 40mgで延長登録・・・満了日=出願日1991年11月29日+20年+延長5年=2016年11月29日・・・満了消滅
- 延長登録出願2011-700094: 20mgで延長登録・・・満了日=出願日1991年11月29日+20年+延長5年=2016年11月29日・・・満了消滅
特許2834971(製法特許)
- 延長登録出願2011-700070: 10mgで延長登録・・・満了日=出願日1993年5月25日+20年+延長5年=2018年5月25日・・・満了消滅
- 延長登録出願2011-700089: 40mgで延長登録・・・満了日=出願日1993年5月25日+20年+延長5年=2018年5月25日・・・満了消滅
- 延長登録出願2011-700095: 20mgで延長登録・・・満了日=出願日1993年5月25日+20年+延長5年=2018年5月25日・・・満了消滅
特許2706037(製法特許)
- 延長登録出願2011-700071: 延長出願は拒絶査定・・・満了日=出願日1993年8月24日+20年+延長0年=2013年8月24日・・・満了消滅
- 延長登録出願2011-700090: 延長出願は拒絶査定・・・満了日=出願日1993年8月24日+20年+延長0年=2013年8月24日・・・満了消滅
- 延長登録出願2011-700096: 延長出願は拒絶査定・・・満了日=出願日1993年8月24日+20年+延長0年=2013年8月24日・・・満了消滅
特許3202607(製法特許)
- 延長登録出願2011-700072: 10mgで延長登録・・・満了日=出願日1996年8月1日+20年+延長5年=2021年8月1日・・・無効審判請求されていない
- 延長登録出願2011-700091: 40mgで延長登録・・・満了日=出願日1996年8月1日+20年+延長5年=2021年8月1日・・・無効審判請求されていない
- 延長登録出願2011-700097: 40mgで延長登録・・・満了日=出願日1996年8月1日+20年+延長5年=2021年8月1日・・・無効審判請求されていない
特許3547707(結晶特許)
- 延長登録出願2011-700073: 10mgで延長登録・・・満了日=出願日1999年6月18日+20年+延長5年=2024年6月18日・・・本判決で特許無効審決維持
- 延長登録出願2011-700092: 40mgで延長登録・・・満了日=出願日1999年6月18日+20年+延長5年=2024年6月18日・・・本判決で特許無効審決維持
- 延長登録出願2011-700098: 20mgで延長登録・・・満了日=出願日1999年6月18日+20年+延長5年=2024年6月18日・・・本判決で特許無効審決維持
特許4084309(製剤特許)
- 延長登録出願2011-700074: 10mgで延長登録・・・満了日=出願日2003年3月28日+20年+延長2年10月29日=2026年2月・・・無効審判請求されていない
- 延長登録出願2011-700093: 40mgで延長登録・・・満了日=出願日2003年3月28日+20年+延長2年10月29日=2026年2月・・・無効審判請求されていない
- 延長登録出願2011-700099: 20mgで延長登録・・・満了日=出願日2003年3月28日+20年+延長2年10月29日=2026年2月・・・無効審判請求されていない
2016年5月23日の効能・効果の追加及び用法・用量の追加(がん化学療法に伴う高尿酸血症(通常、成人にはフェブキソスタットとして60mgを1日1回経口投与する。))による製造販売一部変更承認に基づき特許存続期間延長登録されているものは下記の通り。下記用途特許(特許5907396)が有効に存続し続ければ、その間、「がん化学療法に伴う高尿酸血症」の効能効果部分については後発品の参入は阻止できると思われる。
特許4084309(製剤特許)
- 延長登録出願2016-700215: 10mgで延長登録・・・満了日=出願日2003年3月28日+20年+延長3年7月15日=2026年11月12日・・・無効審判請求されていない
- 延長登録出願2016-700216: 20mgで延長登録・・・満了日=出願日2003年3月28日+20年+延長3年7月15日=2026年11月12日・・・無効審判請求されていない
- 延長登録出願2016-700217: 40mgで延長登録・・・満了日=出願日2003年3月28日+20年+延長3年7月15日=2026年11月12日・・・無効審判請求されていない
特許5907396(用途特許)
- 延長登録出願2016-700218: 10mgで延長登録・・・満了日=出願日2013年10月22日+20年+延長1月21日=2033年12月13日・・・無効審判請求されていない
- 延長登録出願2016-700219: 20mgで延長登録・・・満了日=出願日2013年10月22日+20年+延長1月21日=2033年12月13日・・・無効審判請求されていない
- 延長登録出願2016-700220: 40mgで延長登録・・・満了日=出願日2013年10月22日+20年+延長1月21日=2033年12月13日・・・無効審判請求されていない
2.結晶形に関する発明の進歩性判断について
公知化合物の新規結晶形の発明の進歩性のハードルは、技術常識も医薬品開発における動機づけもそれぞれ一定程度存在することから、相当高い。一般に、有効成分の新規結晶形の出願は、医薬品の製品保護期間を確保するために確実に期待できるものではなくなってきており、下記のとおり、公知の医薬有効成分の新たな結晶形に関する発明の進歩性が争われた過去事例ではいずれも進歩性は否定されている。
- 2017.02.14 「ナンジン キャベンディッシュ v. 特許庁長官」 知財高裁平成28年(行ケ)10112(進歩性を否定)
- 2012.12.05 「サンド v. ワーナー-ランバート」 知財高裁平成23年(行ケ)10445(進歩性を否定)
- 2007.07.04 「メルク v. 特許庁長官」 知財高裁平成18年(行ケ)10271(進歩性を否定)
本件出願の審査が行われ、特許査定となった時期は、2004年頃であり、上記過去判決のように結晶形の進歩性が否定される流れが出てくる前であった。新規結晶形の出願は、日本においては、製品保護期間確保という積極的役割よりも、後発品メーカー含めた競合他社に万が一にも特許を取られてしまい紛争の火種(FTOの問題)を残すのを排するためという消極的役割の方がより現実的な意義付けといえるのかもしれない。
本件特許に相当する欧米出願では、米国(US6225474)でも欧州(EP1020454)でも特許となっている。米国特許はFebuxostatのorangebookに収載されており、欧州特許は異議申立てされ、補正の結果、維持決定となった模様である。


コメント