1.はじめに
2月最終日はRare Disease Day (世界希少・難治性疾患の日)です。
うるう年の2月29日が「rare(希少)」な日であることにちなんで、毎年2月最終日をRare Disease Day(RDD)として、より良い診断や治療による希少・難治性疾患の患者さんの生活の質の向上を目指して始まった活動で、多くの国でRDDが開催されています。


RDDに賛同し、希少・難治性疾患の認知度向上に陰ながら応援したいと思いまして、製薬業界において知的財産を扱う立場から、「希少疾病用医薬品(本記事では「オーファンドラッグ」と呼ぶ場合がある)」をテーマに、
- 日本で承認された希少疾病用医薬品の販売名の由来
- 希少疾病用医薬品へのアクセスについて
- 2022年に米国で承認されたオーファンドラッグ
についての話題を発信したいと思います。
2.日本で承認された希少疾病用医薬品とその名称の由来
患者数が少ない疾患の総称である希少疾患(Rare disease)または希少疾患の治療薬(「オーファンドラッグ」とも呼ばれる)の定義は各国様々ですが、日本では、希少疾病用医薬品・希少疾病用医療機器・希少疾病用再生医療等製品は、医薬品医療機器法第77条の2に基づき、対象患者数が本邦において5万人未満であること、医療上特にその必要性が高いものなどの条件に合致するものとして、薬事・食品衛生審議会の意見を聴いて厚生労働大臣が指定するものです(厚生労働省ホームページ: 希少疾病用医薬品・希少疾病用医療機器・希少疾病用再生医療等製品の指定制度の概要)。
2022年に、独立行政法人医薬品医療機器総合機構(PMDA)の審査及び薬事・食品衛生審議会での審議又は報告を経て、厚生労働大臣によって承認された希少疾病用医薬品について、その販売名の由来を以下の表にまとめました。
| 承認日 | 販売名 | 承認 | 成分名 | 効能・効果等 | 販売名の由来 |
|---|---|---|---|---|---|
| 12/23 | ネキソブリッド外用ゲル5 g | 承認 | パイナップル茎搾汁精製物 | 深達性II度又はIII度熱傷における壊死組織の除去を効能・効果とする新有効成分含有医薬品 | 次世代の(Next)壊死組織除去(Debridement)。 |
| 12/23 | ガラフォルドカプセル123 mg | 一変 | ミガーラスタット塩酸塩 | ミガーラスタットに反応性のあるGLA遺伝子変異を伴うファブリー病を効能・効果とし、小児用量を追加する新用量医薬品 | α-Gal酵素の折りたたみ(fold)構造を矯正するという本剤のメカニズムに由来している。 |
| 12/23 | タバリス錠100 mg 同 錠150 mg | 承認 | ホスタマチニブナトリウム水和物 | 慢性特発性血小板減少性紫斑病を効能・効果とする新有効成分含有医薬品 | 特になし。 |
| 12/23 | イミフィンジ点滴静注120 mg 同 点滴静注500 mg | 一変 | デュルバルマブ(遺伝子組換え) | 治癒切除不能な胆道癌を効能・効果とする新効能・新用量医薬品 | infinity(無限)とimmunotherapy(免疫療法)の頭文字〔IM〕を含む造語。 |
| 12/23 | イムブルビカカプセル140 mg | 一変 | イブルチニブ | 原発性マクログロブリン血症及びリンパ形質細胞リンパ腫を効能・効果とする新効能医薬品 | Bruton’s tyrosine kinase(ブルトン型チロシンキナーゼ)を阻害するmechanism(機序)により症状をimprove(改善)する薬剤という、薬剤の特徴を示すものとして命名。 |
| 9/26 | コセルゴカプセル10mg 同 カプセル25mg | 承認 | セルメチニブ硫酸塩 | 神経線維腫症1型における叢状神経線維腫を効能・効果とする新有効成分含有医薬品 | Koselugo の selu はセルメチニブを由来として命名している。 |
| 9/26 | アムヴトラ皮下注25mgシリンジ | 承認 | ブトリシランナトリウム | トランスサイレチン型家族性アミロイドポリニューロパチーを効能・効果とする新有効成分含有医薬品 | アムヴトラ(Amvuttra)の名称は、Am[アミロイドーシス(Amyloidosis)との関連性]、vut[有効成分であるブトリシラン(vutrisiran)]、ttr[疾患の原因となるトランスサイレチン(TTR)との関連性]に由来する。 |
| 9/26 | フィンテプラ内用液2.2mg/mL | 承認 | フェンフルラミン塩酸塩 | 他の抗てんかん薬で十分な効果が認められないDravet症候群患者におけるてんかん発作に対する抗てんかん薬との併用療法を効能・効果とする新有効成分含有医薬品 | 特になし。 |
| 9/26 | カブリビ注射用10mg | 承認 | カプラシズマブ(遺伝子組換え) | 後天性血栓性血小板減少性紫斑病を効能・効果とする新有効成分含有医薬品 | 特になし。 |
| 9/26 | ベリナート皮下注用2000 | 承認 | 人C1-インアクチベーター | 遺伝性血管性浮腫の急性発作の発症抑制を効能・効果とする新投与経路医薬品 | Berinertは、Behringwerke社(社名)とinert(= inactive→C1-inactivator)に由来する。 |
| 9/26 | エザルミア錠50mg 同 錠100mg | 承認 | バレメトスタットトシル酸塩 | 再発又は難治性の成人T細胞白血病リンパ腫を効能・効果とする新有効成分含有医薬品 | 作用標的部位 EZH1/2 と harmony(ハーモニー)に由来する。 |
| 8/24 | フィラジル皮下注30 mgシリンジ | 一変 | イカチバント酢酸塩 | 遺伝性血管性浮腫の急性発作を効能・効果とし、小児用量を追加する新用量医薬品 | 海外(FIRAZYR)に準じた。 |
| 8/24 | リムパーザ錠100 mg 同 錠150 mg | 一変 | オラパリブ | BRCA遺伝子変異陽性かつHER2陰性で再発高リスクの乳癌における術後薬物療法を効能・効果とする新効能・新用量医薬品 | 特になし。 |
| 8/24 | ポライビー点滴静注用30 mg 同 点滴静注用140 mg | 一変 | ポラツズマブ ベドチン(遺伝子組換え) | びまん性大細胞型B細胞リンパ腫を効能・効果とする新効能・新用量医薬品 | POLIVY:Polatuzumab vedotin、Life、antibody-drug conjugate に由来する。 |
| 6/20 | エジャイモ点滴静注1.1g | 承認 | スチムリマブ(遺伝子組換え) | 寒冷凝集素症を効能・効果とする新有効成分含有医薬品 | 寒冷凝集素症(cold agglutinin disease:CAD)患者さんがより充実した人生を過ごせるよう願いを込め、Enjoy more を変化させ、ENJAYMO とした。 |
| 6/20 | ボックスゾゴ皮下注用0.4mg 同 皮下注用0.56mg 同 皮下注用1.2mg | 承認 | ボソリチド(遺伝子組換え) | 骨端線閉鎖を伴わない軟骨無形成症を効能・効果とする新有効成分含有医薬品 | VOX(VOはVOsoritideより、またVOXはラテン語で「声」を意味する)+ZO(接続)+GO(英語のGO)に由来する。 |
| 6/20 | リツキサン点滴静注100mg 同 点滴静注500mg | 一変 | リツキシマブ(遺伝子組換え) | 視神経脊髄炎スペクトラム障害(視神経脊髄炎を含む)の再発予防を効能・効果とする新効能・新用量医薬品 | 有効成分である rituximab より命名。 |
| 6/20 | ヘムライブラ皮下注30㎎ 同 皮下注60㎎ 同 皮下注90㎎ 同 皮下注105㎎ 同 皮下注150㎎ | 一変 | エミシズマブ(遺伝子組換え) | 後天性血友病A患者における出血傾向の抑制を効能・効果とする新効能・新用量医薬品 | HEMophilia+LIBRA(バランスを意味する)/LIBerty(解放)に由来する。 |
| 5/26 | アドセトリス点滴静注用50mg | 一変 | ブレンツキシマブ ベドチン(遺伝子組換え) | CD30陽性のホジキンリンパ腫を効能・効果とし、小児用量を追加する新用量医薬品 | アドセトリス(ADCetris)は、標的とする腫瘍細胞内に直接、薬物を送り込むことを可能にした薬剤である抗体薬物複合体の略である「ADC(Antibody-Drug Conjugate)」と、アドセトリスを構成する抗体、薬物、これらを結ぶリンカーの3部位の3、またCD30など3を意味する「tris」を由来としている。 |
| 5/31 | ①ボカブリア水懸筋注400mg ②同 水懸筋注600mg ③同 錠30mg ④リカムビス水懸筋注600mg ⑤同 水懸筋注900mg | 承認 | ①②カボテグラビル ③カボテグラビルナトリウム ④⑤リルピビリン | HIV-1感染症を効能・効果とする新有効成分含有医薬品 | 特になし。 |
| 3/28 | セムブリックス錠20 mg 同 錠40 mg | 承認 | アシミニブ塩酸塩 | 前治療薬に抵抗性又は不耐容の慢性骨髄性白血病を効能・効果とする新有効成分含有医薬品 | 特になし。 |
| 3/28 | ゼンフォザイム点滴静注用20 mg | 承認 | オリプダーゼ アルファ(遺伝子組換え) | 酸性スフィンゴミエリナーゼ欠損症を効能・効果とする新有効成分含有医薬品 | 特になし。 |
| 3/28 | ユニタルク胸膜腔内注入用懸濁剤4 g | 一変 | タルク | 外科手術による治療が困難な続発性難治性気胸を効能・効果とする新効能医薬品 | 粒子の大きさを揃えたタルク(Uniform+talc)に由来。 |
| 3/28 | タクザイロ皮下注300 mgシリンジ | 承認 | ラナデルマブ(遺伝子組換え) | 遺伝性血管性浮腫の急性発作の発症抑制を効能・効果とする新有効成分含有医薬品 | 海外(TAKHZYRO)に準じた。 |
| 3/28 | スピンラザ髄注12 mg | 一変 | ヌシネルセンナトリウム | 臨床所見は発現していないが遺伝子検査により発症が予測される脊髄性筋萎縮症を効能・効果とする新効能医薬品 | 不明。 |
| 3/28 | オンデキサ静注用200 mg | 承認 | アンデキサネット アルファ(遺伝子組換え) | 直接作用型第Xa因子阻害剤(アピキサバン、リバーロキサバン又はエドキサバントシル酸塩水和物)投与中の患者における、生命を脅かす出血又は止血困難な出血の発現時の抗凝固作用の中和を効能・効果とする新有効成分含有医薬品 | 特になし。 |
| 2/25 | レットヴィモカプセル40 mg 同 カプセル80 mg | 一変 | セルペルカチニブ | RET 融合遺伝子陽性の根治切除不能な甲状腺癌、RET 遺伝子変異陽性の根治切除不能な甲状腺髄様癌を効能・効果とする新効能・新用量医薬品 | 不明。 |
| 1/20 | ルマケラス錠120 mg | 承認 | ソトラシブ | がん化学療法後に増悪したKRAS G12C変異陽性の切除不能な進行・再発の非小細胞肺癌を効能・効果とする新有効成分含有医薬品 | LUMA(ラテン語で「光」や「明るさ」を意味する語源を持ち、明確な道筋を照らすことを意味する) KRAS(NSCLCに認められる変異の1つであるKRAS G12C変異を標的とすることを意味する) |
| 1/20 | ウィフガート点滴静注400 mg | 承認 | エフガルチギモド アルファ(遺伝子組換 え) | 全身型重症筋無力症(ステロイド剤又はステロイド剤以外の免疫抑制剤が十分に奏効しない場合に限る)を効能・効果とする新有効成分含有医薬品 | 海外における販売名「VYVGART」に準じた。 |
| 1/20 | メプセヴィ点滴静注液10 mg | 承認 | ベストロニダーゼ アルファ(遺伝子組換え) | ムコ多糖症VII型を効能・効果とする新有効成分含有医薬品 | 特になし。 |
一般名(有効成分名)は、世界保健機関(WHO)に医薬品国際一般名称(International Nonproprietary Name:INN)として、日本では厚生労働省に医薬品一般的名称(Japanese Accepted Names for Pharmaceuticals:JAN)として登録され、何人も自由に使用できる名称です。
他方で、商標登録を受けた販売名は、商標権者が独占的に使用することができる商標で、その商標が製品を識別するとともに、製品の品質を保証する機能等も発揮することによって、製品のブランド価値が高まることになります。
各医薬品の販売名の由来を知ると、今まで覚えづらく意味不明な文字の羅列にしか見えなかった販売名が、その医薬品を創出した製薬企業の熱い思いや込められた意味合いを観念したものとして親しみを感じられるようになりませんか。

個人的には、「エジャイモ」のネーミングが気に入っています。
皆さんはどの医薬品の名称に興味を持ちましたか。
3.希少疾病用医薬品へのアクセスについて
日本では、患者数が少ないことにより十分に進んでいなかった希少疾病用医薬品の開発状況を踏まえ、その研究開発を促進するための特別支援措置等が創設されてきました。
しかし、医薬産業政策研究所の報告(「ドラッグ・ラグ:未承認薬は日本のアンメット・メディカルニーズに応えうるか?」政策研ニュース No.66(2022年7月))によると、欧米で承認され日本では承認されていない、いわゆる国内未承認薬の数及びその比率は増加しつづけており、2020年末時点における直近5年間の国内未承認薬は176品目(新有効成分含有医薬品)ありますが、そのうち、欧米でオーファン指定(希少疾患の治療薬として指定)を受けている製品が90品目も占めています。
今後もマイナス成長が見込まれている日本市場の世界における位置づけが変化していること、薬価制度の頻回の見直しという日本独自の制度が日本での医薬品ビジネスの予見性を低下させていること、臨床試験や薬事制度などの開発環境の問題といった要因が複合的に絡み合い、日本の医薬品市場の魅力が低下しているとの声もあります。
- 2023.02.16 日本製薬工業協会 news release: 製薬協 政策提言2023 (PDF)
上記のとおり、日本での希少疾病用医薬品の新薬承認は欧米での承認からかなり遅れての承認(「ドラッグ・ラグ」)か、開発されず未承認のまま(「ドラッグ・ロス」)となっており、アンケート調査からも、企業からは希少疾病用医薬品の開発への優遇措置が早期に受けられにくいこと、また患者さんからは日本での治療薬へのアクセスの無さや選択肢が限られていることが指摘されています。
- 2017年3月 医薬産業政策研究所: 日本の希少疾病用医薬品の指定要件の現状に関する研究 製薬企業に対するアンケート調査にもとづく検討
- 2023.02.09 製薬協: 希少疾患患者さんの困りごとに関する調査
それでも新薬を待ち望む患者さんやご家族は治療薬の日本導入に対して強い期待を持っています。
製薬業界は関連するステークホルダーと連携し、治療薬の研究開発環境を整備するとともに、海外の治験データを活用して治療薬を承認し、患者さん自身が治療薬を選択できる環境を整備する等、希少疾患の患者さんの治療薬へのアクセスを確保する柔軟な仕組みの整備を検討すべきであること、そして、一日も早く革新的な治療薬を患者さんやご家族に届けられるよう引き続き尽力していくことを、製薬協は報告書の中で宣言しています。
- 2023.02.09 製薬協: 希少疾患患者さんの困りごとに関する調査(全文)

国内未承認薬が増加し続けている原因は何か。製薬企業が日本で開発を後回しにするのは何故か。日本政府には国内での新薬開発を促進させる抜本的なインセンティブ施策を検討してほしい。
4.2022年、米国で承認されたオーファンドラッグ
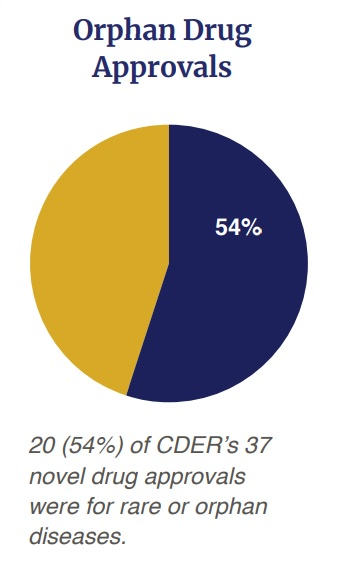 米国食品医薬品局(FDA)医薬品評価研究センター(Center for Drug Evaluation and Research; CDER)が発表した年次報告書「Advancing Health Through Innovation: New Drug Therapy Approvals 2022」(PDF)によると、2022年、新薬承認申請(NDA)に基づく新規低分子化合物(NME)または生物学的製剤承認申請(BLA)に基づく新規生物学的製剤としてCDERが承認した新薬は37件であり、そのうち20件(54%)が、希少疾患(米国では200,000人未満が罹患する疾患)の治療のために承認されたものであったことを伝えています。
米国食品医薬品局(FDA)医薬品評価研究センター(Center for Drug Evaluation and Research; CDER)が発表した年次報告書「Advancing Health Through Innovation: New Drug Therapy Approvals 2022」(PDF)によると、2022年、新薬承認申請(NDA)に基づく新規低分子化合物(NME)または生物学的製剤承認申請(BLA)に基づく新規生物学的製剤としてCDERが承認した新薬は37件であり、そのうち20件(54%)が、希少疾患(米国では200,000人未満が罹患する疾患)の治療のために承認されたものであったことを伝えています。
具体的には、Amvuttra、Camzyos、Elahere、Enjaymo、Imjudo、Kimmtrak、Krazati、Lunsumio、Lytgobi、NexoBrid、Opdualag、Pyrukynd、Relyvrio、Rezlidhia、Spevigo、Tecvayli、Terlivaz、Vonjo、Xenpozyme、Ztalmyが、希少疾患の治療薬(オーファンドラッグ)として承認されました。
例えば、Amvuttra(日本販売名:アムヴトラ)、Enjaymo(日本販売名:エジャイモ)、NexoBrid(日本販売名:ネキソブリッド)、Xenpozyme(日本販売名:ゼンフォザイム)は、日本でも希少疾病用医薬品として承認(Spevigo(日本販売名:スペビゴ)は希少疾病用医薬品ではなく承認)に至っていますが、それら以外の米国で承認されたオーファンドラッグは未だ日本では承認されていません。

一刻も早く日本での開発が進んで、適切な審査を経て承認されて、患者さんのもとに届けられることを願います。
5.おわりに
製薬業界の立場から、日本で承認された希少疾病用医薬品の販売名の由来、希少疾病用医薬品へのアクセスの課題、2022年に米国で承認されたオーファンドラッグについて紹介しました。
「エジャイモ」のネーミングの由来に込められた願いのように、「患者さんがより充実した人生を過ごせるよう」に、製薬業界は一日も早く革新的な治療薬を患者さんやご家族に届けられるよう尽力し続けること、そして、日本における医薬品のアクセス課題である「ドラッグ・ラグ」、「ドラッグ・ロス」が少しでも改善されるような抜本的な政策が望まれます。
テーマは希少疾病用医薬品(オーファンドラッグ)でしたが、この記事をRare Disease Dayに向けて投稿することで、希少・難治性疾患の認知度の向上というRare Disease Day(RDD)の活動に微力ですが一助となれば幸いです。




コメント