ナゾネックス®点鼻液 モメタゾンフロエート水性懸濁液を含有する1日1回鼻腔内投与されるアレルギー性鼻炎治療薬の進歩性判断とオーソライズド・ジェネリック戦略: 知財高裁平成31年(行ケ)10006(第1事件); 知財高裁平成31年(行ケ)10058(第2事件)
【背景】
 メルク・シャープ・アンド・ドームが保有する「気道流路および肺疾患の処置のためのモメタゾンフロエートの使用」に関する特許(第3480736号)に対して東興薬品工業がした無効審判請求(杏林製薬は同審判に被請求人側に参加)を認容した審決(無効2015-800166)の取消訴訟。
メルク・シャープ・アンド・ドームが保有する「気道流路および肺疾患の処置のためのモメタゾンフロエートの使用」に関する特許(第3480736号)に対して東興薬品工業がした無効審判請求(杏林製薬は同審判に被請求人側に参加)を認容した審決(無効2015-800166)の取消訴訟。
本件特許(第3480736号)については、別途先行して審理されていた無効審判請求不成立審決(無効2014-800055号事件)に対し知財高裁において審決取消しの判決(2016.03.30 「東和薬品 v. メルク シャープ アンド ドーム」 知財高裁平成27年(行ケ)10054)があり、同判決についての上告審の結果が出るまで、東興薬品工業が請求していた本件無効審判(無効2015-800166号事件)の審理は手続中止されていた。
上記判決(2016.03.30 「東和薬品 v. メルク シャープ アンド ドーム」 知財高裁平成27年(行ケ)10054)については上告棄却及び上告受理申立不受理の決定を経て、特許庁でさらに審理され、請求項1~3に係る発明についての特許を無効とすることの審決予告(2018年1月18日)がなされたが、東和薬品が2018年2月13日に審判請求を取下げたことで当該事件は無効審決に至らず確定した。東興薬品工業は、東和薬品が上記事件で特許無効を確定してくれるだろうと期待していたに違いない。審判請求取下げを知った東興薬品工業は2月19日付で参加申請書を提出したが、特許庁は審判請求取下げ後のためその申請書を返戻した。
こうして翌3月に東興薬品工業が請求した本件審判事件の審理が再開された。審決は、本件発明の構成については容易に想到することができ、効果も当業者が容易に予測できたものであるから、本件発明は進歩性を欠如するというものだった。
請求項1(本件発明1):
モメタゾンフロエートの水性懸濁液を含有する薬剤であって,1日1回鼻腔内に投与される,アレルギー性または季節性アレルギー性鼻炎の治療のための薬剤。
請求項2(本件発明2):
前記1日1回の投与量が100~200マイクログラムであり,未変化のモメタゾンフロエートの絶対的バイオアベイラビリティが約1パーセント未満である,請求項1に記載の薬剤。
【要旨】
裁判所は、原告ら(杏林製薬、メルク・シャープ・アンド・ドーム)の請求を棄却した。
1.鼻の炎症状態を「アレルギー性または季節性アレルギー性鼻炎」とすることへの容易想到性について
「甲1発明は,炎症状態を治療するための,モメタゾンフロエート一水和物の鼻腔投与用水性懸濁液であるところ,甲2文献には,・・・モメタゾンフロエートがアレルギー性鼻炎の鼻腔内吸入による治療のための有望な新薬候補であることが記載され,治療の対象としてアレルギー性鼻炎の記載があるといえる。そして,甲1文献と甲2文献には,いずれも局所活性ステロイドであるモメタゾンフロエートを鼻腔内に投与することが記載されていると認められるところ,鼻の炎症には, 急性鼻炎・慢性鼻炎等のほかアレルギー性鼻炎や季節性アレルギー性鼻炎が含まれる(弁論の全趣旨)ことをも考慮すれば,甲1発明の治療の対象である「炎症状態」を,「アレルギー性または季節性アレルギー性鼻炎」とすることは,当業者が容易に想到し得たものといえる。したがって,甲1発明において,相違点2(治療の対象である炎症状態につき,本件発明1では「アレルギー性または季節性アレルギー性鼻炎」と特定されているのに対し,甲1発明では特定されていない点。)に係る構成を採用することは,当業者が容易に想到し得たといえる。」
2.1日1回投与の用法を選択することへの容易想到性について
「本件優先日当時,モメタゾンフロエートを含有する鼻腔内投与剤の用法・用量について公知のものはないところ,モメタゾンフロエート一水和物の鼻腔投与用水性懸濁液を用いて炎症状態を治療する場合に,その薬理効果や副作用等を考慮し,他の局所活性ステロイドの鼻腔内投与における投与回数及び投与量を参考にして,モメタゾンフロエートにとって最適な投与回数及び投与量を設定することは,製薬分野の当業者にとって通常のことであったということができる。・・・また,・・・本件優先日当時,鼻腔内投与される局所活性ステロイド薬には,1日1~4回の用法が存在し,患者の好みやコンプライアンスの観点から,1日1回の投与が利点を有することは周知であった。・・・以上によれば,甲1発明の,「炎症状態を治療するための,モメタゾンフロエート一水和物の鼻腔投与用水性懸濁液」について,モメタゾンフロエートの薬理効果や副作用等を考慮して,鼻腔内に投与される局所活性ステロイド薬の用法として最適とされていた,1日1回投与の用法を選択することは,当業者が容易に想到し得たものといえる。したがって,甲1発明において,相違点1(薬剤の用法・用量につき,本件発明1では「1日1回」と特定されているのに対し,甲1発明では特定されていない点。)に係る構成を採用することは,当業者が容易に想到し得たといえる。」
3.モメタゾンフロエートの1日当たりの用量として100~200マイクログラムを選択することへの容易想到性について
「モメタゾンフロエートの薬理効果や副作用等を考慮し,他の局所活性ステロイドの鼻腔内投与における投与量を参考にして,モメタゾンフロエートにとって最適な投与量を設定することは製薬分野の当業者にとって通常のことである。・・・そして,本件優先日当時,モメタゾンフロエートは極めて強い局所抗炎症作用を示す一方,副作用は弱く,主作用と副作用の乖離が大きい局所活性ステロイドであることが技術常識として知られていたから,上記の鼻腔内に投与される他の局所活性ステロイドについて200~440μg/日といったオーダーの用量が用いられているといった情報を参考にしつつ,モメタゾンフロエートの1日当たりの用量としてそれより低い100~200マイクログラムを選択することは,当業者が容易に想到し得たものといえる。したがって,甲1発明において,相違点3-1(本件発明2では「前記1日1回の投与量が100~200マイクログラムである」とされるのに対し,甲1発明ではその特定がない点。)に係る構成を採用することは,当業者が容易に想到し得たものといえる。」
4.「未変化のモメタゾンフロエートの絶対的バイオアベイラビリティが約1パーセント未満である」は、甲1発明に現れる客観的な性質(備わった構成)であるので実質的な相違点ではない
「絶対的バイオアベイラビリティとは,血管内投与以外の投与経路(例えば鼻腔内投与)で得られる血漿中濃度曲線下面積と,静脈注射時の血漿中濃度曲線下面積とを比較することにより得られる割合であるから,投与した薬物の量や濃度には依存しないものといえる。そうすると,「未変化のモメタゾンフロエートの絶対的バイオアベイラビリティが約1パーセント未満」は,モメタゾンフロエートの水性懸濁液を含有する薬剤を鼻腔内に投与した場合に現れる客観的な性質であって,甲1発明が備えた構成でもあると推認でき,これを否定する証拠もない。したがって,相違点3-2は,実質的な相違点であるとはいえない。」
5.優先日当時の技術常識に基づき予測できた範囲について
「本件優先日当時の当業者は,技術常識並びに甲1文献及び甲2文献の上記記載により,副作用が低いモメタゾンフロエートの鼻腔投与用水性懸濁液につき,皮膚への局所投与と鼻腔への局所投与により薬物動態等の相違があるとしても,1日1回の鼻腔内投与でアレルギー性鼻炎に治療効果を有し,全身への吸収が低く,バイオアベイラビリティが優れていることも,予測できた範囲のものと認められる。以上によれば,本件優先日当時の当業者は,本件発明の構成について,「アレルギー性鼻炎に対して,1日1回の鼻腔内投与で,プラセボとの対比において治療効果があり,かつ,モメタゾンフロエートのバイオアベイラビリティが低く,血流中への全身的な吸収が実質的に存在せず,全身性副作用が存在しない」という効果について,予測することができたというべきである。そして,「バイオアベイラビリティが約1%未満である」との数値についても,その程度が,本件優先日当時の技術常識に基づき予測できた範囲を超える顕著なものであることを認めるに足りる的確な証拠はない。・・・第1事件原告は,本件発明が1日1回投与と1日2回投与とで効能に有意な差がなく,ステロイド点鼻薬として本件優先日当時に望み得る,最も高いレベルの作用・効能の持続的効果を奏すること,また,非常に低いバイオアベイラビリティでありながら,本件発明が上記効果を奏することは,本件優先日当時驚くべきことであり,それ自体,本件発明の顕著な効果であると主張する。しかし,・・・そもそも本件発明の構成によれば,1日1回の投与によって有効な治療効果をあげられることが予測し得たことは上記(2)で認定したとおりなのであるから,それ以上に,1日1回の投与と1日2回の投与の効果を比較することに意味があるとは考えられず,これを予測し得ない効果の根拠とすることはできない。」
【コメント】
1.効果の顕著性
進歩性において主張する顕著な効果は、そもそも予測できた範囲のものであるのか、それを超える顕著なものであるのか、優先日当時の技術常識に基づき判断されるので、技術常識の把握と明細書に示された記載(データ)等からの立証が重要となる。本件では、原告が主張する「驚くべき効果」というものが、技術常識から当業者にとって予測できる範囲であったとの証拠がそろっており、予測を超えるものであったと言えるほどの証拠を原告は示すことができなかった。
2.内在する(備わった)性質的構成の意義
「未変化のモメタゾンフロエートの絶対的バイオアベイラビリティが約1パーセント未満である」は、甲1発明に現れる客観的な性質(備わった構成)であるので実質的な相違点ではないと判断された。医薬用途発明では薬物動態学パラメータの構成を含むようなクレームもあり、そのような構成が、いわゆる発明に本来備わった性質であって、先行技術との比較において実質的な相違点とならないと判断される可能性にも留意は必要である。そのような議論(内在する性質的構成の意義)に関係してきそうな判決の例として以下のものがある。
- 2019.03.19 「サン ファーマ v. ジェネンテック」 知財高裁平成30年(行ケ)10036
IL-23アンタゴニストによるIL-17産生阻害の新経路発見に基づく作用機序特許、乾癬治療用途は同じでも新規? - 2011.03.23 「アイノベックス v. アプト」 知財高裁平成22年(行ケ)10256
「物の発明」としての用途発明と新規性 - 2011.01.31 「X v. デビオファーム」 知財高裁平成22年(行ケ)10122
効果に着目した構成 - 2011.01.18 「X v. 特許庁長官」 知財高裁平成22年(行ケ)10055
発明の作用効果に関するクレームの構成 - 2008.02.29 「ティロッツ・ファルマ v. 特許庁長官」 知財高裁平成19年(行ケ)10236
- 2007.11.22 「アンジオテック v. 特許庁長官」 知財高裁平成18年(行ケ)10303
発明の構成要素の用途は発明を特定する要素となり得るか? - 2001.12.18 「テイカ製薬 v. 特許庁長官(インドメタシン含有添付剤事件)」 平成13年(行ケ)107
3.ナゾネックス®点鼻液のジェネリックの参入について
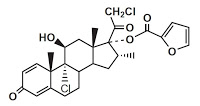
本件特許はナゾネックス®点鼻液(有効成分はモメタゾンフランカルボン酸エステル水和物)を保護するもの。特許期間延長登録を受け、存続期間満了日は2019年10月31日だった。
ナゾネックス®点鼻液は米国シェリング・プラウ社(現 Merck Sharp & Dohme Corp.)によって創製された副腎皮質ステロイドであるモメタゾンフランカルボン酸エステル水和物を含有する定量噴霧式点鼻液である。2008年7月16日に「アレルギー性鼻炎」を効能・効果として国内承認された。再審査期間は~2016年7月15日。MSDが製造販売元、杏林製薬が発売元となっている。
モメタゾン点鼻液 50μg「杏林」は、杏林製薬が販売しているナゾネックス®点鼻液と原薬、添加物及び製造方法・製造場所がそれぞれ同一のオーソライズド・ジェネリック(AG)であり、キョーリンリメディオが後発医薬品として、2017年8月に承認を取得した。しかし、薬価収載は2019年6月14日であり、販売開始は同年8月26日となった(2019.08.23 キョーリン製薬ホールディングス press release 「モメタゾン点鼻液50μg「杏林」56噴霧用・112噴霧用の新発売について」)。
他のジェネリックとして、モメンタゾン点鼻液「MYL」(東興薬品工業)が、2019年2月15日に製造販売承認となり、同年6月14日に薬価収載となってファイザーがマイラン製薬と提携して発売している(2019.06.14 ファイザー press release 「モメタゾン点鼻液50μg「MYL」56噴霧用・同112噴霧用発売」)。東興薬品工業が特許を有する噴霧可能な高粘性ゲル基剤を用いる点鼻剤とのことである。
続いて、モメンタゾン点鼻液「トーワ」(東和薬品)、「JG」(日本ジェネリック)、「タカタ」(高田製薬)、「ニットー」(日東メディック)、「CEO」(東亜薬品)、が2019年8月15日に製造販売承認となり、同年12月13日に薬価収載となって販売されている(2019.12.12 東和薬品 press release 「新製品 2 成分 3 品目を薬価基準追補収載 」)。高田製薬、東和薬品、日東メディック、日本ジェネリックは共同開発を実施し、共同開発グループとして実施したデータを共有している。
|
先発メーカー(MSD/杏林製薬)の動き
|
ジェネリックメーカーの動き
|
|||
|
キョーリンリメディオ (AG)
|
東和薬品、高田製薬、日東メディック、日本ジェネリック、東亜薬品
|
東興薬品工業
|
||
|
2008
|
7/16 ナゾネックス点鼻液が承認
|
|||
|
2014
|
3/31 東和薬品が無効審判請求
(無効2014-800055号)
|
|||
|
2015
|
2/3 審判請求不成立審決
3/13 東和薬品が審決取消訴訟提起
|
8/24東興薬品工業が無効審判請求(無効2015-800166号)
|
||
|
2016
|
7/15 再審査期間終了
|
3/30 審決取消判決
(知財高裁平成27年(行ケ)10054)
|
8/1 左記事件を待つため審理手続中止
|
|
|
2017
|
8/15 AG「杏林」承認
|
6/1 上告棄却及び上告受理申立不受理の決定
|
||
|
2018
|
1/18 特許無効とする審決予告
2/13 東和薬品が審判請求取下げ
2/19東興薬品工業が参加申請するも返戻
|
3/7 審理再開
7/20 杏林製薬が参加申請
7/23 MSDが訂正請求
12/5 特許無効審決
|
||
|
2019
|
10/31 本件特許(3480736)満了日 (20y+4y9m5d)
|
6/14 薬価収載
8/26 販売開始
|
8/15「トーワ」(東和薬品)、「JG」(日本ジェネリック)、「タカタ」(高田製薬)、「ニットー」(日東メディック)、「CEO」(東亜薬品)承認
12/13 薬価収載・販売開始
|
1/18 杏林製薬が審決取消訴訟提起(第1事件)
2/15 「MYL」(東興薬品工業)承認
4/18 MSDが審決取消訴訟提起(第2事件)
6/14 薬価収載・販売開始
12/25 無効審決維持判決
(知財高裁平成31年(行ケ)10006(第1事件); 10058(第2事件))
|
キョーリンリメディオはオーソライズド・ジェネリック(AG)としての承認を2017年に得たが、他のジェネリックの参入が遅れると見込んだのか先発品の本件特許が切れる直前(2019年)まで薬価収載・販売開始を見送った。
東和薬品が無効審決を得る直前で無効審判請求を取下げた理由は不明(先発側と和解?)だが、東和薬品、高田製薬、日東メディック及び日本ジェネリックの共同開発グループ各社からのジェネリックの承認は2019年となった。
上記共同開発グループではなかった東興薬品工業は単独で本件無効審判・訴訟を進め、キョーリンリメディオのAGと同タイミングで「MYL」の薬価収載に至り、販売開始はAGよりむしろ早く行うことができた。先発側のAG戦略はこの点で東興薬品工業に後れをとってしまったことになる。AGの薬価収載のタイミングは先発品への売上や薬価への影響を考えると難しい判断だったのかもしれないが、もし、AGを2018年12月に薬価収載し他のジェネリックに先駆けて販売に踏み切っていれば、先発品の売上にネガティブな影響を早期に受けることになる一方でAGでの早期シェア獲得によるポジティブな影響もあることから、それらのバランスとしての全体利益はどう変化していくことになっただろうか。それにしても、2019年2月に東興薬品工業のジェネリック「MYL」が承認されたのだから、6月の薬価収載でキョーリンリメディオは何としても同日にAGを販売開始しておきたいところだったのでは。
参考(過去記事):

コメント
10054ではなく、10058の誤りでしょうか?
ご指摘ありがとうございました。誤りを修正しました。
【誤】平成31年(行ケ)10054⇒【正】平成31年(行ケ)10058