アリムタ®のビタミン療法特許(進歩性と臨床試験の公然実施について): 知財高裁平成30年(行ケ)10115; 10116
【背景】
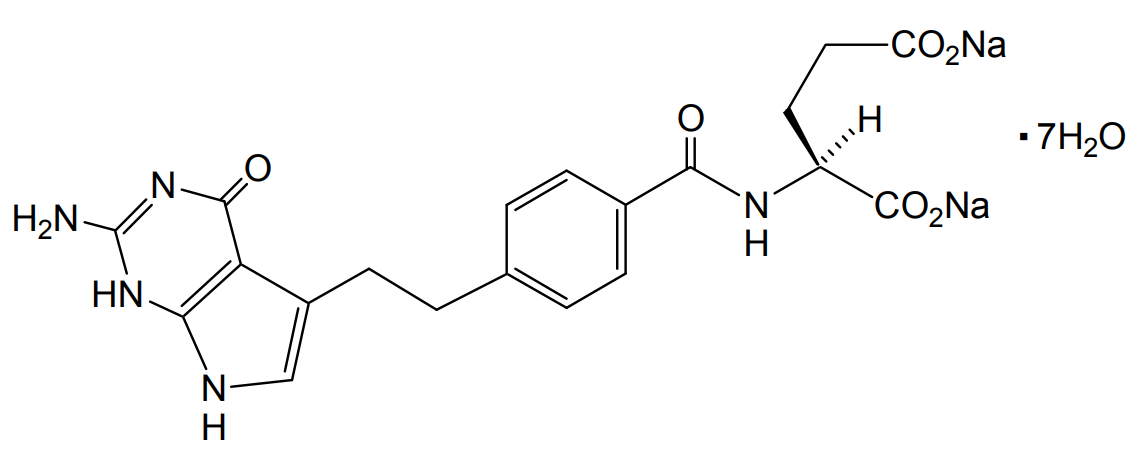 イーライリリーが保有する「新規な葉酸代謝拮抗薬の組み合わせ療法」に関する特許5102928及びその分割出願による特許5469706に対してニプロがした無効審判請求の不成立審決(無効2014-800208及び無効2015-800006)の取消訴訟。
イーライリリーが保有する「新規な葉酸代謝拮抗薬の組み合わせ療法」に関する特許5102928及びその分割出願による特許5469706に対してニプロがした無効審判請求の不成立審決(無効2014-800208及び無効2015-800006)の取消訴訟。
争点は、進歩性及び新規性。
特許5102928及び特許5469706については、過去に、沢井製薬、テバ、ホスピーラによる特許無効審判請求不成立審決を不服として提起された取消訴訟において、原告ら(沢井製薬、テバ、ホスピーラ)主張の取消事由(進歩性に係る判断の誤り、サポート要件に係る判断の誤り、実施可能要件に係る判断の誤り)にはいずれも理由がないとして請求棄却判決が出されている。
- 2017.02.02 「沢井・テバ・ホスピーラ v. イーライ リリー」 知財高裁平成27年(行ケ)10249; 平成28年(行ケ)10017; 平成28年(行ケ)10070
- 2017.02.02 「沢井・テバ・ホスピーラ v. イーライ リリー」 知財高裁平成28年(行ケ)10001; 平成28年(行ケ)10018; 平成28年(行ケ)10082
特許5102928の請求項1:
葉酸とビタミンB12との組み合わせを含有するペメトレキセート二ナトリウム塩の投与に関連する毒性を低下しおよび抗腫瘍活性を維持するための剤であって,
ペメトレキセート二ナトリウム塩の有効量を,葉酸の約0.1mg~約30mgおよびビタミンB12の約500μg~約1500μgと組み合わせて投与し,該ビタミンB12をペメトレキセート二ナトリウム塩の第1の投与の約1~約3週間前に投与し,そして該ビタミンB12の投与をペメトレキセート二ナトリウム塩の投与の間に約6週間毎~約12週間毎に繰り返すことを特徴とする,該剤。
特許5469706の請求項1:
葉酸及びビタミンB12と用いられる,ペメトレキセート二ナトリウム塩を含有するヒトにおける腫瘍増殖を抑制するための医薬であって,下記レジメで投与される医薬:
a.有効量の該医薬を投与し;
b.葉酸の0.3mg~5mgを,該医薬の投与前に投与し;そして,
c.ビタミンB12の500μg~1500μgを,該医薬の第1の投与の1~3
週間前に投与し,
該レジメは,該医薬の毒性の低下および抗腫瘍活性の維持を特徴とする,
上記医薬。
【要旨】
裁判所は、原告の請求を棄却した。以下、裁判所の判断の抜粋。
1.取消事由1(進歩性欠如についての認定判断の誤り)について
「甲1には,GAR-トランスホルミラーゼ阻害剤の治療効果を維持しつつ,その毒性を減少させることを課題とする旨が記載されているところ,甲1では葉酸をGAR-トランスホルミラーゼ阻害剤と組み合わせて投与することによって同課題を解決できるとしており,同課題に関して,更に別の活性成分,例えば,ビタミンB12を積極的に適用する動機や示唆は甲1には何ら記載されていない。これに加えて,・・・本件優先日前にMTAの抗腫瘍活性を維持しつつ毒性を低減させるという目的のために・・・MTAと葉酸を併用投与することは技術常識になっていたものと認められるが,いずれの公知文献にも,上記目的のためには葉酸補充だけでは不十分であるとする指摘はないし,葉酸補充に加えて他の活性成分を投与する必要性についても何ら指摘されていない。
・・・
本件優先日当時,①ベースライン時のホモシステイン値が10μM以上であると,MTAの毒性発現が高度に予測されること,②ホモシステイン値は,葉酸又は/及びビタミンB12が不足すると上昇すること,③葉酸とビタミンB12を併せて投与すると,葉酸単独投与の場合に比して,より確実にホモシステイン値を低下させることができることが,本件優先日当時に知られていたことが認められるものの,以下のa,bからすると,それにより,甲1発明にビタミンB12を投与することを組み合わせることは動機付けられないというべきである。
- a 原告が主張するような,「ベースライン時のホモシステイン値を低下させておくと,毒性の発現が抑制され,かつ抗腫瘍活性が維持される。」ということが,本件優先日当時に技術常識として存在していたとまで認めることはできないから,その点から動機付けがあるということはできない。
- b 仮に当業者がMTAの毒性リスクを低減させるためにベースライン時のホモシステイン値を10μMより低下させる必要があると考えたとしても,そこからビタミンB12を追加することを動機付けられるとは認められない。」
2.取消事由2(新規性欠如についての認定判断の誤り)について
「ICH-GCPガイドラインの上記規定からすると,本件臨床試験においてビタミン補充を受けた患者に対し,投与する抗がん剤がMTAであり,それと併用投与されるのが葉酸及びビタミンB12であるという程度の情報については情報提供があったとは推認できるものの,同意書面等に記載されるべき「治験の目的」,「治験における処置の内容」,「治験の手順」,「合理的に期待できる利益」が具体的にどのようなものを指し,どこまでの情報を開示すべきであるのかについて,ICH-GCPガイドラインには明示的な定めがないし,本件臨床試験が実施されていた諸外国で,当時,どのような法令や実務があったのかについては本件証拠上明らかではない。そうすると,上記のような開示されたと合理的に推認される情報から更に進んでMTA,葉酸及びビタミンB12の具体的な投与量,投与の時期,投与経路といった情報や「MTA投与に関連する毒性を低下しおよび抗腫瘍活性を維持する」ことまでもがインフォームドコンセントの同意書面等に記載されていたと認めることはできない。
また,ICH-GCPガイドライン4.8.7は,治験担当医師は,患者の同意を得るに当たって,患者やその法的に許容される代理人(以下,併せて「患者ら」という。)が,満足するまで患者らからの質問に回答しなければならない旨規定しているものの,「患者らが満足するまで質問に回答しなければならない」という規定は抽象的なものであって,MTA,葉酸及びビタミンB12の具体的な投与量,投与の時期,投与経路といった情報や「MTA投与に関連する毒性を低下しおよび抗腫瘍活性を維持する」ことといった情報を含む全ての情報が患者らの求めに応じて治験担当医師から患者らに対して提供される体制が構築されていたなどそれらの情報が提供される状況にあったとまで本件証拠上認めることはできず,ましてや,実際にそれらの情報の全てが患者らの求めに応じて治験担当医師から提供されたと認めることはできない。その他,本件臨床試験において,患者らが本件発明の内容を知ったとか,知り得る状態にあったというべき事実は認められない。
したがって,本件臨床試験において,本件発明が「公然知られた」とか「公然実施された」と認めることはできない。」
【コメント】
1.進歩性の判断
引用例は異なるもののビタミンB12を組み合わせて用いることまで容易に想到し得るとは認められないとの進歩性判断をした点では、2017.02.02 「沢井・テバ・ホスピーラ v. イーライ リリー」 知財高裁27年(行ケ)10249; 平成28年(行ケ)10017; 平成28年(行ケ)10070及び2017.02.02 「沢井・テバ・ホスピーラ v. イーライ リリー」 知財高裁平成28年(行ケ)10001; 平成28年(行ケ)10018; 平成28年(行ケ)10082と同じ結論となった。
2.新規性の判断
原告は、臨床試験で患者に投与されていることをから、本件発明が「公然知られた」または「公然実施された」として新規性欠如を主張したが、証拠上明らかにすることができず、主張は認められなかった。
臨床試験の実施またはその公開が後の出願の新規性等の判断に問題となった事件として以下のものがある。
- 臨床試験の実施は公然実施(public use)なのか?
2004.04.23 「SmithKline Beecham v. Apotex」 CAFC Docket No.03-1285 - 臨床試験の実施は公然実施(public use)なのか?
2006.12.26 「Eli Lilly v. Zenith, Teva, Dr. Reddy’s」 CAFC Docket No.05-1396, -1429, -1430 - 臨床試験(clinical study)は公然実施(public use)?
2008.08.20 「AstraZeneca v. Apotex and Impax」 CAFC Docket No. 2007-1414, -1416, -1458, -1459 - 臨床試験の実施は新規性を失わせるか
2011.07.07 「Hexal v. Bayer」 EPO審決 T0007/07 - 臨床試験プロトコールと引例適格
2007.03.01 「ブリストルマイヤーズスクイブ v. 日本ケミカルリサーチ」 知財高裁平成17年(行ケ)10818 - 米国カルベジロール試験の信憑性と顕著な効果
2013.10.16 「沢井製薬 v. 第一三共」 知財高裁平成24年(行ケ)10419 - 臨床効果が証明されていなければ引用発明にならない?
2017.02.28 「ザ・ヘンリー・エム・ジャクソン・ファンデイション v. 特許庁長官」 知財高裁平成28年(行ケ)10107
3.本件特許5102928及び5469706が保護すると思われる抗悪性腫瘍剤アリムタ®
抗悪性腫瘍剤アリムタ®(ペメトレキセド注射剤。有効成分はペメトレキセドナトリウム水和物(Pemetrexed Sodium Hydrate))は複数の葉酸代謝酵素を同時に阻害する葉酸拮抗剤。
日本では、悪性胸膜中皮腫に対しては2007年1月4日に承認(再審査期間は~2015年1月3日)、切除不能な進行・再発の非小細胞肺癌に関しては2009年5月20日に承認(再審査期間は同じく~2015年1月3日まで)。
抗悪性腫瘍剤アリムタ®における<用法・用量に関連する使用上の注意>には以下の記載があり、本件特許5102928及び5469706はこの用法用量に関するものと思われる。
本件特許は2021年6月15日が存続期間満了日(延長なし)となる。
1. 本剤による重篤な副作用の発現を軽減するため、以下のように葉酸及びビタミン B12を投与すること。
(1) 葉酸:本剤初回投与の 7 日以上前から葉酸として 1 日 1 回 0.5mg を連日経口投与する。なお、本剤の投与を中止又は終了する場合には、本剤最終投与日から 22 日目まで可能な限り葉酸を投与する。
(2) ビタミン B12:本剤初回投与の少なくとも 7 日前に、ビタミン B12として 1 回 1mg を筋肉内投与する。その後、本剤投与期間中及び投与中止後 22 日目まで 9 週ごと(3 コースごと)に 1 回投与する。
表:アリムタ®(ペメトレキセド注射剤)の特許5102928ヒストリー(日本)
|
製品
|
特許5102928
|
|||
|
無効2014-800039
|
無効2014-800208
|
無効2015-800059
|
||
|
1992
|
欧米で臨床試験開始
|
|||
|
2000
|
6/30 優先日
|
|||
|
2001
|
固形癌患者を対象とした単独投与による第I相試験開始
|
6/15 出願日
|
||
|
2007
|
1/4 悪性胸膜中皮腫の承認
|
|||
|
2009
|
5/20切除不能な進行・再発の非小細胞肺癌の承認
|
|||
|
2012
|
10/5 登録日
|
|||
|
2014
|
3/14 沢井製薬が無効審判請求
12/8 ホスピーラジャパンが請求人参加申請
|
12/16 ニプロが無効審判請求
|
||
|
2015
|
1/3 再審査期間終了(8年)
|
1/6 ホスピーラが請求人参加申請
2/24 テバが請求人参加申請
11/10 請求不成立審決
12/18 沢井製薬が審決取消訴訟出訴(平27行ケ10249)
|
3/18 審判庁が無効2014-800039を優先して審理するため、審判事件手続中止
|
3/10 ホスピーラが無効審判請求
3/26 審判庁が無効2014-800039を優先して審理するため、審判事件手続中止
|
|
2016
|
1/21 テバが審決取消訴訟出訴(平28行ケ10017)
3/17ホスピーラが審決取消訴訟出訴(平28行ケ10070)
|
|||
|
2017
|
2/2 請求棄却判決
|
5/23審理再開
|
||
|
2018
|
7/4 請求不成立審決
8/9 ニプロが審決取消訴訟出訴 (平30行ケ10115)
|
8/8 審理再開
|
||
|
2019
|
11/28 請求棄却判決
|
|||
|
2020
|
||||
|
2021
|
6/15 満了日(20年。延長なし)
|
|||

コメント
2019.12.30 Eli Lilly Press Release:
U.S. District Court Rules in Favor of Lilly in Alimta Vitamin Regimen Patent Lawsuit
http://investor.lilly.com/news-releases/news-release-details/us-district-court-rules-favor-lilly-alimta-vitamin-regimen-0
ELI LILLY v. APOTEX Case No. 1:17-cv-02865-TWP-MPB
https://ecf.insd.uscourts.gov/cgi-bin/show_public_doc?12017cv2865-292
米国特許7,772,209は小児延長により特許期間は2022年5月24日まで。
アリムタ®のビタミン療法特許(5469706, 5102928)に対するホスピーラによる無効審判(無効2014-900214, 無効2015-800059)の口頭審理(2020/3/19)が中止。
先行判決で判断されていない内容を中心に審理予定だった。2021年6月15日が存続期間満了日。
2019.08.09 ELI LILLY AND COMPANY V. HOSPIRA, INC. CAFC 2018-2126, 2018-2127; ELI LILLY AND COMPANY V. DR. REDDY’S CAFC 2018-2128
http://www.cafc.uscourts.gov/sites/default/files/opinions-orders/18-2126.Opinion.8-9-2019.pdf
We reverse the district court’s finding of literal infringement in the Hospira Decision as clearly erroneous in light of the court’s claim construction of “administration of pemetrexed disodium.” Because the district court did not err in its application of the doctrine of equivalents in either decision, we affirm both judgments of infringement. Thus, the Hospira Decision is affirmed-in-part and reversed-in-part, and the DRL Decision is affirmed.
2020.12.21 ELI LILLY AND COMPANY v. APOTEX, INC., CAFC 2020-1328
http://www.cafc.uscourts.gov/sites/default/files/opinions-orders/20-1328.OPINION.12-21-2020_1705369.pdf
“The district court correctly concluded that prosecution history estoppel does not bar Lilly from asserting infringement by equivalents.”
ホスピーラによる無効審判(無効2014-900214, 無効2015-800059)は2020年10月2日に審理終結通知が発せられ、同月23日に審判請求は取下げられました。無効審判の結論がどっちでも特許権が2021年6月15日に満了するので、アリムタ®のジェネリックが6月薬価収載・販売のタイミングか・・・
2021.02.15 東和薬品 press release: ペメトレキセド点滴静注液100mg/500mg「トーワ」製造販売承認取得・・・「ペメトレキセドを有効成分とする医薬品で液剤化に成功し承認されたのは、国内では本剤が初めてです。」
https://www.towayakuhin.co.jp/company/press/2021/02/100mg500mg.php