臨床試験の実施は新規性を失わせるか: EPO審決 T0007/07
 Yasmin®, Yasminelle® and YAZ®に関してバイエル社が保有する経口投与形態医薬組成物の欧州特許EP1214076について、優先日前に実施したYasmin®の臨床試験を原因として新規性を否定したEPO審決に対して、バイエル社はpetition for reviewを提出し、拡大審判部(Enlarged board of appeals)がCase R18/11として検討している(European Patent Register All documents: EP1214076)。
Yasmin®, Yasminelle® and YAZ®に関してバイエル社が保有する経口投与形態医薬組成物の欧州特許EP1214076について、優先日前に実施したYasmin®の臨床試験を原因として新規性を否定したEPO審決に対して、バイエル社はpetition for reviewを提出し、拡大審判部(Enlarged board of appeals)がCase R18/11として検討している(European Patent Register All documents: EP1214076)。
Claim 1:
- A pharmaceutical composition in an oral dosage form comprising, as a first active agent drospirenone in an amount corresponding to a daily dosage, on administration of the composition, of from about 2 mg to 4 mg, and as a second active agent, ethinylestradiol in an amount corresponding to a daily dosage of from about 0.01 mg to 0.05 mg, together with one or more pharmaceutically acceptable carriers or excipients, wherein said drospirenone is in micronized form.
- Bayer press release: 2011.07.08 European Patent Office decides on Yasmin® patent challenge
- Reuters: 2011.07.09 Bayer loses European patent for Yasmin
米国
上記欧州特許のファミリーである米国特許6,787,531については、Yasmin®の後発品をANDA申請したBarr社との特許侵害訴訟において、米国ニュージャージー州連邦地方裁判所(2008.03.03 Case No.05-CV-2308)は、「臨床試験の実施を原因として新規性は失われる」というBarr社の主張は認められないとの判断を下した。但し、特許は自明であるから無効であると判断され、その判断はCAFCでも維持された(2009.08.05 BAYER SCHERING PHARMA v. BARR CAFC Case No.2008-1282)。
Claim 1:
- A pharmaceutical composition comprising from about 2 mg to about 4 mg of micronized drospirenone particles, about 0.01 mg to about 0.05 mg of α-ethinylestradiol, and one or more pharmaceutically acceptable carriers, the composition being in an oral dose form exposed to the gastric environment upon dissolution, and the composition being effective for oral contraception in a human female.
- Bayer press release: 2008.03.31 Bayer appeals invalidity ruling on its Yasmin® Patent
- Reuters: 2008.06.24 Bayer and Barr agree oral contraceptive deal
日本
審査経過によれば、ドロスピレノン及び/又はエチニルエストラジオールが超微粉砕されたものである点で引用発明と相違するが薬物を微粉化する技術文献の存在からすれば当業者が容易に発明できるという理由で特29条2項により拒絶理由を受けたが、最終的には特許成立している(特許4354667)。存続期間満了日は2020年8月31日。
請求項1:
- 第1の活性剤として、組成物の投与の際、1mg~4mgの1日投与量に対応する量の超微粉砕されたドロスピレノンと、第2の活性剤として、0.01mg~0.05mgの1日投与量に応答する量のエチニルエストラジオールと、1以上の医薬的に許容できる担体又は賦形剤とを含んで成る、経口投与形での医薬組成物。
これまでに、臨床試験の実施が新規性を失わせるかどうかについて取り上げた判決は下記のとおり。
- 2006.12.26 「Eli Lilly v. Zenith, Teva, Dr. Reddy’s」 CAFC Docket No.05-1396, -1429, -1430
- 2004.04.23 「SmithKline Beecham v. Apotex」 CAFC Docket No.03-1285
- 2008.08.20 「AstraZeneca v. Apotex and Impax」 CAFC Docket No. 2007-1414, -1416, -1458, -1459
参考:
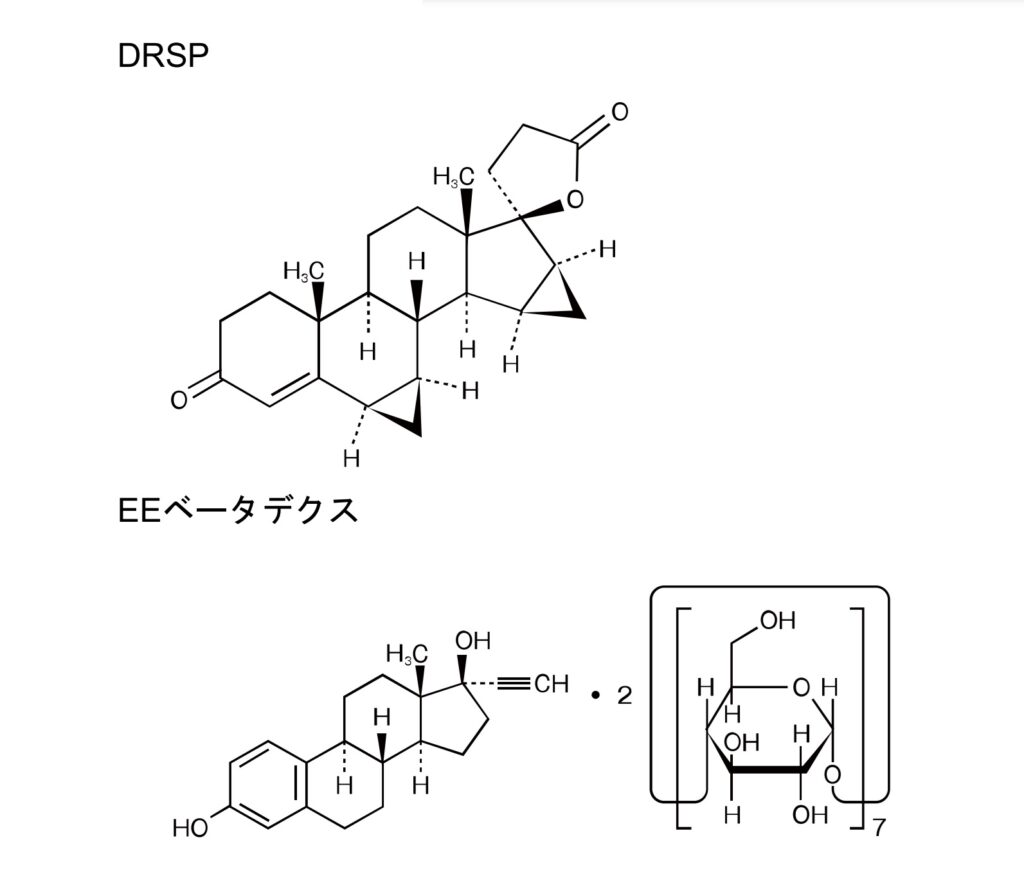
バイエル社は有効成分として、合成黄体ホルモンであるドロスピレノン(Drospirenone(DRSP))と、合成卵胞ホルモンであるエチニルエストラジオールベータデクス(Ethinylestradiol Betadex(EE))を含有する配合剤(DRSP 3mg/EE 0.030mg)を経口避妊剤(販売名Yasmin)として開発し、海外で承認を得た。その後、副作用のリスク軽減を期待してEE含量を0.020mgまで低減したDRSP 3mg/EE 0.020mg 配合剤(販売名YAZ)の臨床開発が開始され、日本では2010年7月に「月経困難症治療剤」(販売名ヤーズ配合錠(YAZ))として承認された。


コメント