抗悪性腫瘍剤アリムタ®のビタミン併用療法特許: 知財高裁平成28年(行ケ)10001; 平成28年(行ケ)10018; 平成28年(行ケ)10082
【背景】
被告(イーライリリー)が保有する「新規な葉酸代謝拮抗薬の組み合わせ療法」に関する特許5469706について原告(沢井製薬、テバ、ホスピーラ)がした無効審判請求を不成立とした特許庁審決(無効2014-800063)に対して、原告が審決取消しを求めて本件訴訟を提起した。争点は、進歩性、サポート要件、実施可能要件。
請求項1:
葉酸及びビタミンB12と用いられる,ペメトレキセート二ナトリウム塩を含有するヒトにおける腫瘍増殖を抑制するための医薬であって,下記レジメで投与される医薬:
a.有効量の該医薬を投与し;
b.葉酸の0.3mg~5mgを,該医薬の投与前に投与し;そして,
c.ビタミンB12の500μg~1500μgを,該医薬の第1の投与の1~3週間前に投与し,
該レジメは,該医薬の毒性の低下および抗腫瘍活性の維持を特徴とする,
上記医薬。
【要旨】
裁判所は、原告ら主張の取消事由(進歩性に係る判断の誤り、サポート要件に係る判断の誤り、実施可能要件に係る判断の誤り)にはいずれも理由がないとして請求棄却とした。取消事由1(進歩性に係る判断の誤り)について取り上げる。
裁判所は、当業者において、引用発明に基づいて、毒性の低下及び抗腫瘍活性の維持のためにビタミンB12を組み合わせて用いることまで容易に想到し得るとは認めるに足りないと判断した。以下理由抜粋。
「引用例には,葉酸の補充を受けても重篤な毒性を経験した患者がいたことも記載されているが,…(略)…葉酸以外のものを組み合わせれば,より一層MTA毒性の低下ないし抗腫瘍活性の維持が促進されるなど,さらに別のものを組み合わせる動機付けとなる記載も示唆もない。」
「ビタミンB12を投与するとホモシステインレベルが低下し,葉酸と併用投与すると,葉酸の単独投与に比してより一層ホモシステインレベルが低下することは,本件優先日当時の技術常識であった。しかし,ベースラインのホモシステインレベルは,MTAを含む葉酸代謝拮抗薬の投与に関連する毒性の程度に影響を与える同投与開始前における葉酸の機能的状態の指標として信頼性の高いものであることから,上記毒性のリスクを予測させるものにすぎない。証拠上,ホモシステインが上記毒性の発現に直接関与していることは認められない。よって,ホモシステインレベルを低下させること自体によって直ちに葉酸代謝拮抗薬の投与に関連する毒性が低下するということはできず,本件優先日当時においてそのような事実が公知であったことを認めるに足りない。」
「さらに,栄養障害を来すことが多いがん患者に対しては,通常,治療の一環として,葉酸,ビタミンB12等のビタミンやその他の栄養素を含む栄養補給が行われ,その効果の1つとして抗がん剤による副作用の軽減も挙げられているが,上記栄養補給の効果に関する本件優先日当時の公知文献の記載によれば,上記副作用の軽減は,葉酸,ビタミンB12のみならず,他の栄養素をも含む栄養補給によって患者の栄養状態を主とする全身状態が改善することによるものであると解され,葉酸とビタミンB12を組み合わせて投与したことによるものではない。よって,上記栄養補給は,葉酸,ビタミンB12に限らず必要な栄養素の補給により患者の栄養状態を主とする全身状態が改善することによる抗がん剤の副作用の軽減という効果を目的の1つとするものである。
したがって,上記のとおり葉酸補充の際にビタミンB12の併用が推奨されること及び上記栄養補給のいずれも,葉酸代謝拮抗薬の毒性の低下及び抗腫瘍活性の維持のために葉酸とビタミンB12を併用投与するという本件発明1の構成とは用途を異にし,上記構成に係る動機付けないし示唆となるものということはできない。」
原告は、
「相違点1に係る容易想到性を肯定する根拠として,…(略)…本件発明1は,従来から広く行われていたがん患者に対する栄養補給のうち,葉酸及びビタミンB12の補充を特に取り出して構成要件としたものにすぎない」
と主張した。
しかし、裁判所は、
「葉酸補充の際にビタミンB12の併用が推奨されるのは,本件優先日当時における技術常識であったから,がん患者に対してMTA等の葉酸代謝拮抗薬を投与するに当たり,その抗腫瘍活性を維持しながら投与に関連する毒性を低下させるために葉酸を補充する際,ビタミンB12を併用することが多かったものと推認することができる。しかし,上記併用が推奨されるのは,ビタミンB12の欠乏が看過されて同欠乏に特徴的な神経症状が引き起こされるおそれがあることによるものであり,葉酸代謝拮抗薬の抗腫瘍活性維持ないし毒性低下とは関係がない。
したがって,上記のがん患者に対する葉酸及びビタミンB12を含む栄養補給並びに葉酸補充の際におけるビタミンB12の併用は,いずれもMTA毒性の低下及び抗腫瘍活性の維持のために葉酸とビタミンB12を併用投与するという本件発明1の構成とは目的を異にし,同構成に係る動機付けないし示唆となるものではない。」
と判断した。
【コメント】
用途発明において、引用発明と本願発明とが「目的を異」にすれば直接的には動機付けは生まれない。
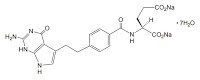
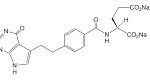
抗悪性腫瘍剤アリムタ®(ペメトレキセド注射剤。有効成分はペメトレキセドナトリウム水和物(Pemetrexed Sodium Hydrate))に関する2件のビタミン併用療法特許(特許第5102928号及び特許第5469706号)に関し、沢井製薬(株)らが請求した無効審判(無効2014-800039及び無効2014-800063)においてそれぞれ特許維持審決を下した特許庁審決の結論を知財高裁も支持した。本件特許は2021年6月まで有効に存続することになる。
抗悪性腫瘍剤アリムタ®は複数の葉酸代謝酵素を同時に阻害する葉酸拮抗剤。日本では、悪性胸膜中皮腫に対しては2007年1月に承認(再審査期間は~2015年1月3日)、切除不能な進行・再発の非小細胞肺癌に関しては2009年5月に承認(再審査期間は同じく~2015年1月3日まで)。
抗悪性腫瘍剤アリムタ®における<用法・用量に関連する使用上の注意>には以下の記載があり、本件特許はこの用法用量に関するものと思われる。
1. 本剤による重篤な副作用の発現を軽減するため、以下のように葉酸及びビタミン B12を投与すること。
(1) 葉酸:本剤初回投与の 7 日以上前から葉酸として 1 日 1 回 0.5mg を連日経口投与する。なお、本剤の投与を中止又は終了する場合には、本剤最終投与日から 22 日目まで可能な限り葉酸を投与する。
(2) ビタミン B12:本剤初回投与の少なくとも 7 日前に、ビタミン B12として 1 回 1mg を筋肉内投与する。その後、本剤投与期間中及び投与中止後 22 日目まで 9 週ごと(3 コースごと)に 1 回投与する。
本事件に関する参考記事:
- アリムタ®のビタミン療法特許 知財高裁が維持判決
- 抗悪性腫瘍剤アリムタ®のビタミン療法特許の無効審判で特許維持審決
- イーライリリー・アンド・カンパニー press release: 2017.02.02 Japan IP High Court Rules In Lilly’s Favor On Alimta Vitamin Regimen Patents
- 日本イーライリリー press release: 2017.02.03 「抗悪性腫瘍剤アリムタ®のビタミン療法特許に関する知的財産高等裁判所の判決について」
併用療法特許の進歩性に関しての過去参考判決記事:
- 2013.10.03 「壽製薬 v. 特許庁長官」 知財高裁平成24年(行ケ)10415
- 2013.04.11 「セルジーン v. 特許庁長官」 知財高裁平成24年(行ケ)10124
- 2012.04.11 「沢井製薬 v. 武田薬品」 知財高裁平成23年(行ケ)10148
- 2012.04.11 「沢井製薬 v. 武田薬品」 知財高裁平成23年(行ケ)10146, 10147
- 2011.07.19 「アラーガン v. 特許庁長官」 知財高裁平成22年(行ケ)10301
- 2011.06.09 「千寿 v. 参天」 知財高裁平成22年(行ケ)10322
- 2011.03.22 「沢井製薬 v. 武田薬品」 特許無効審判事件 2010-800087, 2010-800088
- 2009.04.27 「スミスクライン ビーチャム v. 特許庁長官」 知財高裁平成20年(行ケ)10353
- ロスバスタチンとCYP3A4阻害薬剤の組み合わせに関する発明の拒絶審決(不服2007-17860)
- 2006.10.26 「Takeda事件」 EPO審決T0512/02
- 2006.10.25 「ノバルティス v. 特許庁長官」 知財高裁平成17年(行ケ)10773
- 2006.01.25 「メディカライズ v. 特許庁長官」 知財高裁平成17年(行ケ)10438
- 2005.11.08 「興和 v. 特許庁長官」 知財高裁平成17年(行ケ)10389
- 2005.06.02 「ゼファーマ v. 特許庁長官」 知財高裁平成17年(行ケ)10459
- 2005.06.02 「ゼファーマ v. 特許庁長官」 知財高裁平成17年(行ケ)10458
米国でも2017年1月12日、CAFCはアリムタ(Alimta)®のビタミン併用療法特許の有効性を認め、同後発品のANDAを申請したテバの特許侵害を認める判決を下したところであった(Eli Lilly v. Teva No.15-2067 (Fed. Cir. 2017))。
- 2017.01.12 Eli Lilly press release: U.S. Court of Appeals Rules In Lilly’s Favor On Alimta Vitamin Regimen Patent
アリムタの全世界の売上高(2016年通年)は約23億ドル(2017.02.23 イーライリリー press release: 米国イーライリリー社、2016年第4四半期および通年の業績を報告)。
ところで、日本において、このような組み合わせ特許が後発医薬品に対して実際に権利行使できるのかどうかについては、下記事件のとおり議論の余地がある。いわゆる「組み合わせ医薬」の発明は、医薬用途発明として「物」としての特許は認められている一方で、「方法」ではなく「物」でしか表現できない現在の特許法解釈・審査基準により、配合剤ではない「組み合わせ医薬」の発明に係る特許権の効力には問題が残されている。薬の組み合わせ方だけに限らず、IoT、AI、ビッグデータ等の「物」として表現できない組み合わせが期待される今後の医療技術の発展にとって、より良い医療方法・医薬投与方法を生み出していくことは重要であり、このような「方法」に特徴のある技術について、柔軟かつ安定した権利付与と活用が可能な法制度への改革の必要性議論が望まれる。

コメント