Summary
- 本件は、シャイアーの特許(第6466538号)に対して、グリーンクロスがした無効請求の不成立審決取消訴訟である。
- 知財高裁は、基礎出願2には本件発明の効果が実質的に記載されていたとは認められないとして、審決による優先権の判断は誤りであったと判断したものの、それをもって直ちに本件審決を取り消すべきという結論において理由はないと判断した。
- さらに、知財高裁は、その他の進歩性の判断の誤り、実施可能要件違反、サポート要件違反及び明確性要件違反についての各取消事由についても理由はないとして、グリーンクロスの請求を棄却する判決をした。
- グリーンクロスによって開発されたイズロン酸-2-スルファターゼの脳室内投与製剤(ヒュンタラーゼ®)は、クリニジェンによって日本で販売されているが、シャイアーの特許が問題視されているのだろうか。グリーンクロスとシャイアーとはムコ多糖症II型患者に投与するイズロン酸-2-スルファターゼ製剤においてライバル関係にある。
1.はじめに
本件(知財高裁令和4年(行ケ)10010)は、シャイアー ヒューマン ジェネティック セラピーズ インコーポレイテッド(以下、「シャイアー」という。)が特許権者であり、発明の名称を「治療薬のCNS送達」とする特許第6466538号に対して、グリーン クロス コーポレイション(以下、「グリーンクロス」という。)がした無効審判請求(無効2020-800024号事件)を不成立とした審決の取消訴訟である。
特許第6466538号
【請求項1】(本件発明1)
リソソーム酵素に関する補充酵素である酵素を含む薬学的組成物であって、該組成物は、該リソソーム酵素のレベルまたは活性の減少を伴うリソソーム蓄積症に罹患しているかまたは、これに罹患しやすい対象に脳室内投与されることを特徴とし、ここで、該組成物は、5mg/ml~100mg/mlの濃度の該補充酵素と、50mMまでのリン酸塩を含み、かつ該組成物が、5.5~7.0のpHを有することをさらに特徴とする、薬学的組成物。
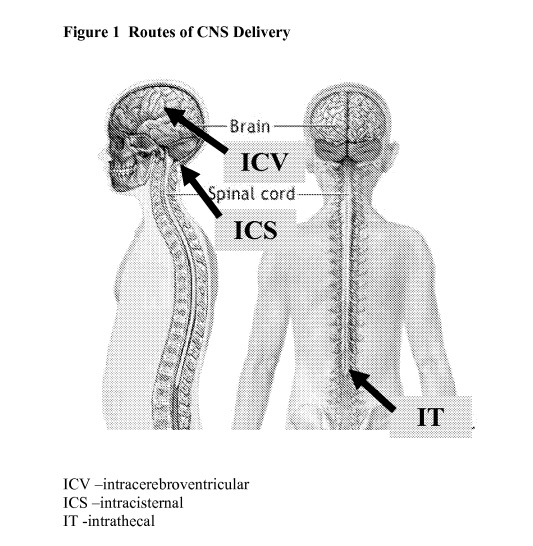
※「脳室内投与」は、 「ICV(intracerebroventricular )投与」ともいう。これに対して、「髄腔内投与」は、「IT(intrathecal)投与」ともいう。
※「リソソーム蓄積症」は、「ライソゾーム病」ともいわれ、ライソゾームと呼ばれる細胞内小器官内の酵素が遺伝的に欠損していることにより、ライソゾーム内で分解されるべき脂質やムコ多糖が老廃物として体内に蓄積してしまう先天代謝異常疾患の総称で、そのひとつが「ムコ多糖症II型(ハンター症候群)」。治療法としては、ライソゾームの酵素のひとつであるイズロン酸-2-スルファターゼを補充する療法がある。
なお、シャイアーが特許権者であり、発明の名称を「イズロン酸-2-スルファターゼのCNS送達のための方法および組成物」とする特許第6522072号に対して、グリーンクロスがした無効審判請求(無効2020-800025号事件)を不成立とした審決の取消訴訟(知財高裁令和4年(行ケ)10022)も、本件(知財高裁令和4年(行ケ)10010)と同日に判決が言い渡された。
特許第6522072号
【請求項1】
ハンター症候群を治療するための安定製剤であって、前記製剤は対象に脳室内投与されることを特徴とし、前記安定製剤は、少なくとも5mg/mlの濃度のイズロン酸-2-スルファターゼ(I2S)タンパク質を含み、かつ、50mM以下の濃度のリン酸塩を含み、前記製剤が5.5~7.0のpHを有することをさらに特徴とする、安定製剤。
令和4年(行ケ)10010及び令和4年(行ケ)10022の何れの審決取消請求事件も、争点は、優先権に関する認定判断の誤り並びに実施可能要件違反、サポート要件違反、明確性要件違反及び進歩性についての各認定判断の誤りの有無である。
両事件に係る特許権は何れも同じ7つの基礎出願に基づく優先権を主張して同日に出願されたPCT出願(PCT/US2011/041924及びPCT/US2011/41925)に由来するものである。特許発明の内容は前記のとおり若干異なるが、何れも製剤は「対象に脳室内投与されることを特徴と」するものであり、原告グリーンクロスが主張した無効理由及び裁判所の判断内容は概ね同じであるため、本記事では、令和4年(行ケ)10010の内容についてのみ紹介する。
本件の知財高裁による判断を紹介した後に、「医薬用途発明」の優先権の利益の享受についての雑感や、グリーンクロスがシャイアーの特許について無効審判を請求した背景を紹介する。
2.知財高裁の判断(令和4年(行ケ)10010)
知財高裁(第2部)は、原告グリーンクロスの主張は、優先権の判断の誤りという限度において理由があるが、それをもって直ちに本件審決を取り消すべきという結論において理由はないとし、その他、進歩性の判断の誤り、実施可能要件違反、サポート要件違反及び明確性要件違反という各取消事由についても理由はないとし、原告グリーンクロスの請求を棄却する判決をした。
(1)優先権に関する認定判断の誤り(取消事由1)について
ア 優先権について
進歩性判断の引用文献となるか否かについて問題となった甲6(後述)が公衆に利用可能となった日(2010年7月2日)より前の優先基礎出願は、以下の2つである。
- 甲16(優先権証明書(US61/358,857:2010年6月25日出願))に係る米国特許出願第61/358,857号(基礎出願1)
- 甲17(優先権証明書(US61/360,786:2010年7月1日出願))に係る米国特許出願第61/360,786号(基礎出願2)
知財高裁は、本件発明が基礎出願1及び2の優先権主張の利益を享受することができるか否かについて、以下のとおり、甲17(基礎出願2)には、本件発明が記載されているものとは認められないから、本件出願について、基礎出願2に基づく優先権を(同様に基礎出願1に基づく優先権も)主張することはできない、と判断した。
- ICV投与とIT投与の相応に密接な関連性を考慮しても、ICV投与による実験データとIT投与による実験データとを直ちに同一視することはできないことが、2010年7月頃における技術常識であったこと等を踏まえると、「本件発明1が甲17に記載されていた発明であると認められるためには、甲17に、本件発明1の組成物が実質的に記載されていたものと認められるのみならず、甲17に、本件発明1の組成物による送達の効果が、ICV投与した場合のものとして、実質的に記載されていたと認められる必要があるというべきである。」
- 甲17には、本件発明1の組成物に含まれる組成物の記載があるといえるが、組成物の構成やその使用方法に関する一般的な記載はみられるものの、当該組成物がどのように送達されて治療効果を奏するのかについて具体的な記載はない。
- 実施例の記載を見ても、製剤がIT投与されたとの記載があるが、治療効果については記載がなく、ICV投与した場合のものとして本件発明1の組成物による送達の効果を記載するものでもない。
イ 甲6が公知文献とされなかったことが直ちに取消事由に当たるかについて
原告グリーンクロスは、本件出願について基礎出願2に基づく優先権主張が認められないのであれば、取消訴訟の審理範囲を根拠として、本件審決に当たり、基礎出願2に基づく優先日(2010年7月1日)の後であるが基礎出願3に基づく優先日(2010年9月29日)前に公開された甲6:
- 「INTRATHECAL DELIVERY OF PROTEIN THERAPEUTICS TO TREAT GENETIC DISEASES INVOLVING THE CNS 」 INJECTABLE DRUG DELIVERY 2010: FORMULATIONS FOCUS, Issue No.19, pages 16-20(2010年7月2日に公衆に利用可能となったと認められる) pdfダウンロード用リンク(p16-20)URL https://www.ondrugdelivery.com/wp-content/uploads/2018/11/May2010.pdf
を副引用例として考慮しなかった本件審決は、優先権に係る判断の誤りによって直ちに取り消されるべきである旨を主張した。
しかし、知財高裁は、
- 甲6の適用については審判手続においても問題とされ、当事者双方において攻撃防御を尽くす機会はあったといえる。
- 本件訴訟において、審判手続において審理判断されていた甲2発明ないし甲4発明との対比における無効原因の存否の認定に当たり、甲6発明を適用することによって容易想到性の有無を判断することが、当事者に不測の損害を与えるものではなく、違法となるものではない。
- 最高裁昭和42年(行ツ)第28号同51年3月10日大法廷判決・民集30巻2号79頁は、本件のような場合について許されないとする趣旨とは解されない。
ことから、優先権の判断の誤りという限度において理由があるが、それをもって直ちに本件審決を取り消すべきという結論において理由がない、と判断した。
(2)進歩性の判断における甲6の適用について
なお、知財高裁は、基礎出願1及び2に基づく優先権の利益を享受できず、基礎出願3に基づく優先日(2010年9月29日)前に公開された甲6を適用しても、以下のとおり、進歩性を否定することはできないと判断した。
- (ア) 甲6には、「14mg/mLのリソソーム酵素、5mMのリン酸ナトリウム、145mMの塩化ナトリウム及び0.005%のポリソルベート20を含有し、pHは7.0である、IT投与されるリソソーム酵素を含む処方物」が記載されているといえる。
- (イ) 甲2’発明は、「ガラクトシルセレブロシダーゼ(GALC)10mg/ml、マンニトール170mM、クエン酸ナトリウム50mM、およびTween80 100mg/Lの組成を有する、twitcherマウスに対して脳室内投与するための組成物。」の発明であるところ、その組成を特定する事項として、緩衝剤とみられる「クエン酸ナトリウム50mM」を含むものであり、クエン酸緩衝液はpH2.0~6.2であることが認められる。
- 本件発明1と甲2’発明との相違点については、本件発明1は、50mMまでのリン酸塩を含み、かつ該組成物が、5.5~7.0のpHを有することをさらに特徴とするものであるのに対し、甲2’発明は、50mMまでのリン酸塩を含み、かつ該組成物が、5.5~7.0のpHを有すると特定されていない点である。
- 甲2においては、甲2’発明に係る組成物について、サイコシンの有意な減少や生存日数の延長という有利な効果が認められた旨が記載されているところであり、それにもかかわらず、甲2に接した当業者に対し、甲2’発明の「クエン酸ナトリウム50mM」に代えて、pHも組成も異なる前記(ア)の処方物を用いることを動機付ける、又はこれを示唆する記載は甲2に見当たらないし、本件全証拠をもってしても、そのような動機付け又は示唆に当たり得るような技術常識も認められない。
- (ウ) さらに、前記(ア)の処方物は、IT投与に係るものであるところ、甲6には、前記(ア)の処方物を投与した場合の送達や治療効果について具体的な記載がされているとは直ちに認め難く、また、IT投与の治療効果とICV投与の治療効果とを同視し得る旨等を明らかにする記載も見当たらない。
ことから、前記(イ)及び(ウ)からすると、甲6に、そもそも製剤の発明として引用発明を認定できる程度に前記(ア)の処方物が記載されているといえるかには疑問があり、仮にそれが記載されているとしても、当業者において、ICV投与に係る甲2’発明に、IT投与に係る前記(ア)の処方物を適用して、本件発明1の構成に至ることが容易想到であったと認めるに足りる事情はないとして、甲2発明を基礎とする進歩性の判断の誤り(取消事由5)において、甲6発明の適用についての原告グリーンクロスの主張に理由はないと判断した。
また、知財高裁は、甲3発明を基礎とする進歩性の判断の誤り(取消事由6)、甲4発明を基礎とする進歩性の判断の誤り(取消事由7)においても、甲6の適用についての原告グリーンクロスの主張に理由はないと判断した。
結論として、知財高裁は、進歩性の判断の誤りについての原告グリーンクロスの主張はいずれも理由はないと判断した。
(3)実施可能要件違反(取消事由2)について
知財高裁は、
「各実施例についての記載からすると、本件明細書の発明の詳細な説明には、本件発明1に規定される濃度のリソソーム蓄積症に係る酵素とリン酸塩を含み、かつ、pHも本件発明1に規定される範囲内にある組成物をICV投与することにより、組成物中の酵素が脳の組織に分布して大脳の深部組織まで到達することや、酵素による治療効果が確認されたことが記載されており、もって、本件発明1の薬学的組成物がリソソーム蓄積症の治療に使用できることが開示されていると認められる。」
と判断した。
原告グリーンクロスは、
- リン酸塩が0~5mMの範囲
- イオン強度が低い場合(NaClが0~50mMである場合)
- hGalC以外の酵素について熱安定性が検証されていないこと
等について実施可能要件違反を主張したが、知財高裁は、本件発明についての実施可能要件違反は認められないとして、取消事由2は理由がないと判断した。
(4)サポート要件違反(取消事由3)について
知財高裁は、
「本件発明の概要に照らすと、本件発明の課題は、リソソーム蓄積障害の処置のために、中枢神経系(CNS)に、活性作用物質であるリソソーム酵素に関する補充酵素である酵素を、より有効に直接送達するためのアプローチを提供することにあるということができる。」
としたうえで、
「本件明細書には、補充酵素を一定以上の濃度で含み、かつ、副作用をもたらされない範囲でリン酸塩を含む、pHが特定範囲である組成物として、前記・・・の課題を解決できると当業者が認識できる発明が記載されており、本件発明1は、発明の詳細な説明に記載された発明であるといえる。」
と判断した。
原告グリーンクロスは、
- 本件発明の課題には、(免疫原性の問題を回避して)高濃度の酵素濃度を実現することも含む。
- リン酸塩濃度が低い場合やイオン強度が低い場合における熱安定性は明らかでない。
- 本件発明は、エリオットB溶液にタンパク質を溶解させた組成物にまで及んでおり、課題を解決できない領域にまで及んでいる。
等、サポート要件違反を主張したが、知財高裁は、本件発明についてのサポート要件違反は認められないとして、取消事由3は理由がないと判断した。
(5)明確性要件違反(取消事由4)について
原告グリーンクロスは、本件発明1について、リン酸塩の下限値が特定されていないことから、明確性要件に反すると主張した。
しかし、知財高裁は、
「本件特許の請求項1の文言から、本件発明1の薬学的組成物が「リン酸塩を含」むものであることは明らかで、50mMまでのリン酸塩であれば、どれほどわずかの量を含む場合であっても、本件発明1のリン酸塩に係る発明特定事項を満たすことは明確であって、リン酸塩の下限値が特定されていないことが何ら第三者に不測の損害を被らせるものでないことは明らかである。」
として、取消事由4は理由がないと判断した。
3.優先権の利益の享受・・・「効果が実質的に記載されていた」か否か
(1)「医薬用途発明」の優先権の効果を認めるか否かの判断
知財高裁は、本件において優先権の効果が認められるためには、すなわち「本件発明1が基礎出願2(甲17)に記載されていた発明であると認められるためには」、何が必要とされるかについて、以下のように言及した。
「・・・の技術常識を踏まえると、本件発明1が甲17に記載されていた発明であると認められるためには、甲17に、本件発明1の組成物が実質的に記載されていたものと認められるのみならず、甲17に、本件発明1の組成物による送達の効果が、ICV投与した場合のものとして、実質的に記載されていたと認められる必要があるというべきである。」
これを、さらに「医薬用途発明」(医薬発明ともいう)のこととして一般化するとすれば、基礎出願に少なくとその医薬用途としての効果が実質的に記載されていると認められる必要がある、と解釈することができそうだ。

「医薬用途としての効果が実質的に記載されている」と認められるには、その効果がどのようなレベルで記載されていればよいのでしょうか・・・。
基礎出願2には、製剤が髄腔内(IT)投与されたとの記載にとどまっており、その製剤が脳室内(ICV)投与されたことによる治療効果についての記載どころか、脳室内(ICV)投与される(された)との記載すらなかったことから、基礎出願2には本件発明にとって優先権の効果はないとの結論は妥当のように思える。審判(特許庁)での審理が丁寧ではなかったといえるかもしれない。
優先権の効果が認められるための記載について判示された(主張された)過去の医薬関連判決を眺めると、「医薬用途発明」の優先権の効果について真正面から判示した裁判例は少ない。
- 2016.03.24 「東和薬品 v. イコス」 知財高裁平成27年(行ケ)10113・・・特許庁は、「パリ条約4条Hにおいて優先権が認められるための要件は,特許発明の構成部分が最初の出願の記載全体により明らかにされていることであって,優先権を主張する特許発明について,優先権証明書の記載が,日本の特許法の実施可能要件やサポート要件を充足することを要求するものではないし,ましてや実施可能要件やサポート要件の充足性のために優先権証明書に薬理データを記載すべきことを要求するものでもない」と述べた。裁判所は判断せず。
- 2008.10.06 「ユーロスクリーン v. 小野薬品」 大阪地裁平成18年(ワ)7760・・・裁判所は、「本件基礎出願1の明細書には,ケモカイン受容体88C(CCR5)と結合するケモカイン(リガンド)についての記載がなく,88Cの機能が開示されていないこととなり,産業上の利用可能性ないし実施可能性要件を欠き,また,最初の出願に係る出願書類の全体により本件各発明が明らかにされているということもできない。したがって,本件特許は,本件基礎出願1に基づく優先権を享受することができない。」と判示した。
- 2006.11.30 「シンジェンタ v. 特許庁長官」 知財高裁平成17年(行ケ)10737・・・裁判所は、「本願発明は化学物質の発明であるが、化学物質につきパリ条約による優先権主張の利益を享受するためには、第1国出願に係る出願書類において単に化学構造式や製造方法を示して理論上の製造可能性を明らかにしただけでは足りず、当該出願書類全体から当該化学物質が現実に存在することが実際に確認できることを要するものと解するのが相当である。けだし、化学構造式や製造方法を机上で作出することは容易であるが、それだけでは単に理論上の可能性を示唆するにとどまるものであって、現実に製造できることが確認されない限り、実施可能な発明として完成しているものと評価することはできないからである。」と判示した。
- 2000.09.05 「杏林製薬 v. 特許庁長官」 東京高裁平成11年(行ケ)207・・・裁判所は、「化学物質につき特許が認められるためには、それが現実に提供されることが必要であり、単に化学構造式や製造方法を示して理論上の製造可能性を明らかにしただけでは足りず、化学物質が実際に確認できるものであることが必要であると解すべきである。なぜなら、化学構造式や製造方法を机上で作出することは容易であるが、そのことと、その化学物質を現実に製造できることとは、全く別の問題であって、机上で作出できても現実に製造できていないものは、未だ実施できない架空の物質にすぎないからである。そして、ある化学物質に係る特許出願の優先権主張の基礎となる出願に係る明細書に、その化学物質が記載されているか否かについても、同様の基準で判断されるべきことは明らかである。」と判示した。
特許・実用新案審査基準 によると、請求項に係る発明にとって優先権の主張の効果が認められるか否かは、基礎出願の記載から同発明に補正したと仮定した場合に新規事項の追加となるか否かを軸として判断する(特許・実用新案審査ハンドブック(第V部 優先権 第1章 パリ条約による優先権)も参照。)。
日本出願の明細書、特許請求の範囲及び図面が第一国出願について補正されたものであると仮定した場合において、その補正がされたことにより、日本出願の請求項に係る発明が、「第一国出願の出願書類全体に記載した事項」との関係において、新規事項の追加されたものとなる場合には、パリ条約による優先権の主張の効果が認められない。すなわち、当該補正が、請求項に係る発明に、「第一国出願書類全体に記載した事項」との関係において、新たな技術的事項を導入するものであった場合には、優先権の主張の効果が認められない。
ここで、「第一国出願の出願書類全体に記載した事項」とは、当業者によって、第一国出願の出願書類全体の記載を総合することにより導かれる技術的事項である。– 特許・実用新案審査基準 「第V部 優先権 第1章 パリ条約による優先権」(3.パリ条約による優先権の主張の効果についての判断 3.1.3 第一国出願の出願書類の全体に記載した事項との対比及び判断)より
医薬用途発明の補正・訂正において、新規事項の追加に該当しないと判断するプロセスに実施可能要件と同様なハードル(効果を認識し得ること)を設けて訂正要件を判断した判決(記事「疼痛治療剤リリカ®(プレガバリン)の後発医薬品の特許権侵害訴訟で控訴審(知財高裁)判決出揃う 全ての「痛み」の用途特許は無効、特許権侵害認めず・・・4つの部で本件訂正が新規事項追加か否かへの向き合い方に違い」参照)が近年見られる。
医薬用途発明の優先権の効果を認めるか否かの判断は、審査基準のように補正の新規事項の追加の例に従うのか、数少ない判決例のように実施可能要件の例に従うのか、それとも、両観点ともに満たしていることを要するのか、はたまた、前記プレガバリン事件の一部の判決のように、補正の新規事項の追加に該当しないことの必要条件に実施可能要件も求められるのなら、そのような二つの観点のどちらだと議論すること自体無意味なのか・・・、医薬用途発明におけるこれら関係性については依然として判然と整理しきれていないように思う。
何れにせよ、医薬用途発明における試験例(例えば薬理試験データ)補充型の優先権主張をする場合には、その基礎となる出願に基づく優先権の効果が認められるのかどうか、すなわち、基礎出願にはその発明の「効果が実質的に記載されていると認められる」のかについて注意する必要がある。
今回、裁判所が「医薬用途発明」の優先権の効果について判示した部分は、個別事例とはいえ、今後の同様な「医薬用途発明」の優先権の効果を争点とした裁判に有用な示唆を与えるものかもしれない。
(2)臨床試験結果を頼りにする医薬用途発明の出願タイミングのジレンマ
優先権の効果が認められず、その結果、特許が無効となる一番の理由は、先の出願と後の出願との間に特許発明の新規性や進歩性を失わせる刊行物が公表されたことによるものであろう。
参考:

要は、発明の効果を実質的に記載して基礎出願するか、発明に関連した内容を世間に公表したいなら、公表前に、特許取得したい発明の効果まで十分に記載して基礎出願すればいいってことじゃない?

ピポ先輩。医薬品開発の実態を考えると、医薬用途発明についてはそう簡単な話では済まない場合がありますよ。
臨床試験を実施する者(企業)には、公衆衛生上の利益として臨床試験の透明性を約束するため、臨床試験情報について自由にアクセス可能なインターネット上の登録簿に一定の臨床試験情報を、決められた時期までに、登録し公開することが求められている。この登録・公開は、臨床試験の結果が得られてから初めて行うものではなく、試験を開始する時点から求められている。つまり、臨床試験に関する一定の情報は開始段階で公開される。
臨床試験の結果を頼りにして「医薬用途発明」(新たな効能・効果または用法・用量など)を特許出願したい場合に、本件のように、効果の記載がないことを理由に基礎出願に基づく優先権の効果が認められないとしたら、その出願のベストなタイミングはいつなのだろうか。

臨床試験の登録公開という手続きによって、特許を取得したいかもしれない医薬用途発明に関連した内容が試験結果を得る前に公開されるため、その公開前に、結果(効果)を記載せずに出願しておくかどうか、頭を抱える問題が生じます。

・・・
例えば、臨床試験の結果を頼りとする「医薬用途発明」において、臨床試験情報を試験開始時にClinicalTrials.gov等に登録公開する前に、臨床試験内容をまず出願(先の出願)しておき、臨床試験結果が得られてからその発明の効果を裏付ける試験データを盛り込んだうえで先の出願に基づく優先権を主張して出願する(ほとんどの場合、優先権を主張できる1年以内で結果が出ることは稀だろうが)といった手法は、優先権の効果が認められず、優先権を主張する前に試験情報が登録公開されてしまえば、新規性又は進歩性を否定されるかもしれないことに注意が必要である。
先の出願に医薬用途発明の概念が「文言」として試験方法とともに記載されていたとしても、試験データが記載されていなければその医薬用途発明が実施可能とはいえないことを理由に優先権の効果が認められない可能性があるからである。
「とりあえず情報公開する前に出願だけはしておいて、後で試験データ整ったら追加記載する優先権主張出願することにしよう」・・・と考えるのは、医薬用途発明では極めて危険であるといえる。

結果(効果)が十分揃うまで出願を待っていたら、その前の臨床試験開始時の登録公開によって、発明の新規性や進歩性を失いかねないよ・・・。

ピポ先輩、腕の見せ所ですよ!
日本だけでなく、どの国の市場が一番重要か、その国での新規性、進歩性、優先権、記載要件や、特許取得可能な製品保護の観点やジェネリック対策への効果、臨床試験の登録公開等の内容やタイミング、開発状況やスケジュール、製品保護する他の特許との関係、ライバル会社の状況など、他にもまだまだ考えることがあるかもしれないです。
知恵を絞って、ベストな選択を提案しましょうよ、ピポ先輩!

そだねー。
参考:
- 臨床試験の結果を頼りとする特許出願のタイミングについてコメントした記事「2021.06.29 「EAファーマ v. 沢井製薬・大原薬品工業」 知財高裁令和2年(行ケ)10094」
4.引用文献(甲6)は発明者による投稿論文
本件で、引用文献として考慮すべきであると原告グリーンクロスが主張した甲6(「INTRATHECAL DELIVERY OF PROTEIN THERAPEUTICS TO TREAT GENETIC DISEASES INVOLVING THE CNS 」 INJECTABLE DRUG DELIVERY 2010: FORMULATIONS FOCUS, Issue No.19, pages 16-20 URL https://www.ondrugdelivery.com/wp-content/uploads/2018/11/May2010.pdf)の著者であるZahra Shahrokh博士、Perry Calias博士及びLawrence Charnas博士の3名は、シャイアーに所属していた研究者であり、本件特許に係る発明者である。
幸い、本件発明の「ICT投与」という特徴が決め手となり、日本では、甲6に基づく進歩性の欠如を主張したグリーンクロスの無効理由は認められず、シャイアーにとっては事無きを得た。
とはいえ、やはり、発明者自身による投稿論文発表のタイミングや内容については、本件のように、第三者に格好の無効理由となり得る攻撃材料を与えることになるため、ほころびが出ないように出願人としては出願前に慎重に対応策を検討しておく必要がある。
本件のように、医薬用途発明の優先権の主張の効果には一定のハードルがあること、そのハードルの高さは当時の技術常識レベルや「実質的」な効果の記載という”ゆらぎ”によって若干上下することがあるかもしれないことも踏まえれば、医薬用途発明を様々な観点で捉えるために優先権主張を積み重ねようとしている最中に、論文発表による新規性喪失の回避策として、単純に優先権主張に頼りすぎることは大きなリスクが伴うかもしれない。
出願人又は発明者自らの発表は、社内で調整できることがほとんどであろうから、特許無効(事業リスク)を生むような発表について、知財部門は極めて厳しく且つ慎重に社内関係部門に働きかける必要がある。

そだねー。
5.欧州特許に対する異議申立て・・・EPO異議部の判断は?
本件出願の由来となったPCT出願(PCT/US2011/041924)からの欧州特許出願ファミリーのひとつである欧州特許EP3103469B1に対して、グリーンクロスは、2021年9月9日に、本件と同様の無効理由を主張して異議申立てを欧州特許庁に提出している。
2023年6月5日及び6日に口頭審理が開催され、同欧州特許は以下の理由で無効であると判断されたようである。
“The European patent is revoked because, account being taken of the amendments made by the patent proprietor during opposition proceedings, the patent and the invention to which it relates were found not to meet the requirements of the EPC (Art. 101(3)(b) EPC).”

シャイアーは、「本補正の文言上の根拠(textual basis)は、出願時の明細書にある」と主張してたようだね・・・。
6.発明者・・・PCT出願時の大きな修正、また修正
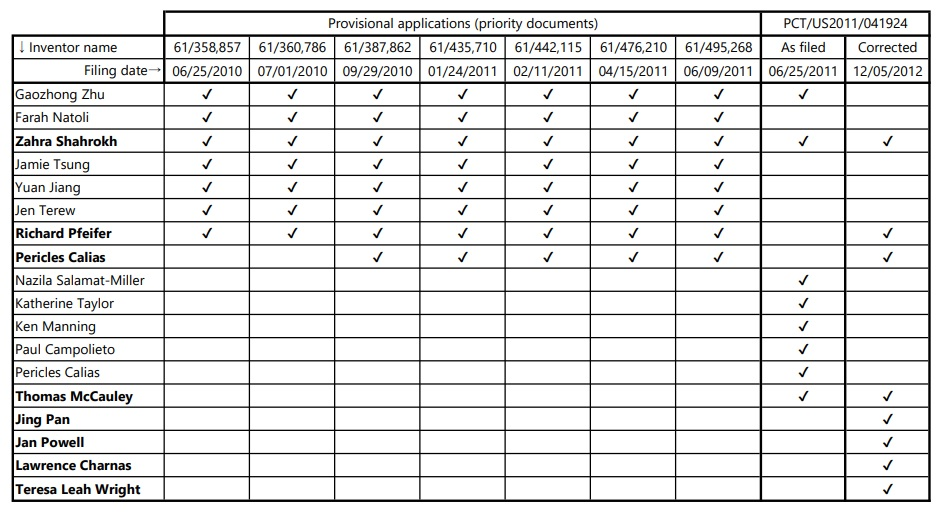
基礎出願と本件出願の由来となったPCT出願(PCT/US2011/041924)の書誌事項を見比べていて気付いたことであるが、7つの基礎出願(米国仮出願)にそれぞれリストされた発明者と、それらの優先権を主張して出願された当初当該PCT出願にリストされた発明者は、大きく異なる(下表)。
さらに、本件出願に係るPCT出願PCT/US2011/041924が出願された後にそれら発明者のリストは正しい発明者のリストに大幅に補正された(2012年12月5日 Request for Change under Rule 92bis)。
当初当該PCT出願のクレームは、本件出願に係る特許のクレーム(脳室内(ICV)投与を特徴とするクレーム)に比べて広く、髄腔内(IT)投与を中心としたクレームセットであった。
米国仮出願である基礎出願1(61/358,857)、基礎出願2(61/360,786)、基礎出願3(61/387,862)、基礎出願4(61/435,710)、基礎出願5(61/442,115)、基礎出願6(61/476,210)及び基礎出願7(61/495,268)に基づいて優先権を主張したPCT出願は、本件出願に係るPCT/US2011/041924(WO/2011/163648)の他に、実は、PCT/US2011/41922(WO/2011/163647)、PCT/US2011/41925(WO/2011/163649)(知財高裁令和4年(行ケ)10022事件の特許第6522072号に繋がる)、PCT/US2011/41926(WO/2011/163650)、PCT/US2011/41927(WO/2011/163651)及びPCT/US2011/41928(WO/2011/163652)があり、これらの出願範囲の整理とともに、どの出願に係る発明にどの発明者が該当するのか、発明者リストも整理されたようである。
しかし、本件出願に係るPCT出願PCT/US2011/041924が出願された後に発明者リストが大幅に補正されたことから、発明者どうしの調整が出願時までに簡単には進まなかったことが伺える。
なお、本件で、引用文献として考慮すべきであると原告グリーンクロスが主張した甲6の著者であるZahra Shahrokh博士、Perry Calias博士及びLawrence Charnas博士の3名も、本件出願(当該PCT出願)に係る発明者である。
甲6著者のPerry Calias博士の名前は、当初当該PCT出願の発明者リストに無く、Lawrence Charnas博士の名前は、当初当該PCT出願だけでなく基礎出願の発明者リストにも無かったが、最終的に発明者リストに加えられた。

発明者の大幅な修正が出願後にも行われたことは普通ではない感じ。何かあったのかな。
7.分割出願ファミリー・・・無効審判請求されたのは本件出願のみ
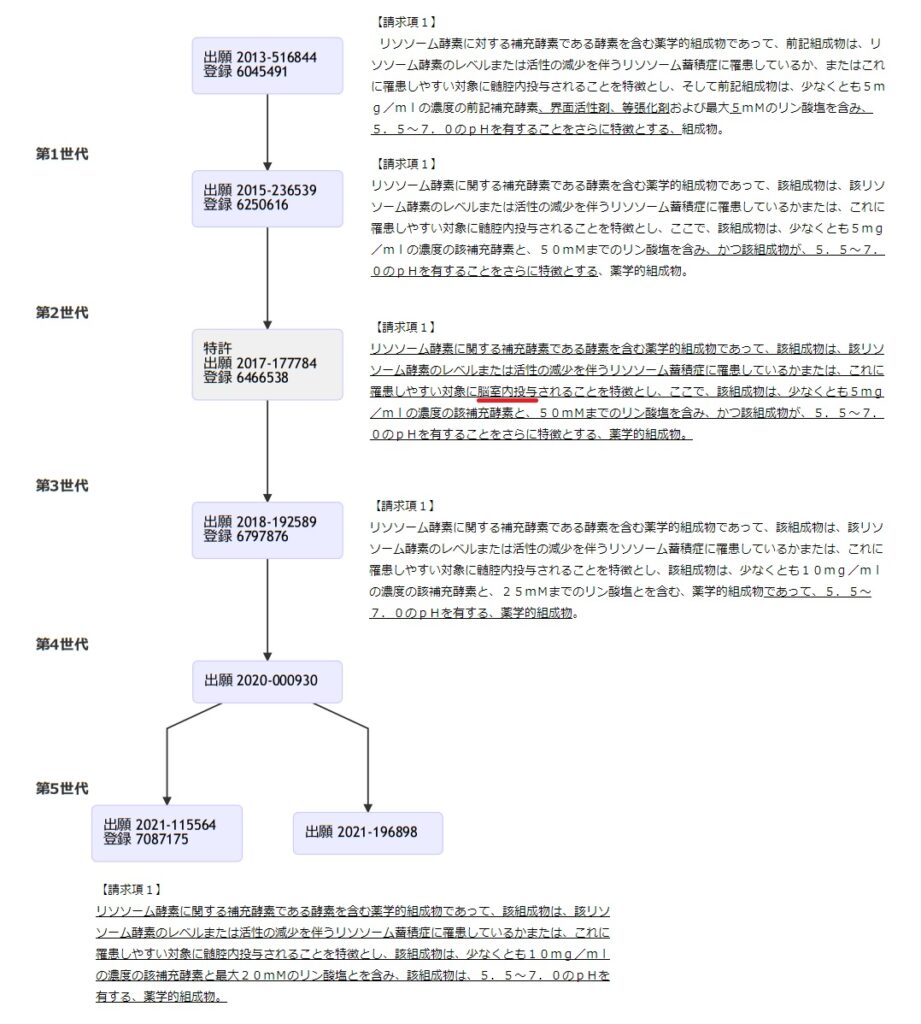
本件発明に係る特許第6466538号となった本件出願(特願2017-177784号)は、2011年6月25日を国際出願日とする特許出願(特願2013-516844号)の一部を新たな特許分割出願として2015年12月3日にされた特許出願(特願2015-236539号)の一部を新たな特許分割出願としたものである。
本件出願は、以下のツリーで示されているように複数の分割出願とそれらの特許で構成されたファミリーのひとつであるが、登録された特許において、「脳室内(ICV)投与」を構成要件とするものは本件出願に係る特許第6466538号のみであり、その他は「髄腔内(IT)投与」を構成要件とするものである。
原告グリーンクロスが無効審判を請求している対象は、この分割出願ファミリーの中では本件特許第6466538号のみである。つまり、グリーンクロスにとっては、「脳室内(ICV)投与」を構成要件とする特許のみが関心の的であったことがわかる。

グリーンクロスは、なぜ「脳室内(ICV)投与」を構成要件とする特許の無効を求めて審判請求を行ったのでしょうか・・・。
8.グリーンクロスとシャイアーとのライバル関係という背景
グリーンクロスによって開発されたイズロン酸-2-スルファターゼの脳室内投与製剤(ヒュンタラーゼ®脳室内注射液)は、クリニジェン株式会社(以下、「クリニジェン」)によって世界に先駆けて日本で「ムコ多糖症II型治療剤」として承認された。
グリーンクロスは、シャイアーの本件特許がヒュンタラーゼ®脳室内注射液の日本での販売の障壁になる可能性があるかもしれないと、問題視しているのかもしれない。
シャイアーは、ヒュンタラーゼ®と同じムコ多糖症II型治療剤であるイズロン酸-2-スルファターゼ製剤「エラプレース®点滴静注液」を開発した企業である。

つまり、グリーンクロスとシャイアーとは、投与経路は異なるけど、ムコ多糖症II型患者に投与するイズロン酸-2-スルファターゼ製剤においてライバル関係になるね。
もう少し、両製品の詳細を紹介する。
(1)ヒュンタラーゼ®脳室内注射液15mg
「ヒュンタラーゼ®脳室内注射液15mg(Hunterase®ICV Injection 15mg)」(一般名:イデュルスルファーゼ ベータ Idursulfase beta(遺伝子組換え) )は、チャイニーズハムスター卵巣細胞で産生された遺伝子組換えヒトイズロン酸-2-スルファターゼを有効成分として含有する、ムコ多糖症II型(ハンター症候群)に対する酵素補充療法に使用される世界で初めての脳室内投与製剤である。
このイデュルスルファーゼ ベータの脳室内投与製剤は、グリーンクロス(現・GC Biopharma、本社:大韓民国、旧名称:GC Pharma、Green Cross Corporation)によって開発され、2021年1月22日、クリニジェンによって、世界に先駆けて日本で製造販売承認された。
なお、本剤は、2020年3月17日付で希少疾病用医薬品として指定されており、再審査期間は10年(2021年1月22日~2031年1月21日)である。
参考:
- 2019.04.04 クリニジェン press release: クリニジェンと GC Pharma がハンター症候群治療薬イデュルスルファーゼ ベータ脳室内投与製剤の日本における開発・販売ライセンス契約を締結
- 2019.04.04 GC Biopharma press release: Clinigen K.K. and GC Pharma Announce Japan Licensing Agreement
- 2020.04.01 Clinigen press release: Clinigen and GC Pharma collaboratively submit New Drug Application for Hunterase (Idursulfase-beta) ICV in Japan
- 2021.01.22 クリニジェン press release: ムコ多糖症II型(ハンター症候群)治療薬 ヒュンタラーゼ脳室内注射液 15mg(一般名:イデュルスルファーゼ ベータ(遺伝子組換え)) 国内における製造販売承認取得
- 2021.01.22 GC Biopharma press release: Announcing marketing approval for Hunterase ICV Injection 15 mg, the world’s first enzyme replacement therapy for mucopolysaccharidosis type II (Hunter syndrome) administered by ICV injection
- 2021.04.26 クリニジェン press release: ムコ多糖症II型治療剤「ヒュンタラーゼ脳室内注射液15mg」新発売
- 2021.11.01: GC Pharma Announces EMA Grants Orphan Drug Designation to Hunterase ICV, The World’s First Enzyme Replacement Therapy for Mucopolysaccharidosis Type II Administered by ICV Injection
「ヒュンタラーゼ®脳室内注射液15mg」は、遺伝子組換えヒトイズロン酸-2-スルファターゼ15mg(1バイアル 1mL中)を含有し、無色澄明又はわずかに乳白色の液体であり、pHは5.5~6.5、添加剤として、塩化ナトリウム、ポリソルベート20及び注射用水を含有する。
しかし、特許第6466538号に係る本件発明に必須の構成要件である「リン酸塩」が本剤の添加剤として含まれているとの記載は、その添付文書中に見当たらない。
このように、グリーンクロスのヒュンタラーゼ®の添加剤にリン酸塩が含まれていないことを踏まえて、本件訴訟において原告グリーンクロスが本件発明の「リン酸塩」の濃度について主張している点を改めて眺め直してみると、以下のように、リン酸塩濃度の低い範囲についての実施可能要件違反、サポート要件違反及び明確性要件違反を主張していたことがわかる。
- 「リン酸塩が0~5mMの範囲において実施可能であると当業者が理解することはできない」
- 「リン酸塩濃度が低い場合・・・における熱安定性は明らかでなく・・・本件発明のリン酸塩濃度は・・・課題解決手段を反映していない」
- 「リン酸濃度の下限が特定されていないという点で、明確性要件に適合しない」
そして、知財高裁の判断を見ると、以下の抜粋のとおり、知財高裁は、本件発明は(無効ではないが)「リン酸塩を含む」組成物であると認定している。
- 「前記(2)の各実施例の記載に加え、前記(イ)及び(ウ)の記載も考慮すると、リン酸塩が0を超えて5mMまでの範囲についても、前記(3)の判断は左右されないというべきである。」(取消事由2(実施可能要件違反)について)
- 「(3) 本件明細書・・・からすると、・・・副作用をもたらされない範囲でリン酸塩を含む・・・組成物として、前記(2)の課題を解決できると当業者が認識できる発明が記載されており、本件発明1は、発明の詳細な説明に記載された発明であるといえる。・・・原告は、リン酸塩濃度が低い場合・・・における熱安定性は明らかでないなどと主張するが、それらの場合における熱安定性を裏付ける直接的な実験結果等の記載がないことから、直ちに、当業者が前記(2)の課題を解決できると認識できないということはできない。前記2(4)ア~ウで認定説示した点を考
慮しても、上記主張は、前記(3)の判断を左右するものとはいえない。 」(取消事由3(サポート要件違反)について) - 「本件特許の請求項1の文言から、本件発明1の薬学的組成物が「リン酸塩を含」むものであることは明らかで、50mMまでのリン酸塩であれば、どれほどわずかの量を含む場合であっても、本件発明1のリン酸塩に係る発明特定事項を満たすことは明確であって、リン酸塩の下限値が特定されていないことが何ら第三者に不測の損害を被らせるものでないことは明らかである。」(取消事由4(明確性要件違反)について)
従って、本件発明の組成物に含まれる「リン酸塩」の数値限定はその下限値を特定していないが、リン酸塩の濃度が0mMである(すなわちリン酸塩を含まない)組成物は本件発明の範囲外であることは、知財高裁による本件発明の認定内容からも明らかである。
「ヒュンタラーゼ®脳室内注射液15mg」がリン酸塩を含んでいないのであれば、グリーンクロスは本件特許第6466538号の存在をそれほど神経質に問題視することは無いのではないか、と考えられる。
グリーンクロスは敗訴したが、本件発明におけるリン酸塩濃度範囲について裁判所の認定を導き出せたという点で、実質的には目的を果たせたのかもしれない。

でも、まだ安心はできないね。
シャイアーの分割出願ファミリーには審査に係属している出願があるため、リン酸塩の構成要件の無い特許請求の範囲に補正又は分割出願をすることにより、ヒュンタラーゼ®をその範囲に含むような特許取得にシャイアーが挑戦してくるかもしれないことは、ヒュンタラーゼ®にとってのFTO(freedom-to-operate)リスクとして依然としてあり得ることである。
(2)エラプレース®点滴静注液6mg
エラプレース®(一般名:イデュルスルファーゼ(遺伝子組換え))は、米国 Trans Karyotic Therapies, Inc.(現 Shire Human Genetic Therapies, Inc.、本記事では「シャイアー」)によりムコ多糖症II型に対する治療薬として開発された。
「エラプレース®点滴静注液6mg」は、日本では、2006年12月に希少疾病用医薬品に指定され、「ムコ多糖症II型」を効能・効果として、2007年10月4日に承認された(サノフィ株式会社、旧ジェンザイム・ジャパン株式会社が承認を取得)。シャイアーは同剤の製造元である。
参考: エラプレース®の販売額推移:
- 希少難治性疾患における国内外の規制対応、開発企業及び周辺環境の現状及び動向調査報告書(三菱総合研究所 令和4年3月)図 2-13 URL: https://www.amed.go.jp/content/000102555.pdf
9.おわりに
本件は、どのような条件のもとで医薬用途発明の優先権の効果が認められるかについてや、組成物発明における特定成分の数値限定の下限値がない場合の記載要件の判断についてなど、特許出願実務に若干の示唆を与える内容であった点でも興味深いものであった。
また、本件は、グリーンクロス(ヒュンタラーゼ®)とシャイアー(エラプレース®)とのライバル関係を背景として起きた訴訟であり、その紛争は、シャイアーの分割出願戦略や、並行して進んでいる欧州での異議申立てにおいても見られるとおり、日本に限らず、世界的な特許紛争にさらに発展しそうな様相を呈している。
シャイアー側からの攻めに対してグリーンクロス側(ヒュンタラーゼ®)がどのように対抗していくか、両陣営の攻防を引き続き見守りたい。


コメント