ゾレドロン酸の投与時間を5分から15分にする動機付けは認められない: 知財高裁平成26年(行ケ)10045
【背景】
「骨代謝疾患の処置のための医薬の製造のための,ゾレドロネートの使用」に関する特許出願(特願2001-585739; WO2001/089494; 特表2004-501104)の拒絶審決(不服2013-7030)取消訴訟。
請求項1(本願発明):
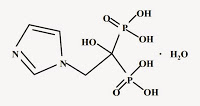
2-(イミダゾル-1-イル)-1-ヒドロキシエタン-1,1-ジホスホン酸(ゾレドロン酸)又はその薬学的に許容される塩を有効成分として含む処置剤であって,ビスホスホネート処置を必要とする患者に4mgのゾレドロン酸を15分間かけて静脈内投与することを特徴とする処置剤。
争点は進歩性。本願発明と引用例1に記載された引用発明との相違点は、引用発明では「5分間」であるのに対し、本願発明では「15分間」である点だった。
【要旨】
主 文
特許庁が不服2013-7030号事件について平成25年9月30日にした審決を取り消す。(他略)
裁判所の判断(抜粋)
取消事由1(相違点に係る容易想到性の判断の誤り)について
引用例1及び2に開示されたゾレドロン酸の第Ⅰ相及び第Ⅱ相臨床試験の結果によれば,ゾレドロン酸は,4mgという低用量で従来用いられていたパミドロン酸90mgに匹敵する薬効を奏し,5分間の短時間の静脈点滴で安全性が確保できるものであると理解できる。そうすると,このような臨床試験の結果からは,前記(1)記載の臨床試験の段階的性格を考慮し,第Ⅲ相試験で,当該用法用量による安全性について違った結果が生じて用法用量をより安全性の高いものに変更する可能性があることを考慮しても,第Ⅰ相及び第Ⅱ相臨床試験の段階では,安全性に疑問を呈するような結果は全く出ていないのであるから,患者の利便性や負担軽減の観点からも,引用例1及び2の記載からは,4mgのゾレドロン酸を5分間かけて点滴するとの引用発明の投与時間を更に延長する動機付けを見出すことは困難であるというべきである。
引用例3の~記載は,エチドロネート及びクロドロネートを念頭に置いたものであることは明らかである。~エチドロネート及びクロドロネートは,初期の臨床試験に用いられていた第一世代のビスホスホネートであり,至適投与方法が確立されていなかった初期の頃に,エチドロネートの短時間投与で腎障害による死亡例が報告されたことが発端となって,その後開発された種々のビスホスホネートに関しても緩徐な投与が推奨されることとなったものであるが,エチドロネートの100倍ないし1000倍の骨吸収抑制作用の薬効を有するパミドロン酸,インカドロン酸及びアレンドロン酸といった第二世代,第三世代のビスホスホネートは使用量が少量で足りることもあり,患者の利便性との兼ね合いで急速投与が検討され,パミドロン酸は1~1.5mg/分,インカドロン酸及びアレンドロン酸は10mg/30分の急速投与で安全性が確認されただけでなく,これら3つの製剤については逆に腎機能障害の改善効果の報告もあることが認められる。
このような本願優先日当時の第二世代及び第三世代のビスホスホネートの開発の経緯及び急速投与の実績からすれば,当業者としても,引用例3に記載された第一世代のビスホスホネートの急速投与による腎臓への有害事象に関する知見は,第三世代のビスホスホネートであるゾレドロン酸に直ちに当てはまるものではないと理解されるものと認められる。
そうすると,~ゾレドロン酸はパミドロン酸よりも100ないし850倍も活性が高いビスホスホネートであって,インカドロン酸及びアレンドロン酸よりもさらに骨吸収抑制作用が高く少量投与で足りることも考慮すれば,患者の利便性や負担軽減の観点からも,引用例1及び2において安全性が確認されたゾレドロン酸4mgの5分間投与という投与時間を,更に延長する動機付けがあると認めることは困難である。以上のとおり,ゾレドロン酸の急速投与については,腎臓に対する安全性が課題の一つとされ,引用例2の第Ⅰ相臨床試験でも,その点の確認が行われ,第Ⅱ相試験(引用例1)を経た上で,さらにはそれに引き続く第Ⅲ相臨床試験において,腎臓に対する安全性の関係で異なる結果が生じることも可能性としては存在したが,引用例1及び2の第Ⅰ相臨床試験,第Ⅱ相臨床試験では,4mg5分間投与で腎臓に対する安全性に疑問を呈する結果は確認されていないこと,引用例3の記載も本願優先日当時,第三世代のビスホスホネートであるゾレドロン酸に直ちに当てはまるものではないと理解されることからすると,引用例1及び2において安全性が一応確認されたゾレドロン酸4mgの5分間投与という投与時間を更に延長し,これを15分間とする動機付けがあると認めることはできない。
したがって,本願発明は,引用発明に基づき,引用例2及び3を適用して容易に発明することができたとは認められないから,原告主張の取消事由1は理由がある。
【コメント】
本件発明は、5分間投与よりも15分間投与によって臨床的な有効性を損なうことなく腎臓への安全性が改善されるという用法用量に特徴を有する医薬発明であり、まさに用法用量の観点での進歩性を知財高裁が認めた数少ない事例として参考になる。5分投与で安全性に疑問は無かったのだから、敢えて15分投与にする動機付けは無いでしょうということで、相違点に係る容易想到性の判断の誤り(取消事由1)についての原告の主張を認め、本願発明の効果に係る判断の誤りについて(取消事由2)までは判断しなかった。
ゾメタ(Zometa)®点滴静注(有効成分: ゾレドロン酸水和物(Zoledronic Acid Hydrate))はノバルティス社により創製された骨吸収抑制作用を有するビスホスホネート製剤。用法用量は、通常、成人にはゾレドロン酸として4mgを、15分以上かけて点滴静脈内投与することとなっている。現在、後発品が多数参入しているが、本件特許が成立に至れば、特許係争になることは必至であろう。そうなれば、用法用量に特徴を有する医薬発明についての特許権の権利行使の判断がどうなるのか楽しみである。
参考:
- 対応する欧州特許EP1286665B1
- 対応する米国特許US8324189B2(Orangebookにlistされている)
- 旭化成ファーマ press release: 2010.06.14 「ビスホスホネート剤「ゾレドロン酸」のライセンス契約締結について」


コメント