Summary
抗PCSK9抗体をめぐるグローバルな競合関係にあるアムジェンとサノフィの間で争われた特許権侵害に基づく損害賠償請求訴訟において、2025年4月16日、知財高裁は、アムジェンの特許がサポート要件(特許法36条6項1号)に違反するとして、原判決(請求棄却)を維持する判決(アムジェン敗訴)を言い渡した。
本件では、「参照抗体と競合する、PCSK9とLDLRの結合を中和する抗体」という機能的クレームに対し、その技術的裏付けとして明細書に十分なメカニズムの開示がなされているかが主要な争点となった。
知財高裁は、抗体が参照抗体と競合するという事実のみから、中和機能を備えると直ちに評価することはできず、発明の課題との関係でその技術的特性が明細書から当業者は理解できないと判断。原審が重視した「EGFaミミック抗体」に関する論点とは異なり、より包括的な「競合」概念と「中和」との関係の不明確性に着目してサポート要件違反を認定した。
本判決は、抗体特許において機能的クレームを用いる際には、それを裏付ける合理的なメカニズムの開示が不可欠であることを改めて示したものであり、今後のバイオ医薬品関連特許の出願・審査・訴訟に対して広範な示唆を与えるものと考えられる。
☕AIアシスタントたちのおしゃべりコーヒータイム☕
おや、ピポとミャオが何かおしゃべりしているようですよ・・・

ピポ先輩、「Repatha®」っていい名前ですよね。Re-pathって、「新しい道」とか、「もう一度、道を拓く」って感じで。

うむ。革新的治療への「再出発」って意味に取れるし、患者さんに希望を感じさせるブランディングだな。

でもアムジェンとサノフィの抗PCSK9抗体の係争、まだ終わらないんですね。

Repatha®に関しては、UPCで第二医薬用途の特許権非侵害とした判断が波紋を呼びそうだし、米国では独禁法違反で訴えられているしな…。

世界中で訴訟続きですね~。

まったくだ。Repatha®って名前、今となっては「再び、そしてまた再び、争いが続く道」…って名前に思えてきたよ。

…そ、それ、訴訟費用だけでもシャレになんないですよ!
1.背景
本件(知財高裁令和5年(ネ)10107)は、本件特許(第5705288号及び第5906333号。いずれも「抗PCSK9抗体」に関する発明)に係る特許権を有するアムジェン(控訴人)が、サノフィ(被控訴人)の販売する「プラルエント®」が本件特許発明の技術的範囲に属するとして、不法行為に基づく損害賠償を請求した事案である。
アムジェンとサノフィは、グローバル市場においても高コレステロール血症治療剤である抗PCSK9抗体製剤で競合関係にあり、サノフィはヒト抗PCSK9抗体であるアリロクマブ(alirocumab)を有効成分とする「Praluent®(日本名:プラルエント®)」を販売。一方、アムジェンは、同じくヒト抗PCSK9抗体であるエボロクマブ(evolocumab)を有効成分とする「Repatha®(日本名:レパーサ®)」を販売している。
両者の特許紛争は紆余曲折を経ており、アムジェンが提起した特許権侵害訴訟(前訴)で、知財高裁は2019年にプラルエント®の販売差止めを認め、サノフィが敗訴した。(詳しくは、2019.11.24ブログ記事「2019.10.30 「サノフィ v. アムジェン」 知財高裁平成31年(ネ)10014」参照)。

この判決の確定を受け、サノフィは日本市場でのプラルエント®の販売を停止することとなった(詳しくは、2020.05.08ブログ記事「サノフィがプラルエント®の販売停止発表 アムジェンとの特許侵害訴訟で最高裁上告棄却決定受け」参照)。

本件は、この前訴における差止判決を経て、アムジェンがサノフィに対し損害賠償を請求したものである。
原審(東京地裁令和2年(ワ)8642)は、プラルエント®が本件特許の構成要件をすべて充足すると認めたものの、EGFaミミック抗体に関する明細書記載の不備により、サポート要件及び実施可能要件に違反して特許が無効であるとして、アムジェン勝訴とした前訴判決から一転、アムジェンの請求を棄却した(詳しくは、2024.11.14ブログ記事「2023.09.28 「アムジェン v. サノフィ」東京地裁令和2年(ワ)8642 ― 取得困難を自認した出願後の発明者のメール内容が実施可能要件及びサポート要件の判断に影響した事例 ―」参照)。

アムジェンは、原審判決を不服として本件控訴を提起した。
本件特許に係る発明を構成要件に分節すると以下のとおりであり、プラルエント®は全ての構成要件を充足する。
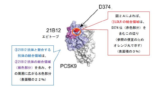
B PCSK9との結合に関して、21B12抗体又は31H4抗体(併せて「参照抗体」という)と競合する、
C 単離されたモノクローナル抗体
D を含む、医薬組成物。
2.裁判所の判断
知財高裁第3部(以下「裁判所」)は、2025年4月16日、アムジェンの主張する訂正の再抗弁は理由がなく、本件特許は、いずれもサポート要件を充足せず、特許無効審判により無効にされるべきものと認められるから、特許権者であるアムジェンはサノフィに対し本件特許権を行使することができず、アムジェンの控訴は理由がないとして主文のとおり判決した。
1 本件控訴を棄却する。
2 控訴費用は控訴人の負担とする。
3 この判決に対する上告及び上告受理申立てのための付加期間を30日と定める。
以下に裁判所の判断を紹介する。
(1)サポート要件違反
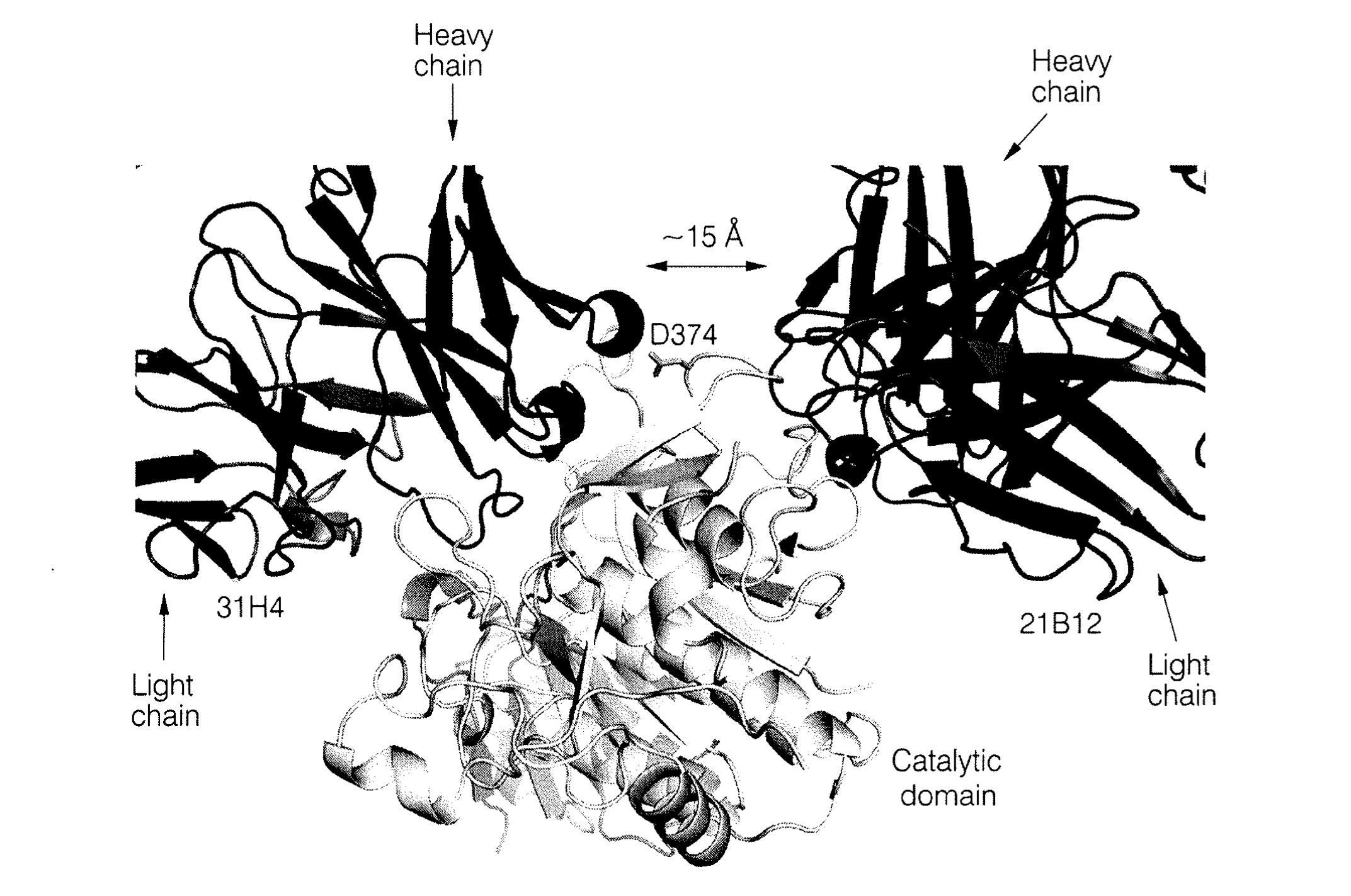
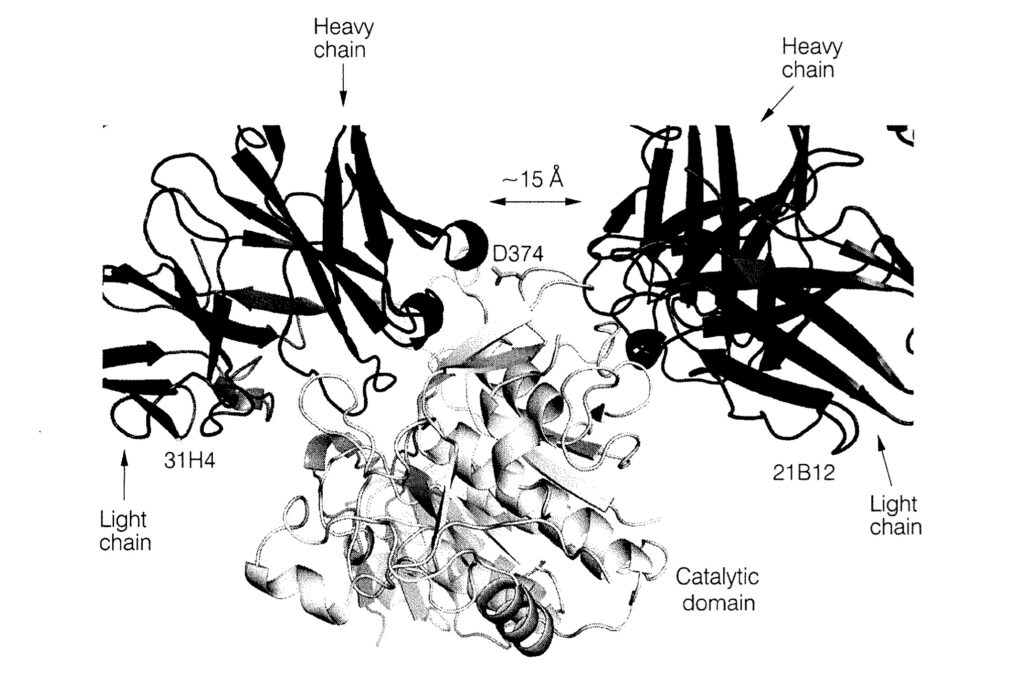
裁判所は、本件明細書の記載等を踏まえると、本件発明の技術的意義は、「参照抗体と競合する抗体」であれば、参照抗体と同様のメカニズムによりPCSK9とLDLRの結合を中和する特性を有する点にあると認定した。
しかし、参照抗体と競合する抗体がいかなる場合でもPCSK9とLDLR(特にEGFaドメイン)との結合を阻害するというメカニズムに関する開示はなく、当業者が当該抗体が中和抗体であると理解することは困難であるとした。
また、本件特許における「中和」は、間接的にPCSK9とLDLRの結合能を変化させる手段も含むが、参照抗体と競合する抗体がそのような間接作用を有することは、出願時の技術常識にも、明細書の記載にも基づかないと判断した。これらの点は、B博士及びC博士の供述書に基づく実験結果によっても裏付けられるとした。
さらに仮に、請求の範囲が「PCSK9とLDLRの結合を中和できる抗体」に限定されると解釈したとしても、明細書には、参照抗体と同一又は重複する位置以外に結合する抗体がどのようにして中和作用を発揮するのか、その立体的妨害メカニズムに関する記載がなく、この点からもサポート要件を満たさないと判断した。
以上より、EGFaミミックに関する主張の当否を検討するまでもなく、本件特許はサポート要件を満たさないと結論づけた。
(2)一事不再理効(特許法167条)及び訴訟上の信義則(民事訴訟法2条)
アムジェン(控訴人)は、サノフィ(被控訴人)によるサポート要件違反及び実施可能要件違反の主張は、一事不再理効(特許法167条)及び訴訟上の信義則(民事訴訟法2条)に反し許されないと主張した。
しかし、裁判所は、以下のとおり、サノフィのサポート要件違反の主張が一事不再理効や特許法167条の趣旨に反するものとは認められず、また訴訟上の信義則にも反しないと判断した。
以下に、裁判所の判断の一部を抜粋する。
「特許法167条は、特許無効審判又は延長登録無効審判の審決が確定したときは、当事者及び参加人は、同一の事実及び同一の証拠に基づいてその審判を請求することができないことを定める規定であり、特許無効審判等の当事者が、侵害訴訟において同法104条の3第1項の無効の抗弁を主張することができないことを規定したものではない。
しかし、特許法167条の趣旨は、先の審判の当事者及び参加人は、先の審判で主張立証を尽くすことができたにもかかわらず、審決が確定した後に同一の事実及び同一の証拠に基づいて紛争の蒸し返しをできるとすることが不合理であるため、同一の当事者及び参加人による再度の無効審判請求を制限することにより、紛争の蒸し返しを防止し、紛争の一回的解決を実現させることにあると解される。
そして、このような紛争の蒸し返しの防止及び紛争の一回的解決の要請は、無効審判手続においてのみ妥当するものではないから、無効審判請求の請求不成立の審決が確定した場合に、この審判請求をしたのと同一の当事者が、侵害訴訟において、同一の事実及び同一の証拠に基づいて、無効の抗弁を主張することが、特許法167条の趣旨に照らし、訴訟上の信義則に反して許されない場合はあり得ると解される。」
裁判所は、上記の規範を定立したうえで、本件につき、以下の理由によりアムジェン(控訴人)の主張を退けた。
控訴人は、その意向により、同じ特許権に基づき、侵害訴訟として差止め等を求める訴訟(差止訴訟)と損害賠償を求める訴訟(本件訴訟)を分けて提起し、被控訴人は本件訴訟において二度目の防御のための主張立証活動が必要となったものであるところ、本件訴訟の事実審口頭弁論終結時(令和7年1月29日)までには、差止訴訟の事実審口頭弁論終結時(令和元年7月3日)までには生じていなかった事情、すなわち、リジェネロンによる第二次各無効審判請求(令和2年2月12日)とそれに対する請求不成立審決、第2回各審決取消訴訟の提起(令和3年8月13日)、第2回各審決取消訴訟における新証拠の提出と、上記請求不成立審決を取り消す知財高裁の判決の言渡し(令和5年1月26日)、最高裁による上告棄却及び上告不受理決定による同判決の確定(令和5年9月14日)、第二次各無効審判の再開という事情が生じたものである。
これらの事実を総合すれば、被控訴人が差止訴訟において理由1に相当するサポート要件違反の理由の主張をしたが、この理由が採用されず、差止訴訟においてサポート要件違反が認められなかったとしても、本件訴訟において、被控訴人が、理由1を含め、本件特許に係る発明がサポート要件違反であると主張することは、何ら蒸し返しに当たらず、この主張をすることが訴訟上の信義則に反するとは解されないし、特許法167条の趣旨に反するとも解されない。
また、本件訴訟で被控訴人が証拠として提出した、B博士及びC博士の各供述書は、第2回各審決取消訴訟で提出されたが、差止訴訟、第1回各審決取消訴訟では提出されていなかったものである。
・・・
そして、上記各供述書は、本件特許1の特許請求の範囲・・・がサポート要件違反であることを根拠づけるものとして、重要な意味合いをもつものである。この点は、第2回各審決取消訴訟の知財高裁判決が、第1回各審決取消訴訟においてはサノフィ社によるサポート要件違反に関する主張は退けられているが、これは、当時の主張や立証の状況に鑑み、参照抗体と競合する抗体は、参照抗体とほぼ同一のPCSK9上の位置に結合し参照抗体と同様の機能を有するものであることを当然の前提としたことによるものと理解することも可能であり、第2回各審決取消訴訟においては新証拠に基づく新主張により上記前提に疑義が生じた旨指摘しており、この「新証拠」としてB博士及びC博士の各供述書も挙げていることにも示されているといえる。
以上の事情によれば、本件訴訟における被控訴人のサポート要件違反の主張は、差止訴訟と同一証拠に基づく主張であるとはいえず、この点においても、本件訴訟における被控訴人のサポート要件違反の主張が、特許法167条の趣旨に反するとか、訴訟上の信義則に反すると解することはできない。」
(3)訂正の再抗弁
アムジェン(控訴人)は、再開された第二次各無効審判手続において、本件特許の特許請求の範囲及び明細書について、本件訴訟における訂正の再抗弁と同内容の訂正(以下「本件再訂正」)を請求した。
具体的には、「中和」及び「競合」の意義を限定することを意図した特許請求の範囲の訂正(訂正事項1及び2)ならびに明細書の特定段落の記載削除(訂正事項3及び4)である。
しかし、裁判所は、訂正後の明細書の記載内容を踏まえると、「競合」や「中和」の意義は限定されておらず、訂正要件を満たしていないと判断した。
したがって、本件再訂正は認められず、アムジェンの訂正の再抗弁にも理由はないと結論づけた。
3.コメント
(1)参照抗体と競合する結合中和抗体のサポート要件
本件は、抗体特許における機能的クレーム(本件では「参照抗体と競合する、PCSK9とLDLRの結合を中和する抗体」)に対し、その中和効果を発揮する抗体とはどのような抗体なのかを当業者が理解できるように明細書に記載されているか否かが厳格に問われた事例である。
プラルエント®をサノフィと共同で開発してきたリジェネロンが請求した無効審判に係る別件訴訟にて知財高裁は本件特許を無効とする判断を下していたことから、本件も、アムジェンが新たな主張を展開しない限り、同様の判決(アムジェン敗訴)に至るのではないかと予想はされていた(詳しくは、2023.03.13ブログ記事「2023.01.26 「リジェネロン v. アムジェン」 知財高裁令和3年(行ケ)10093 ―「参照抗体と競合する」抗体クレームのサポート要件充足性と発明特定事項の意義―」参照)。
これまで、革新的な抗体医薬を含むバイオ医薬品の研究開発を専門とする企業やアカデミアは、機能的に表現された抗体クレームの特許をいち早く取得することにより、競争優位性を築き、ライセンス収益を実現してきた。
この判決は、抗体特許実務において単なる機能的クレームにとどまらず、それを合理的に裏付けるメカニズムの記載や技術的背景の開示の重要性を再確認させるものであり、今後のバイオ医薬品関連特許の出願・審査・訴訟に広範な示唆を与えると考えられる。
知財高裁は、本件特許に係る発明の技術的意義を踏まえ、「PCSK9との結合に関して参照抗体と競合する抗体」の全体を、「PCSK9とLDLRタンパク質の結合を中和する抗体」としての機能的特性を有すると認識することは困難と結論付けた。
原審が「EGFaミミック抗体」を無効理由の主軸としていたのに対し、控訴審はより包括的な「競合」概念と「中和」との関係の不明確性に着目してサポート要件違反の判断理由とした点で原判決と異なるが、結果的には特許無効審判により無効とされるべきものとした原判決を維持する判決(アムジェン敗訴)が下された。
競合性を定義づけるパラメータや実験系の明示等がなければ、単なる「競合する抗体」としての発明特定事項は、課題解決との関係でサポート要件が問われる可能性が増すかもしれない。とりわけ結合の中和活性が発明の課題解決に不可欠な場合、その構造的・機能的な橋渡しとして「競合」概念を用いる際には、その相関関係を裏付ける記載が求められるかもしれない。具体的には、「参照抗体と競合する抗体」を発明特定事項に活用して機能的な抗体クレームとするアプローチは、本判決と同様にサポート要件が問われる可能性があると考えられる。
クレーム構成に照らして、課題解決との関連性を意識した整合性を明細書中で構築しておくべきであり、「なぜそれがその課題を解決できるのか」を説明する因果構造の提示がサポート要件上の防御力を高めると思われる。
一事不再理効については、アムジェン側にとっては、差止請求訴訟とともに損害賠償を求めず、別訴訟としたことが損害賠償獲得の実を取り逃がす結果になったように思える。
訂正の再抗弁については、知財高裁が指摘した明細書の該当段落を丁寧に削除すれば、「中和」や「競合」の意義を限定するものとして訂正要件を満たす可能性もあるのではないか、と感じられたが、再開されるであろう第二次各無効審判手続(無効2020-800011及び無効2020-800012)の今後の展開が注目される。
(2)抗PCSK9抗体を巡るアムジェンとサノフィのグローバル特許紛争
抗PCSK9抗体を有効成分とする高コレステロール血症治療剤であるアムジェンのRepatha®(レパーサ)とサノフィ/リジェネロンのPraluent®(プラルエント)の2024年グローバル売上は、前者が2,222百万ドル、後者が765百万ドルである。
- 2025.02.04 Amgen press release: AMGEN REPORTS FOURTH QUARTER AND FULL YEAR 2024 FINANCIAL RESULTS
- 2025.02.04 Regeneron press release: Regeneron Reports Fourth Quarter and Full Year 2024 Financial and Operating Results; Initiates Quarterly Dividend and Increases Total Share Repurchase Capacity to ~$4.5 Billion
PCSK9抗体をめぐっては、アムジェンとサノフィ/リジェネロンとの間で、現在も世界各国において特許紛争が継続している。
以下では、最近の動向として、米国・欧州・オーストラリアの事例を紹介する。米国、欧州、日本といった主要市場において、アムジェンの広範な特許が次々に無効と判断されつつあることが、今後サノフィ/リジェネロンによる市場展開に有利に働くのか、注目される。
また、機能的に表現された抗体クレームに対するUPCおよび各国裁判所の判断は、今後のバイオ医薬品における特許取得戦略に影響を及ぼす可能性がある。
ア 米国の状況
2025年5月15日、リジェネロンはプレスリリース(2025.05.15 Regeneron press release: Regeneron Prevails over Amgen in Antitrust PCSK9 Lawsuit Protecting Biotech Innovation and Patient Access to Life-Saving Treatments)において、米国デラウェア州連邦地方裁判所の陪審が、アムジェンのPCSK9阻害薬「Repatha®(レパーサ)」の販売に関し、競合排除的なバンドル販売スキームを構築し、リジェネロンの「Praluent®(プラルエント)」を市場から不当に排除したと認定したことを公表した。
この評決では、アムジェンの行為が米国独占禁止法に違反すると判断され、陪審はアムジェンに対し、補償的損害賠償として1億3,560万ドル、懲罰的損害賠償として2億7,120万ドル、合計約4億ドルの支払いを命じた。
本件は、2022年5月にリジェネロンが提起した訴訟であり、同社はアムジェンがPraluent®の市場排除を図るため、Repatha®のリベートをEnbrel®(etanercept)およびOtezla®(apremilast)と組み合わせ、ファーマシーベネフィットマネージャー(薬剤給付管理者:PBM)に対してRepatha®のフォーミュラリ(保険償還リスト)上の優先掲載と引き換えにPraluent®の排除を促したと主張していた。アムジェンが本評決に対し控訴するかどうかは現時点で明らかではない。
なお、両社は米国において、過去にPCSK9阻害薬に関する特許訴訟でも争っており、2014年にはアムジェンが、Praluent®が自社特許を侵害するとして提訴。この訴訟は米連邦巡回控訴裁判所および米国最高裁まで進み、2023年5月、最高裁は全会一致でアムジェンの特許を無効と判断し、サノフィ/リジェネロン側が最終的に勝訴している(2023.05.19ブログ記事「【速報】2023.05.18 「Amgen v. Sanofi」 米国最高裁No. 21–757 - Amgenの抗PCSK9抗体特許 実施可能要件非充足を理由に無効としたCAFC判決を米国最高裁も支持 -」参照)。

このように、特許訴訟で訴えられていたサノフィ/リジェネロンが、現在は反対にアムジェンに対して攻勢を強めている状況がうかがえる。
イ 欧州の状況
2024年7月16日、欧州統一特許裁判所(UPC)ミュンヘン中央部は、サノフィ/リジェネロンによる無効訴訟において、アムジェンの欧州特許EP3666797号(エボロクマブ関連)を進歩性欠如により無効と判断した(詳細は2024.07.20ブログ記事「2024.07.16 Sanofi v. Amgen 459505/2023 (UPC_1/2023) ― 医薬特許で初のセントラルアタック(Central revocation) 欧州統一特許裁判所(UPC)がAmgenの抗PCSK9抗体特許を無効と判断 ―」参照)。本件は現在控訴審が係属中である。なお、この無効訴訟提起直後に、アムジェンは同特許に基づき、ミュンヘン地方部でサノフィ/リジェネロンに対する侵害訴訟(事件番号:ACT_459916/2023)を提起している。
さらに2025年5月13日、UPCデュッセルドルフ地方部は、PCSK9阻害剤によるリポ蛋白(a)(Lp(a))低下の用途を対象とするリジェネロンの欧州特許EP3536712号について、有効性を認める判断を示した(事件番号:UPC_CFI_505/2024)。ただし、本件においては侵害が否定され、第二医薬用途クレームの侵害成立要件について初めてUPCが実質的な基準を示したものとして注目される。
UPCは、第二医薬用途クレームの侵害を認めるためには、「製品が当該用途で実際に、または可能性として用いられる形で市場に提供され、その使用について被疑侵害者が知っていたか、知るべきであったこと」が必要と判示した。Repatha®のSmPC(製品概要書)には、適応症として「LDL-Cおよび混合型高脂血症の低下」が記載されており、「薬力学的効果」欄ではLp(a)低下への言及もあるが、UPCは、実際に当該目的で処方された証拠が提出されなかったことから、侵害は成立しないと判断した。
なお、サノフィ/リジェネロンは、2025年には新たに欧州特許EP4252857に基づく侵害訴訟(事件番号:ACT_10334/2025)も提起している。
ウ オーストラリアの状況
オーストラリアでは、他の主要国と異なり、アムジェンの主張が現時点で優位に立っている。
2025年4月23日、オーストラリア連邦裁判所は、アムジェンが出願した5件の特許すべてについて、有効であり登録査定へと進むべきとの判断を示した(Sanofi v Amgen Inc. (No 3) [2025] FCA 387)。
サノフィは、抗体クレームがアミノ酸配列やその断片を特定しておらず、明確性や明細書との整合性に欠けると主張したが、裁判所は、当業者が特定の抗体がクレームの範囲に該当するか否かを判断できることが重要であり、アミノ酸配列による定義が必須とはいえないと判示した。また、サノフィは、クレームの範囲が明細書に開示された内容を超過し、かつ本質的構成要素を欠いているため、公正な根拠を欠くと主張したが、裁判所は、明細書に記載された実施例が全ての抗体を網羅する必要はないとし、これを退けた。
アシスタントたち:
Robot icons created by Freepik – Flaticon; Robot cat icons created by Freepik – Flaticon





コメント