Summary
本件は、細胞傷害誘導治療剤に関する被告(中外製薬)の特許第6278598号について、無効審判を請求したところ、特許庁がその請求を不成立・却下する審決をしたため、これを不服として原告(ジェンマブ)により提起された審決取消訴訟である。
2025年9月18日、知財高裁は、本件訂正発明1について、二重特異性抗体のFcエフェクター機能を低減する手段としてFc領域にFcγ受容体結合親和性を低下させる変異を導入することは本件優先日当時の周知技術・技術常識であるから、引用発明である二重特異性抗体に同様の変異を導入することは当業者が容易に想到し得たとして、進歩性欠如(特許法29条2項)を理由に審決を取り消した。この取消事由(進歩性)のみで判決が下されたため、その余の請求項及び主張については判断されていない。
なお、本件特許の分割出願ファミリーである特許第6773929号を対象とする審決取消訴訟(知財高裁令和6年(行ケ)10074)でも、同様に進歩性欠如を理由として審決を取り消す判決が同日に言い渡されている。
これらの審決取消事件の背後には、中外製薬が、ジェンマブによる抗悪性腫瘍剤エプキンリ®皮下注(一般名:エプコリタマブ)の製造販売行為が上記特許に係る特許権を侵害しているとして、東京地裁に差止及び損害賠償を求めている訴訟が存在する。両事件の今後の審理の進展は、当該侵害訴訟の帰趨にも影響を及ぼす可能性がある。
☕AIアシスタントたちのおしゃべりコーヒータイム☕
おや、ピポとミャオがおしゃべりしてますよ・・・

ピポせんぱ〜い! 最近よく聞く“T cell engager”って何ですか? がん免疫療法の一種なんですよね?

そうそう。T cell engagerは、片方の腕でT細胞上のCD3等に、もう片方の腕でがん細胞上の抗原、たとえばCD20やBCMAに結合する二重特異的抗体が代表的だ。そうするとT細胞が活性化して、がん細胞を攻撃してくれるんだよ。

でも抗体の免疫反応が強く出すぎたら、危険じゃないですか?

いいところに気づいたね。だからT cell engagerでは、抗体のFc領域に変異を入れてFcγ受容体と結合しにくくして、余計な免疫反応(Fcエフェクター機能)を起こさないようにしているんだ。

なるほど。T細胞とがん細胞のせっかくの出会いの場に、余計なトラブルが起きないようにしてくれている感じですね。

そのとおり。それがT cell engagerのミソなんだ。だから“エンゲージャー(結合させるもの)”って呼ばれてる。まるでT細胞とがん細胞の“仲人”だな!

えー、でも結ばれた瞬間にケンカして“破局”……どころか“消滅”しますけどね。

結ばれても叶わない禁断の恋……。
1.背景
本件(知財高裁令和6年(行ケ)10073)は、発明の名称を「細胞傷害誘導治療剤」とする被告(中外製薬)の特許(第6278598号)に対し、ファイザーが無効審判(無効2022-800027号)を請求したところ、特許庁が、被告による本件訂正を認めたうえで、請求項1~18、23~25、27~70については無効審判請求を不成立とし、請求項19~22及び26については請求を却下するとの審決をしたため、無効審判の参加人であった原告(ジェンマブ )が審決の取消しを求めて提訴したものである。なお、無効審判請求人であったファイザーは、請求を取り下げている。
本件訂正発明1は以下のとおりである(下線部は本件訂正によるもの)。
【請求項1】
下記のドメイン;
(1) 癌抗原結合ドメイン、
(2) 配列番号:23に記載のFc領域を構成するアミノ酸が変異しているFc領域であって、IgG1抗体のFc領域(配列番号:23) を有するポリペプチド会合体と比較して、Fcγ受容体に対する結合活性が低下している、Fc領域
を含むドメイン、及び、
(3) T細胞受容体複合体結合ドメイン、
を含むポリペプチド会合体であって、該T細胞受容体複合体結合ドメインがFabであり、該変異しているFc領域を構成する二つのポリペプチドの配列が互いに異なる配列を有する、以下の(a)から(f)からなる群より選ばれる一のポリペプチド会合体:
((a)~(f)の記載は省略)
であり、
該Fc領域を構成するアミノ酸のうち、EUナンバリングに従って特定される265位のアスパラギン酸がアラニンに変異している、
ポリペプチド会合体。
原告が主張した本件審決取消事由は以下の4点であるが、本判決では取消事由2のみが判断対象となった。
- 取消事由1(甲2に基づく新規性・進歩性欠如に係る認定・判断の誤り)
- 取消事由2(甲10に基づく新規性・進歩性欠如に係る認定・判断の誤り)
- 取消事由3(サポート要件違反に係る判断の誤り)
- 取消事由4(実施可能要件違反に係る判断の誤り)
本件審決が認定した甲10号証(国際公開WO2010/120561)に記載された発明(以下「甲10発明」)は、「抗FcRH5アームと、CD3といったT細胞受容体分子と結合するアームとが組合された、ヒト化抗体である、全長抗体の二重特異性抗体」とされるものである。
本件訂正発明1と甲10発明との一致点及び相違点は、以下のとおりである。
一致点:
(1)癌抗原結合ドメイン、
(2)Fc領域を含むドメイン、及び、
(3)T細胞受容体複合体結合ドメイン、
を含むポリペプチド会合体であって、該T細胞受容体複合体結合ドメインがFabであり、以下の(e)からなるポリペプチド会合体:
(e)癌抗原結合ドメインを構成する一価のFabの重鎖Fv断片がCH1領域を介してFc領域を構成する一方のポリペプチドに連結され、当該Fabの軽鎖Fv断片がCL領域と連結され、T細胞受容体複合体結合ドメインを構成するFabの重鎖Fv断片がCH1領域を介してFc領域を構成する他方のポリペプチドに連結され、当該Fabの軽鎖Fv断25 片がCL領域と連結された、ポリペプチド会合体
相違点3:
本件訂正発明1では、Fc領域を含むドメインが「配列番号:23に記載のFc領域を構成するアミノ酸が変異しているFc領域であって、IgG1抗体のFc領域(配列番号:23)を有するポリペプチド会合体と比較して、Fcγ受容体に対する結合活性が低下している」ものであり、「該Fc領域を構成するアミノ酸のうち、EUナンバリングに従って特定される265位のアスパラギン酸がアラニンに変異している」のに対し、甲10発明では、上記のような特定がされていない点。
相違点4:
本件訂正発明1では、「該変異しているFc領域を構成する二つのポリペプチドの配列が互いに異なる配列を有する」のに対し、甲10発明では、上記のような特定がされていない点。
2.裁判所の判断
2025年9月18日、知財高裁第4部(以下「裁判所」)は、原告主張の取消事由2のうちの進歩性欠如の点に理由があると判断し、その余の取消事由について判断するまでもなく、原告の請求を認容して本件審決を取り消す旨の判決を言い渡した。
1 特許庁が無効2022-800027号事件について令和6年3月21日にした審決のうち、特許第6278598号の請求項1から18まで、23から25まで及び27から70までに係る部分を取り消す。
2 訴訟費用は被告の負担とする。
(1)相違点3の該当性
原告(ジェンマブ)は、相違点3(Fc領域265位のアスパラギン酸がアラニンに置換されている点、すなわちD265A変異)について、引用文献(甲10号証)には同様の改変が実質的に記載されており、新規性はないと主張した。
すなわち、甲10号証の段落【0744】に「エフェクター機能を排除するか低減することが望ましい場合、ある種の他のFc領域が用いられ得る」との記載があることから、当業者が周知技術又は技術常識を適用すれば、その「ある種の他のFc領域」にD265A変異を導入することは甲10号証に記載されているに等しいと主張した。

Fc領域のエフェクター機能(ADCC・CDC)を保持すると、FcγR発現細胞の非特異的活性化や過剰なサイトカイン放出を招くおそれがあります。T細胞依存的細胞傷害活性に作用機序を限定し、安全性と作用選択性を高める目的で、FcγRやC1q結合能を失活化したFcサイレント変異が導入されるわけです。
これに対し裁判所は、甲第10号証の段落【0744】には「ある種の他のFc領域」が用いられ得ることが記載されているのみであり、この「ある種の他のFc領域」が具体的にいかなるものであるかは明らかにされていないと指摘した。
仮に、Fc領域におけるD265A変異が当時の周知技術又は技術常識であったとしても、その「ある種の他のFc領域」として特定の変異であるD265A変異が記載されている、あるいは記載されているに等しいとまでいえないとし、原告の主張を退けた。
さらに、甲10号証が引用する文献(甲52号証)にはD265A変異の効果が記載されているものの、甲10号証本文では単に「参照されたい」と言及するにとどまっていることから、その文献を確認しなければ把握することができないような具体的かつ特定の技術的事項(D265Aの効果)までもが甲10号証自体の記載された事項であるとは到底いえないと判断した。
したがって、裁判所は、本件審決が認定した相違点3(D265A変異の導入)は認められると結論づけた。

甲10発明と本件訂正発明1との間に相違点3がある(同一ではない)=甲10発明で本件訂正発明1の新規性を否定することはできない…ということになりますね。でもこの相違点について進歩性はどう判断されたかというと…(後述)
(2)相違点4は相違点か
相違点4(本件訂正発明1では、「該変異しているFc領域を構成する二つのポリペプチドの配列が互いに異なる配列を有する」のに対し、甲10発明では、上記のような特定がされていない点)について、裁判所は、本件審決の認定は誤りであると判断した。
具体的には、甲10号証の請求項195、段落【0423】【0922】、及び実施例11等には、「ヘテロ接合体抗体も、本発明の範囲内である」との記載があり、二重特異性抗体を形成するために、片方の重鎖に「隆起(knob)」、もう一方の重鎖に「空洞(hole)」を導入する突然変異を誘発する手法(Knob-into-Hole戦略)が具体的に説明されている。
これらの記載に基づき、裁判所は、甲10発明にはFc領域を構成する二つのポリペプチドの配列が互いに異なる配列を有する二重特異性抗体(空洞への隆起(protruberanco-into-cavity)抗体)が開示されていると認定した。
したがって、裁判所は、本件審決が相違点4を相違点として認定したのは誤りであり、当該構成に差異はないと判断した。
(3)相違点3の容易想到性
裁判所は、抗体のFcエフェクター機能を低減する手段として、大腸菌で発現させることやFc領域にFcγ受容体結合親和性を低下させる変異が、本件優先日当時には周知技術・技術常識であり、Fc領域のD265A変異は、Fcγ受容体結合能を低下させる変異として、複数の文献・特許により当業者に周知であったと指摘し、エフェクター機能を必要としない二重特異性抗体(甲10発明)にD265A変異を導入することは当業者が容易に想到し得たと判断した。
また、本件明細書には、D265A変異を導入した二重特異性抗体の調製例や効果を確認したことは全く記載されていないから、本件訂正発明1が予測できない顕著な効果を奏するとも認められないとした。
したがって、裁判所は、本件訂正発明1は進歩性を欠き、特許法29条2項により特許を受けることができないとして、本件審決を取り消す判決を下した。
3.コメント
(1)本件特許の国際的状況
本件特許は、国際出願PCT/JP2011/077603(国際公開WO2012/073985)に基づくものであり、そのファミリーとして米国ではUS11,066,483B2、欧州ではEP2647707B1が登録された。
もっとも、当該欧州特許については、(1) Janssen Biotech, Inc.、(2) Boehringer Ingelheim RCV GmbH & Co KG /Boehringer Ingelheim International GmbH、(3) James Poole Limited、(4) Mathys & Squire LLP、(5) Genmab A/Sの5者により異議申立てが行われた。
欧州特許庁異議部は、異議申立人らの主張を認め、特許を新規性欠如等の理由で無効と判断した。これに対し中外製薬は、この決定を不服として上訴したが、特許付与テキスト(請求項・明細書)をもはや承認せず補助的修正案(auxiliary request)も提出しない旨を表明したため、欧州特許庁審判部は2023年7月11日付で上訴を却下し、結果的に特許は失効した(T 0820/21)。
しかし、欧州では現時点で分割出願ファミリーの出願群(EP3434767、EP4279511、EP4279512、EP4279513、EP4303236、EP4303237)がまだ審査に係属している。特に、EP3434767は、2025年10月21日付で特許許可通知が発出されたところであり、前述の親特許EP2647707B1と類似の請求項を有していそうである。そして同年11月10日、Third Party Observationsが提出されている。
親特許が審判部で無効とされる可能性が高まるとその特許を戦略的に取り下げることによって欧州特許庁による無効決定が他の分割特許に「ドミノ倒し」的な影響を与えるのを防ぎ、結果として、競合医薬品企業が複数の分割特許に対して繰り返し法的異議を申し立てざるを得なくなるような状況を作り出す戦術は、法的な不確実性を長期化させることにより競合医薬品の市場参入を妨害するための優越的地位の濫用であるとされる可能性がある(2024.11.04ブログ記事「欧州委員会がTeva社に制裁金 多発性硬化症治療薬コパキソンの分割出願制度濫用と競合製品への誹謗中傷行為を理由に」(『医薬系特許的判例ブログ年報 2024』 Fubuki著 2025年3月発行, p293-297)参照)。このリスクについては中外製薬も当然に注意を払って手続きを進めているものと想像される。
以上のとおり、本件特許に係る発明は、日本のみならず欧州でもその特許性が争われている。
本件では、本件特許第6278598号の本件訂正発明1において、Fc領域にFcγ受容体結合能を低下させる変異(D265A変異)を導入することの容易想到性が主要な争点となった。裁判所は、当該訂正発明1は進歩性を欠き、特許法29条2項により特許を受けることができないと判断した。
もっとも、判決は本件訂正発明1のみに関するものであり、その余の請求項及び主張については判断していない。今後は審判(特許庁)に差し戻され、残る請求項の特許性が改めて審理される予定である。その行方に注目したい。
なお、本件特許に対しては、アッヴィによる無効審判(無効2025-800001号)も請求され審判に係属している。
(2)もうひとつの審決取消請求事件
本件特許の分割出願ファミリーの特許第6773929号(Fc領域の234位及び235位に変異を導入してFcγ受容体結合能を低下させた抗体)についても、同様の争点が問題となった。
同特許を対象とする無効審判(無効2022-800030号)の審決取消請求事件(知財高裁令和6年(行ケ)10074)において、裁判所(知財高裁第4部)は原告(ジェンマブ)の進歩性欠如の主張を認め、本件判決と同日に審決を取り消す判決を言い渡した。
裁判所は、訂正発明1と甲11号証発明(本件での甲10号証:国際公開WO2010/120561に相当)との相違点のうち、
- 相違点4(「Fc領域を構成する2本のポリペプチド配列が異なる」点)は実質的な相違ではないと判断し、
- 相違点3(234位及び235位の変異の有無)については、抗体における Fcエフェクター機能を低減させるための手段として、これらの変異導入が当時の当業者にとって周知慣用の技術常識であったと認定した。
そして、エフェクター機能を必要としない二重特異性抗体(甲11発明)において、そのような周知技術に基づきFc領域に変異を導入することは容易に想到し得るとし、特許法29条2項違反を理由に審決を取り消した。
この特許第6773929号についても、アッヴィによる無効審判(無効2025-800002号)が請求され審判に係属している。
(3)中外製薬の二重特異性抗体製品
中外製薬の製品のうち、がん抗原とT細胞受容体複合体の双方に結合し、Fc領域に変異を導入してFcγ受容体結合能を低下させた二重特異性抗体を有効成分とする抗腫瘍剤としては、「ルンスミオ®(有効成分:モスネツズマブ)」及び「Columvi®(有効成分:glofitamab)」(日本では未承認)が挙げられる。
ルンスミオ®(有効成分:モスネツズマブ)
中外製薬は、B細胞上のCD20とT細胞上のCD3を標的とする抗CD20/CD3ヒト化二重特異性モノクローナル抗体であるモスネツズマブを有効成分とする「ルンスミオ®点滴静注」について、2024年12月27日、「再発又は難治性の濾胞性リンパ腫」を効能・効果として国内承認を取得した。
モスネツズマブは、抗原結合部位(Fab)領域がT細胞受容体複合体のCD3及びB細胞性腫瘍の表面抗原CD20の細胞外ドメインに同時に結合することにより、細胞傷害性T細胞を介した免疫応答を活性化し、CD20陽性腫瘍細胞に対して抗腫瘍効果を発揮すると考えられている。
審査報告書(2024年12月27日)及び申請資料概要(品質に関する概括評価)によれば、Fcエフェクター機能の抑制等を目的として、抗CD20-H鎖のFc領域に2箇所(N302G、T371W)、抗CD3ε-H鎖のFc領域に4箇所(N299G、T368S、L370A、Y409V)の変異が導入されている。
本件特許第6278598号に係る発明は、癌抗原とT細胞受容体複合体に結合し、Fc領域に変異を導入してFcγ受容体結合能を低下させた二重特異性抗体を包含し得るが、当該変異をD265A変異に限定している。このため、モスネツズマブのように異なる部位に変異を導入した抗体は、当該特許には包含されないと考えられる。
なお、ルンスミオ®の承認に基づき延長登録が出願された特許群(特許第7579481号、特許第7402381号、特許6449295号)にも、本件特許は含まれていない。
Columvi®(有効成分:glofitamab)
中外製薬は、Homann-La Roche社が創製した抗CD20/CD3二重特異性抗体glofitamab(開発コード:RG6026)の国内開発を進めており、想定適応症は初発大細胞型B細胞リンパ腫である。欧米では製品名Columvi®として既に承認されている。
FDA公表資料によると、glofitamabはFcエフェクター機能の抑制を目的として、Fc領域の3箇所(P329G, L234A, L235A)に変異が導入されている。
glofitamabは、Fc領域の234位及び235位の変異によりFcγ受容体結合能を低下させた抗体であることから、本件特許の分割出願ファミリーである特許第6773929号(Fc領域の234位及び235位に変異を導入してFcγ受容体結合能を低下させた抗体)に包含される可能性がある。しかし、glofitamabの承認に基づく英国のSupplementary Protection Certificate(SPC/GB23/033)を確認すると、欧州特許EP3177643に基づいて手続が進められており、日本における対応特許は特許第6464255号である。このことから、glofitamabに関しては後者の特許が本命であると考えられる。
以上より、本件特許及びその分割ファミリーは、中外製薬の具体的な製品を直接的に保護するというよりも、競合他社による同様の二重特異性抗体開発を牽制する戦略的特許としての性格が強いと考えられる。
(4)エプキンリ®を巡る特許紛争の存在
ア 特許権侵害訴訟が係属
前述の別件同日判決を含む本件の背後には、抗悪性腫瘍剤エプキンリ®皮下注(一般名:エプコリタマブ) に関する特許紛争が存在する。
中外製薬は、ジェンマブによるエプキンリ®の製造販売行為が、自社保有の特許権を侵害しているとして、東京地裁に差止及び損害賠償を求める訴訟を提起している。
ジェンマブの2025年8月7日付プレスリリース(Genmab Announces Financial Results for the First Half of 2025)によれば、
“In 2024, Chugai filed a lawsuit in the Tokyo District Court, Japan against AbbVie’s and Genmab’s subsidiaries in Japan asserting that their activities with EPKINLY (epcoritamab) in Japan infringe two Japanese patents held by Chugai, JP6278598 and JP6773929. Chugai is claiming damages and injunctive relief. Genmab and AbbVie believe that the two Japanese patents are invalid and not infringed and are vigorously defending against the lawsuit, and thus no provision has been recorded related to this matter.”
すなわち、2024年、中外製薬はアッヴィ及びジェンマブに対し、エプキンリ®に関する日本国内での活動が特許第6278598号及び第6773929号に係る特許権を侵害するとして、東京地裁に提訴した。なお、特許第6278598号は、本件でジェンマブが無効を主張した特許にあたる。そして、特許第6773929号は、もうひとつの審決取消請求事件で争われた特許にあたる。

本件の特許無効の争いの裏には中外製薬とジェンマブ/アッヴィとの間での特許権侵害訴訟が勃発していたのですね。
イ エプキンリ®(エプコリタマブ)の概要
エプキンリ®皮下注は、ジェンマブが開発したDuoBody®技術に基づき作製されたCD3及びCD20を標的とする二重特異性モノクローナル抗体(遺伝子組換え抗体)であるエプコリタマブ(Epcoritamab)を有効成分とする抗悪性腫瘍剤である。
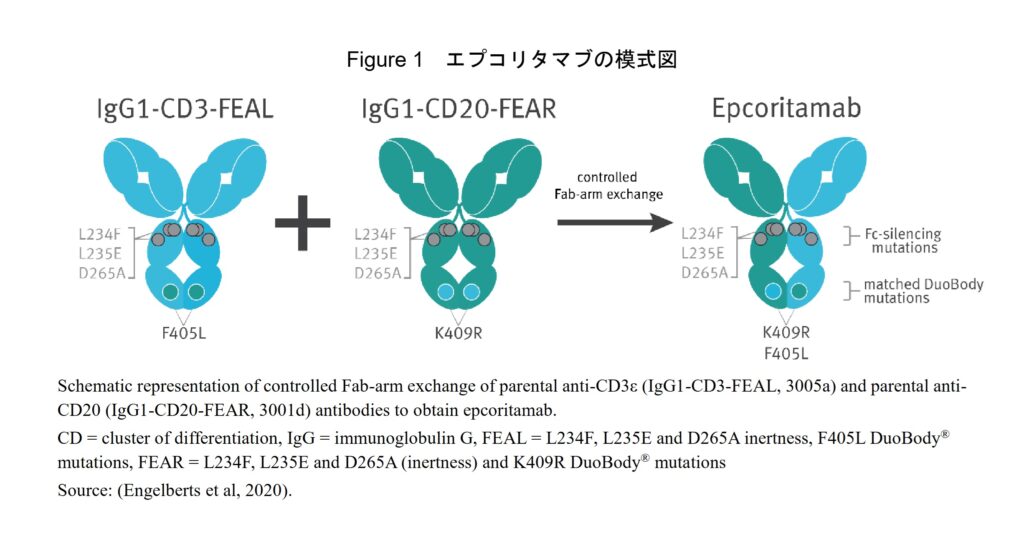
抗CD3抗体及び抗CD20抗体の可変ドメイン配列は、DuoBody分子の作製に必要な重鎖定常領域(CHドメイン)の相補的変異(それぞれF405L及びK409R)を含むヒトIgG1λ及びIgG1κ骨格にそれぞれ遺伝子組換え技術を用いて導入された。親抗体のFcドメインには、L234F、L235E及びD265Aの3 箇所の変異(いわゆる不活性化変異)が導入されており、これによりIgG Fc受容体(FcγR)及び補体成分C1qとの結合が失われる一方、胎児性Fc受容体(FcRn)との結合能は保持されている。これらの改変により作成された親抗体(IgG1-CD3-FEAL及びIgG1-CD20-FEAR)を基に、制御されたFabアーム交換によりCD3及びCD20結合性の二重特異性抗体であるエプコリタマブが作成された(インタビューフォーム及び申請資料概要 5. 非臨床に関する概括評価より。下図「Figure 1 エプコリタマブの模式図」は申請資料概要(6. 非臨床概要(1)薬理, 2.6.1 緒言, p3)より)。

ジェンマブのエプコリタマブのFc領域には、Fcγ受容体結合能を低下させる変異として、L234F、L235E、D265Aのアミノ酸変異が導入されています。
ウ エプコリタマブの作用機序及び承認状況
エプコリタマブは、T細胞膜上のCD3と、B細胞性腫瘍の細胞膜上のCD20の双方に結合することで、CD20陽性腫瘍細胞をT細胞依存的に傷害すると考えられている。
- 米国では、2023年5月に「2つ以上の全身療法後の再発又は難治性のびまん性大細胞型B細胞リンパ腫(not otherwise specified)(インドレントリンパ腫からの組織学的形質転換を含む)及び高悪性度B細胞リンパ腫」を効能・効果として承認(製品名:EPKINLY®)(ジェンマブ press release)。さらに2024年6月には、「2つ以上の全身療法後の再発又は難治性の濾胞性リンパ腫」が追加承認された(ジェンマブ press release)。
- 日本では、2023年9月25日に「再発又は難治性の大細胞型B細胞リンパ腫(びまん性大細胞型B細胞リンパ腫、高悪性度B細胞リンパ腫、原発性縦隔大細胞型B細胞リンパ腫)」及び「再発又は難治性の濾胞性リンパ腫」を効能・効果として2023年9月25日に承認(製品名:エプキンリ®)(ジェンマブ press release)。さらに2025年2月20日には、「再発又は難治性の濾胞性リンパ腫(Grade 1~3A)」に対する用法・用量追加承認を取得した(ジェンマブ press release)。
- EUでは、2023年9月に承認され(製品名:TEPKINLY®)(ジェンマブ press release)、現在の効能・効果は「2回以上の全身療法後の再発又は難治性のびまん性大細胞型B細胞リンパ腫の成人患者に対する単剤療法」及び「2回以上の全身療法後の再発又は難治性の濾胞性B細胞リンパ腫の成人患者に対する単剤療法」である。
エプキンリ®は、ジェンマブとアッヴィのがん領域におけるグローバルな提携関係の下、両社が共同開発した薬剤。⽇本では、ジェンマブが製造販売を⾏い、アッヴィとのコ・プロモーションにより、両社が情報提供活動を⾏っている。
(5)なぜファイザーは無効審判請求を取り下げたのか
本件特許第6278598号(特許権者:中外製薬)に対して無効審判(無効2022-800027号)を請求したのは、ファイザー(請求人)である(2022年3月31日)。

ファイザーはなぜ無効審判を請求したのでしょうか。
特許庁は2023年3月29日、被告による訂正を認めつつも、請求人の主張を支持して本件特許を無効とする旨の審決予告を行った。これを受け、同年7月に中外製薬はさらにFc領域の変異をD265A変異に限定する本件訂正を提出した。
その後、2024年2月8日にジェンマブが請求人側の参加人として手続に加わり、数日後に審理終結通知が発せられた。そして同月19日、ファイザーは無効審判請求を取り下げた。

ファイザーはなぜ審決を見届けずに請求を取り下げたのでしょうか。
2024年3月21日、特許庁は、無効を予告していた前回の判断を覆し、被告による本件訂正を認めたうえで、請求項1~18、23~25、27~70について無効審判請求を不成立とする審決を行った。これを不服として、参加人であるジェンマブが本件審決取消訴訟を提起するに至った。
興味深いのは、ファイザーが自身の無効審判請求を取下げた直後の動きである。ファイザーは、無効審判請求取下げの7日後、すなわち2024年3月26日、B細胞成熟抗原(BCMA)及びCD3ε鎖を標的とする遺伝子組換え二重特異性モノクローナル抗体エルラナタマブ(Elranatamab)を有効成分とする抗悪性腫瘍剤「エルレフィオ®皮下注44mg・同76mg」について、「再発又は難治性の多発性骨髄腫(標準的な治療が困難な場合に限る)」を効能・効果として国内承認を取得した(2024.03.26 ファイザー press release: 再発または難治性の多発性骨髄腫の患者さんに新たな治療選択肢「エルレフィオ®皮下注」製造販売承認を取得)。
インタビューフォームによれば、エルラナタマブは、T細胞の細胞膜上のCD3及び骨髄腫細胞膜上のBCMAに結合し、T細胞を活性化してBCMA陽性腫瘍細胞を傷害する作用機序を有する。また、抗CD3ε-H鎖上にはD265A変異が導入されており、ヒトFcRnには結合する一方で、種々のヒトFcγRには結合しないとされている。

ファイザーのエルラナタマブのFc領域にも、Fcγ受容体結合能を低下させる変異として、D265Aのアミノ酸変異が導入されているようですね。
一方、ジェンマブとファイザーは、抗ヒト組織因子(TF)モノクローナル抗体チソツマブと微小管重合阻害作用を有するモノメチルアウリスタチンE(MMAE)をリンカーで結合させた抗体薬物複合体(ADC)チソツマブ ベドチン(Tisotumab Vedotin)を有効成分とする「テブダック®(Tivdak®)」の共同開発で提携関係にある(日本では2025年3月27日承認、米国では2021年9月20日承認)。本剤は、ファイザーに買収されたSeagen社のADC技術を用いて創製されている(ジェンマブ press release参照)。
もっとも、本件特許が対象とするような、腫瘍細胞をT細胞依存的に傷害する二重特異性抗体に関して、両社が共同開発を行っている情報は公表されていない。ジェンマブが審判終盤で参加したことや、両社の製品ポートフォリオの違いを踏まえると、両者はそれぞれ独立した事情に基づいて無効審判を争っていた可能性が高い。
ファイザーが当初無効審判を請求した背景としては、エルレフィオ®皮下注の開発・承認に際し、本件特許がその製造販売活動に影響を及ぼすおそれを懸念したことが考えられる。審決が出される直前に請求を取り下げ、そのわずか7日後にエルレフィオ®が承認されたという時系列をみると、両社間で何らかの協議または合意が成立した可能性を示唆するものとも読めるが、その具体的内容は公表されていない。
(6)今後の特許紛争の展開
前述のとおり、本判決は本件訂正発明1に関する判断にとどまり、その余の請求項や主張については審理が継続している。差し戻し後の審判の帰趨は、東京地裁で係属中の特許権侵害訴訟の判断にも一定の影響を及ぼす可能性がある。今後の審理の進展に注目したい。
なお、本件特許ファミリーに係る発明は、癌抗原とT細胞受容体複合体の双方に結合し、Fc領域に変異を導入してFcγ受容体結合能を低下させた二重特異性抗体を包含し得るものである。この技術分野には、エプキンリ®を製造販売するジェンマブ/アッヴィや、エルレフィオ®を製造販売するファイザーのほか、同様の技術コンセプトに基づくバイオ医薬品の開発を進める企業も存在し得る。したがって、本件特許群の有効性を巡る動向は、これらの企業の事業活動にも影響を及ぼし得るものであり、今後の無効審判・訴訟の展開が注目される。
※ご覧いただきありがとうございます。この記事の内容について、読者の皆さまのご意見や気づきもぜひお聞かせください!
以下のようなご感想・質問、大歓迎です!
- 🤔ここ理解しづらいな、という部分はありましたか?
- 🤔このニュース、事件、判決例の実務影響についてご意見ありますか?
- 🤔過去の類似事例や判決例をご存じでしたら教えてください!
- 🤔恥ずかしい質問、つぶやき、大歓迎です
- 「👍」「なるほど」「疑問あり」だけでもOK!
コメント欄は↓ コメントは匿名OK! ぜひ気軽に投稿してください🙇
皆さんの反応が、次回の記事や解説のヒントになります🥰

Robot icons created by Freepik – Flaticon; Robot cat icons created by Freepik – Flaticon



コメント