2025年12月1日、オーストラリア連邦裁判所(Federal Court of Australia)は、Otsuka Pharmaceutical Co Ltd v Sun Pharma ANZ Pty Ltd [2025] FCAFC 161事件において、オーストラリア特許法に基づく医薬品の特許期間延長(Patent Term Extension:PTE)の対象となる「pharmaceutical substance」(特許法70条(2))は有効成分そのものを指し、製剤は含まれないとの判断を示しました。
その結果、長時間作用型注射製剤「ABILIFY MAINTENA」がオーストラリア医薬品登録簿(ARTG)に登録されたことを根拠として認められていた、大塚製薬のオーストラリア特許第2004285448号(アリピプラゾール(aripiprazole)を有効成分とする持続放出型注射製剤に関するクレーム)のPTE(満了日が2024年10月18日から2029年7月25日へと延長)について、本件特許が「pharmaceutical substance per se」をクレームしておらず、製剤クレームにとどまる以上、PTEの法定要件(特許法70条(2))を満たさないとして、連邦裁判所は当該PTEの適格性を否定する判決を言い渡しました。
“we consider that the term pharmaceutical substance is limited to active pharmaceutical substances and that formulations do not fall within the definition of pharmaceutical substance. Thus, the Formulations are not within the definition of pharmaceutical substances, and accordingly they are not pharmaceutical substances per se.”
本判決は、製剤クレームに基づくPTE適格性を明確に否定した点で、オーストラリアにおける特許期間延長の実務およびこれまでの先行裁判例に重要な転換をもたらすものといえます。

新規有効成分の特許を強く意識した本判決の立場は一貫している一方で、本判決によって、製剤技術も臨床的価値を大きく左右する現代の創薬実務とPTE制度との間に、考え方のずれがより明確になったように感じられます。今後は、こうしたずれをどのように位置づけるべきかについて、政策的な議論が求められるのかもしれません。
補足1: 適用される特許期間延長制度
大塚製薬による本件特許期間延長の出願は2014年8月13日に行われているため、本件には現行の特許期間延長制度が適用されます。当該制度を構成する規定は、特許法第6章第3部(第70条〜第79A条)に定められています。本件において特に重要なのは、第70条であり、同条は、特許期間延長を出願しようとする特許権者が満たすべき3つの要件を、第2項、第3項および第4項において定めています。これらの要件は、いずれも「pharmaceutical substance(医薬物質)」に関して満たされなければなりません。要件の内容は以下のとおり。
(2) 次のいずれか一方又は双方の要件が満たされなければならない。
(a) 一又は二以上の医薬物質そのもの(pharmaceutical substances per se)が、当該特許の完全明細書において実質的に開示されており、かつ、その完全明細書の請求項の範囲に実質的に含まれていること。
(b) 組換えDNA技術の使用を含む製造方法によって製造される一又は二以上の医薬物質が、当該特許の完全明細書において実質的に開示されており、かつ、その完全明細書の請求項の範囲に実質的に含まれていること。
(3) 上記の医薬物質のうち少なくとも一について、次の両方の要件が満たされなければならない。
(a) 当該医薬物質を含有し、又は当該医薬物質から成る医薬品が、オーストラリア医薬品登録簿(Australian Register of Therapeutic Goods:ARTG)に収載されていること。
(b) 当該特許の出願日から、当該医薬物質に関する最初の規制当局による承認日までの期間が、少なくとも5年以上であること。
(4) 当該特許の存続期間が、本部(第6章第3部)に基づいて、これまでに延長されたことがないこと。
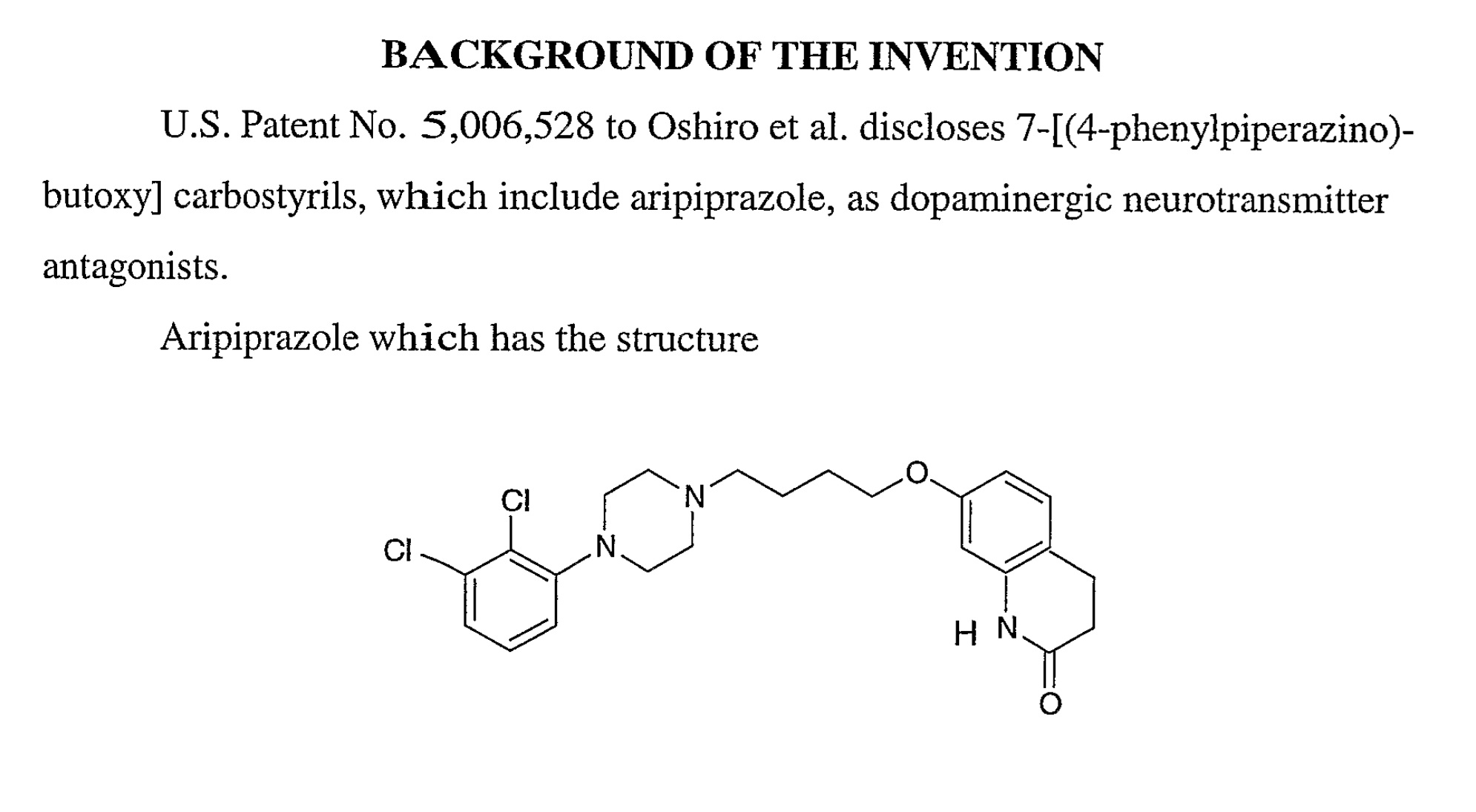
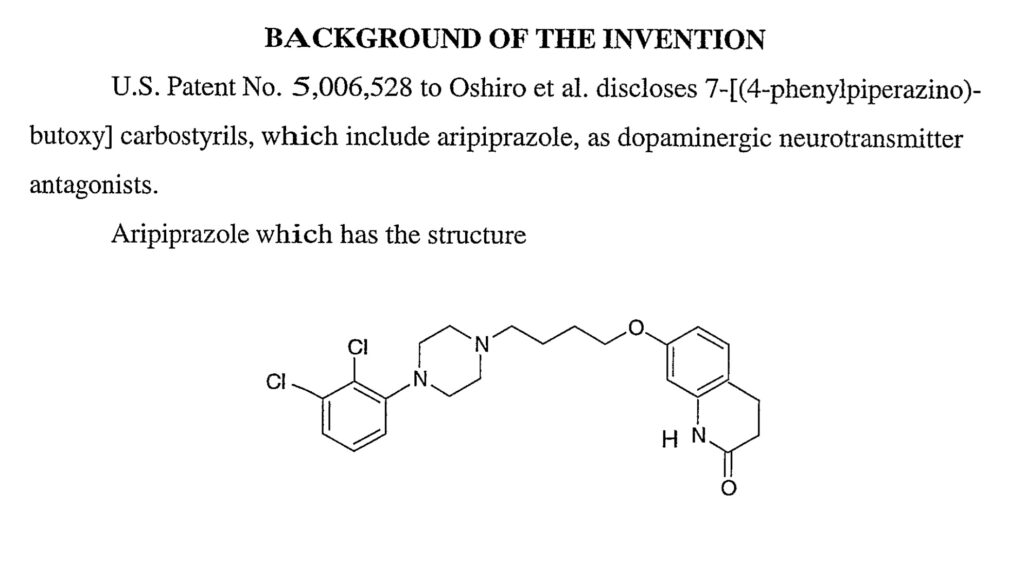
補足2:オーストラリア特許第2004285448号
オーストラリア特許第2004285448号はPCT出願(PCT/US2004/034367)から移行され特許となりました。例えばクレーム1および16は以下のとおり。
1. A controlled release sterile aripiprazole injectable formulation which upon injection releases aripiprazole over a period of at least one week, which comprises:
(a) aripiprazole having a mean particle size of about 1 to 10 microns,
(b) a vehicle therefor, and
(c) water for injection.
16. A sterile freeze-dried controlled release aripiprazole formulation which comprises:
(a) aripiprazole having a mean particle size of about 1 to 10 microns, and
(b) a vehicle therefor,
which formulation upon constitution with water forms a sterile injectable to formulation which upon injection releases aripiprazole over a period of at least about two weeks.
本件特許出願時点で、アリピプラゾールそのものは公知の物質でした。
※ご覧いただきありがとうございます。この記事の内容について、読者の皆さまのご意見や気づきもぜひお聞かせください!
以下のようなご感想・質問、大歓迎です!
- 🤔ここ理解しづらいな、という部分はありましたか?
- 🤔このニュース、事件、判決例の実務影響についてご意見ありますか?
- 🤔過去の類似事例や判決例をご存じでしたら教えてください!
- 🤔恥ずかしい質問、つぶやき、大歓迎です
- 「👍」「なるほど」「疑問あり」だけでもOK!
コメント欄は↓ コメントは匿名OK! ぜひ気軽に投稿してください🙇
皆さんの反応が、次回の記事や解説のヒントになります🥰


コメント