 *Topics
*Topics 2011年、医薬系”特許的”な判決を振り返る。
特許権の存続期間の延長の問題2011年、医薬メーカーにとって最もホットだった"特許的"ニュースは、特許権の存続期間の延長問題だったのではないでしょうか? 2011.12.28 「特許権の存続期間の延長」の審査基準改訂 第7回 特許権の存続期間の延長制度検討ワーキング・グループ議事録 「特許権の存続期間の延長」の審査基準改訂案に対する意見募集 2011.08.19 「第6回 特許権の存続期間の延長制...
 *Topics
*Topics  *Pharma/IP news
*Pharma/IP news  *Case2011
*Case2011 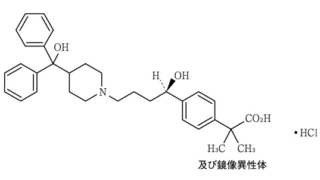 *Pharma/IP news
*Pharma/IP news 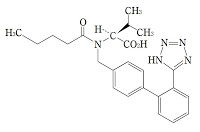 *Case2011
*Case2011  *Case2011
*Case2011 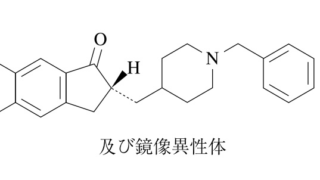 *Pharma/IP news
*Pharma/IP news  *Pharma/IP news
*Pharma/IP news  *Pharma/IP news
*Pharma/IP news  *Case2011
*Case2011  *Case2011
*Case2011 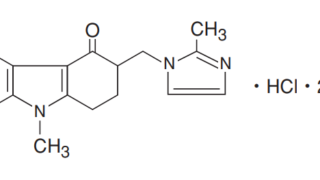 *Case1991-2000
*Case1991-2000  *Pharma/IP news
*Pharma/IP news  *Pharma/IP news
*Pharma/IP news  *Case2011
*Case2011  *Pharma/IP news
*Pharma/IP news  *Case2011
*Case2011  *Case2011
*Case2011  *Case2011
*Case2011  *Case2011
*Case2011 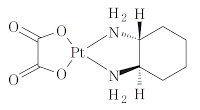 *Case2011
*Case2011  *Pharma/IP news
*Pharma/IP news  *Case2011
*Case2011 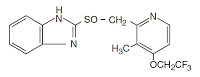 *Case2010
*Case2010 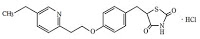 *Case2011
*Case2011  *Pharma/IP news
*Pharma/IP news  *Case2011
*Case2011  *Pharma/IP news
*Pharma/IP news  *Case2010
*Case2010  *Case2011
*Case2011  *Case2010
*Case2010  *Case2010
*Case2010  *Pharma/IP news
*Pharma/IP news 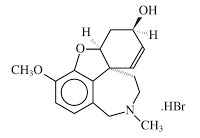 *Case2010
*Case2010  *Topics
*Topics