エバスチンの微細粉粒化: 大阪地裁平成22年(ワ)12227
【背景】
アルミラル(原告)は、沢井製薬・メディサ新薬・ニプロファーマ・全星薬品工業(被告)のエバスチン含有製剤の販売行為が、原告が保有するエバスチン製剤に関する特許権(特許3518601)を侵害するものであるとして、本件特許権に基づき被告らに対し、被告ら各製品の製造販売等の差止め及び廃棄を求めた。
請求項1(本件特許発明1):
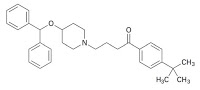
式(Ⅱ)‥‥に対応する化合物を含有し;式(Ⅱ)の化合物は微細粉粒化されていることを特徴とする,改良された溶解特性を持つ固体医薬組成物。
被告ら各製品が本件特許発明の技術的範囲に属するかどうかという争点のほか、本件特許権には無効理由(新規性欠如、進歩性欠如、実施可能要件違反、サポート要件違反等)があり特許無効審判により無効とされるべきものであるかという争点についても当事者から主張されたが、裁判所は、被告ら各製品が本件特許発明1の構成要件「微細粉粒化されていることを特徴とする」を充足するかどうかを検討し結論を下した。
【要旨】
原告は、
「「微細粉粒」とは,一般には,極めて細かい粉又は「つぶ」をいい,本件各特許発明では,通常のエバスチン粉粒(例えば,本件明細書に記載された平均サイズ=140µm のエバスチン粉粒)と比べて,小さな粉又は「つぶ」をいう。したがって,構成要件1-Bの「微細粉粒化されていること」とは,微細粉粒の状態にあることをいう。」
と主張した。そして、被告ら製品に含有されるエバスチンの具体的な状態についての分析結果を提出するとともに、被告ら各製品はエバスチンが微細粉粒化された状態となっていると主張した。
これに対し、被告は、
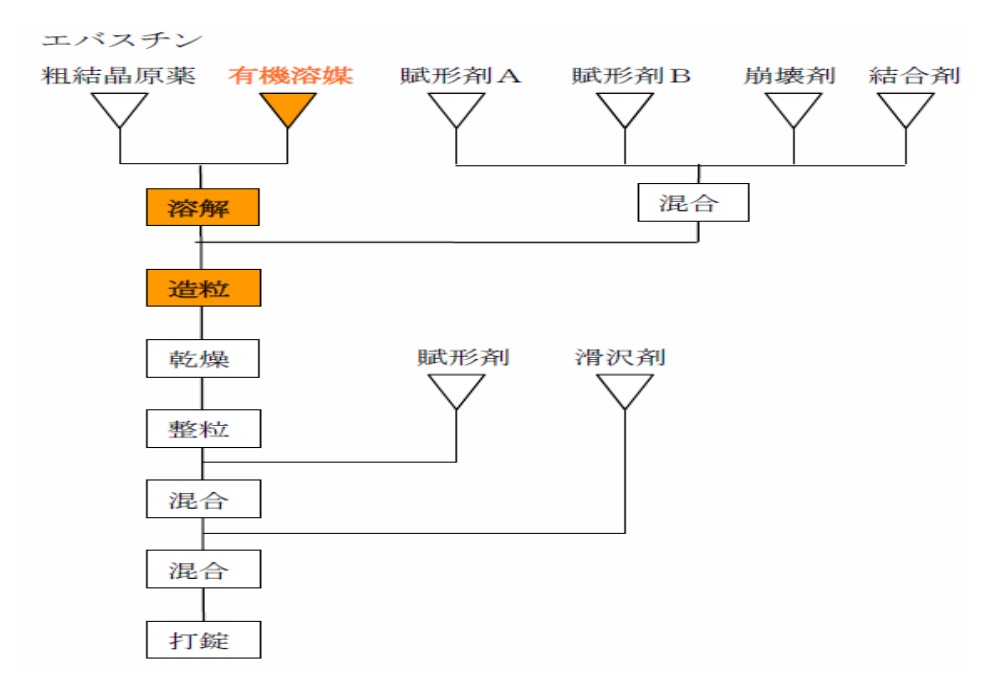
「被告ら各製品は,以下の図に記載したとおり,エバスチンの粗結晶化化合物(エバスチン粗結晶原薬)を有機溶媒に溶解させ,溶解状態にある薬物溶液のまま賦形剤等を加えて,製剤化したものである。
上記製法は,~難水溶性薬物を物理的に粉砕して微細な粒子にするという本件各特許発明とは全く異なるものである。
このように,本件各特許発明と被告ら各製品の製法は,溶解性の悪い化合物の溶解特性を改善するという技術的課題が共通するものの,その解決手段において全く系統・系譜を異にする(技術的思想を異にする)別個の技術手段である。
したがって,被告ら各製品は,エバスチンの粗結晶化化合物を物理的に粉砕して微細な粒子にしたもの,すなわち微細粉粒化されたものではない。
~そもそも,被告ら各製品に含有されるエバスチンは,上記イの製法を採用することにより,賦形剤等と絡まって渾然一体となっており,エバスチンの粒子径や粒子数を観念することはできないし,その実測寸法等を云々できるようなものではない。」
と主張した。
裁判所は、
「本件特許発明1の構成要件1-B「式(Ⅱ)の化合物は微細粉粒化されていることを特徴とする,」とは,式(Ⅱ)の化合物,すなわち「エバスチンを(ある状態よりも)大きさが極めて細かい状態の『粉(こな)』又は『粒(つぶ)』に変化させていることを特徴とする,」ものと解される。
~しかし,上記3のとおり,本件各報告書の分析結果,すなわちドメインサイズの分析結果が,被告製品1及び5に含有されるエバスチン粒子の状態,数,大きさなどを示すものであるとは認めることができない。他に,被告ら各製品に含有されるエバスチンの状態を示す証拠はなく,その結果,上記エバスチンが上記構成要件1-B~を充足することを認めるに足りる証拠はない。
したがって,被告ら各製品が本件各特許発明の各技術的範囲に属するということはできない。」
と判断した。
請求棄却。
【コメント】
有機溶媒に溶解させた状態にある薬物溶液のまま賦形剤等を加えて製剤化した被告ら製剤について、有効成分粒子の状態を立証するのは困難だった。
また、「微細粉粒化されていること」について、裁判所は、「どの程度微細なものであれば,これを充足するのか又何を基準として粒子の大きさを特定するのかなどの問題があると指摘したが、この点についての判断は留保した。仮に、被告ら各製品が、本件特許発明1の技術的範囲に属したとしても、本件請求項1には記載要件違反という無効理由があり特許無効審判により無効とされるべきものであるという判断が下されていた可能性がある。
本事件は、控訴期限までに原告側からの控訴がなく、被告側の勝訴が確定した。
エバステル®は、アルミラル(Almirall)社により開発されたアレルギー性疾患治療剤で、有効成分はヒスタミンH1受容体拮抗剤としての作用機序を持つエバスチン(Ebastine)。日本国内では大日本製薬株式会社(現:大日本住友製薬株式会社)が開発し、1996年にエバステル錠として承認、同年6月から販売され、その後、本剤の口腔内崩壊錠であるエバステルOD錠が2005年2月に承認され、同年7月から販売されている。
日本では、2008年に後発品が参入している。大日本住友製薬株式会社のアニュアルレポートによれば、エバステルの国内売上高は、2007年度において114億円、2008年度において111億円、2009年度において106億円、2010年度において92億円、2011年度において86億円であり、年々減少している。

コメント