 2024年2月1日、アステラス製薬による「ミラベグロン(ベタニス®錠)に関する特許権について」の謹告文が掲載されました。
2024年2月1日、アステラス製薬による「ミラベグロン(ベタニス®錠)に関する特許権について」の謹告文が掲載されました。
- 2024.02.01 日刊薬業: 【謹告】ミラベグロン(ベタニスⓇ錠)に関する特許権について
ベタニス®錠は、アステラス製薬が創製したミラベグロン(mirabegron)を有効成分とする選択的β3アドレナリン受容体作動性過活動膀胱治療剤であり、日本では、2011年7月1日、「過活動膀胱における尿意切迫感、頻尿及び切迫性尿失禁」を効能又は効果として承認されました。
ミラベグロンに関する特許
日本では、ミラベグロンの用途、結晶、製剤に関する特許権が有効に存続しているとのことです。
なお、再審査期間(8年間: 2011年7月1日~2019年6月30日)は終了していますので、ベタニス®錠の独占期間は以下の特許権の満了日のいずれかに依存することになります。
(1)ミラベグロンの過活動膀胱治療用途
特許第3815496号。5年の存続期間延長登録により満了日は2028年11月4日。現在、無効審判は請求されていないようです。
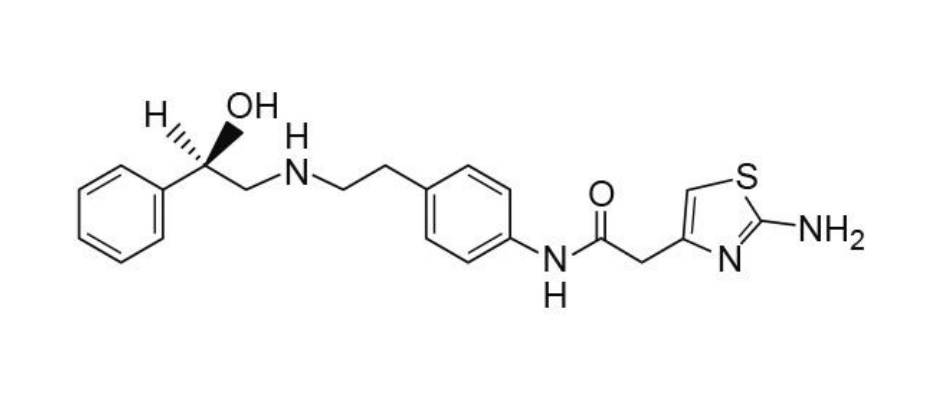
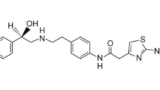
(R)-2-(2-アミノチアゾール-4-イル)-4’-[2-[(2-ヒドロキシ-2-フェニルエチル)アミノ]エチル]酢酸アニリド又はその塩を有効成分とする過活動膀胱の治療剤。
(2)ミラベグロンの結晶
特許第3800220号。5年の存続期間延長登録により満了日は2027年10月29日。現在、無効審判は請求されていないようです。
粉末X線回折で2θ(°) 5.32, 8.08, 15.28, 17.88, 19.04, 20.20, 23.16及び24.34にピークを有する、(R)-2-(2-アミノチアゾール-4-イル)-4′-[2-[(2-ヒドロキシ-2-フェニルエチル)アミノ]エチル]酢酸アニリドのα型結晶。
・・・
【請求項5】
粉末X線回折で2θ(°) 9.68, 19.76, 20.72, 22.10及び23.52にピークを有する、(R)-2-(2-アミノチアゾール-4-イル)-4′-[2-[(2-ヒドロキシ-2-フェニルエチル)アミノ]エチル]酢酸アニリドのβ型結晶。
(3)ミラベグロンを含有する製剤
特許第3462490号。5年の存続期間延長登録により満了日は2025年8月1日。現在、無効審判は請求されていないようです。
(a)薬物、(b)5乃至80重量%の、基剤1gが溶解するために必要な水の量が5ml以下(20±5℃)である、(c)のポリエチレンオキサイドがゲル化するより前に溶解する親水性基剤、および(c)10乃至95重量%の、(i)2%水溶液(25℃)で2000cP以上の粘度を有するか、あるいは(ii)粘度平均分子量が200万以上であるポリエチレンオキサイドを含有してなるマトリックス型放出制御製剤において、マトリックス中物理混合によって、黄色三二酸化鉄を製剤重量当たり1乃至20重量%配合もしくは赤色三二酸化鉄を5乃至20重量%配合するか、またはフィルムコート中、黄色三二酸化鉄および/または赤色三二酸化鉄を錠剤重量当たり0.3乃至2重量%配合してなる薬物の放出特性の変化を防止した経口用ハイドロゲル形成医薬組成物。
・・・
【請求項5】
薬物、親水性基剤、およびポリエチレンオキサイドを含有してなるマトリックス型放出制御製剤において、かかる製剤の安定化に有効な量の黄色三二酸化鉄および/または赤色三二酸化鉄を配合することにより、薬物の放出特性の変化を防止せしめる方法。
(4)ミラベグロンを含有する製剤
特許第4688089号 4月5日の存続期間延長登録により満了日は2030年2月2日。現在、無効審判は請求されていないようです。
(1)(R)-2-(2-アミノチアゾール-4-イル)-4’-[2-[(2-ヒドロキシ-2-フェニルエチル)アミノ]エチル]酢酸アニリドまたはその製薬学的に許容される塩、(2)1gを溶解する水の量が10mL以下の溶解性を示す製剤内部に水を浸入させるための添加剤として、少なくともポリエチレングリコール、および(3)ハイドロゲルを形成する高分子物質として、少なくとも、平均分子量が100万以上200万以下、または2%水溶液25℃の粘度が400mPa・s以上4000mPa・s以下のポリエチレンオキサイドを含有してなる、経口投与用放出制御医薬組成物。
・・・
【請求項16】
(1)(R)-2-(2-アミノチアゾール-4-イル)-4’-[2-[(2-ヒドロキシ-2-フェニルエチル)アミノ]エチル]酢酸アニリドまたはその製薬学的に許容される塩に、(2)1gを溶解する水の量が10mL以下の溶解性を示す製剤内部に水を浸入させるための添加剤として、少なくともポリエチレングリコールを製剤全体に対し5重量%以上75重量%以下、および(3)ハイドロゲルを形成する高分子物質として、少なくとも、平均分子量が100万以上200万以下、または2%水溶液25℃の粘度が400mPa・s以上4000mPa・s以下のポリエチレンオキサイドを製剤全体の重量に対して1重量%以上70重量%以下を配合することを特徴とする、経口投与用放出制御医薬組成物の製造方法。
(5)ミラベグロンを含有する製剤
特許第5849947号。満了日は2031年3月28日。現在、無効審判は請求されていないようです。
心拍数の上昇を抑制するための、1製剤当たり10mg以上200mg以下の(R)-2-(2-アミノチアゾール-4-イル)-4’-[2-[(2-ヒドロキシ-2-フェニルエチル)アミノ]エチル]酢酸アニリドまたはその製薬学的に許容される塩、及び、徐放性医薬組成物用担体を含有する放出制御錠剤であって、絶食投与時における最大血中薬物濃度(Cmax)が400ng/mL以下であり、溶出試験開始1.5時間後の薬物溶出率が75%以下であり、かつ7時間後の薬物溶出率が75%以上100%以下であり、徐放性ハイドロゲル形成性製剤、幾何学的に配置した薬物核および放出制御層からなる多層性製剤、複数のガムを組み合わせたゲル製剤、浸透圧ポンプ型製剤、膨潤性高分子を用いた製剤、水溶性高分子を用いたマトリクス製剤、コーティング膜による放出制御製剤、並びに、不溶性高分子を用いたマトリクス製剤からなる群より選択され、
前記の徐放性ハイドロゲル形成性製剤が、製剤内部まで水を浸入させるための添加剤と、ハイドロゲルを形成する高分子物質とを含む製剤であり、
前記の幾何学的に配置した薬物核および放出制御層からなる多層性製剤が、薬物を含有する層及び放出制御層からなり、以下の構成:
a)層中5~90W/W%の水溶性高分子を含有する混合物又は粒剤を圧縮することにより製造される、環境流体との接触で膨張する性質を有する第一層(層1)、
b)第一層に隣接し、圧縮成形性に適した特性を有し、かつ予め決められた時間内に生理活性物質を放出するように設計された、水溶性高分子と他の賦形剤からなる、薬物を含有
する第二層(層2)
からなる、二層からなる製剤、あるいは、
a)層中5~90W/W%の水溶性高分子を含有する混合物又は粒剤を圧縮することにより製造される、環境流体との接触で膨張する性質を有する第一層(層1)、
b)第一層に隣接し、圧縮成形性に適した特性を有し、かつ予め決められた時間内に生理活性物質を放出するように設計された、水溶性高分子と他の賦形剤からなる、薬物を含有する第二層(層2)、及び
c)一般的にゲル化及び/又は膨張し、次いで任意に崩壊する水溶性高分子を含み、かつ(層2)からの薬物の放出を制御する機能を有する、(層2)に隣接する第三層(層3)
からなる、三層からなる製剤であり、
前記の複数のガムを組み合わせたゲル製剤が、少なくとも、薬物とガム基剤とを含有し、当該ガム基剤が、ヘテロ多糖ガム及び環境流体に呈される時に前記ヘテロ多糖ガムを橋かけ結合させることができるホモ多糖を含む徐放性賦形剤である製剤であり、
前記の浸透圧ポンプ型製剤が、薬物層とプッシュ層とからなる二層錠型圧縮コアに、半透膜をコーティングしてなる製剤であり、
前記の膨潤性高分子を用いた製剤が、水の吸収時に膨潤する高分子量の水溶性のポリマーを含む製剤であり、
前記の水溶性高分子を用いたマトリクス製剤が、水溶性高分子に薬物が均一に分散している製剤であり、
前記のコーティング膜による放出制御製剤が、コーティング液の成分として、皮膜形成剤を含有する製剤であり、
前記の不溶性高分子を用いたマトリクス製剤が、水不溶性高分子に薬物が均一に分散している製剤である、前記放出制御錠剤。
ベタニス®錠のパテントクリフはいつ?
用途特許(1)(特許第3815496号)に係る特許権の満了日(2028年11月4日)が経過した後に、日本ではベタニス®錠の後発医薬品が承認される可能性があります。
製剤特許(4)及び(5)が後発医薬品参入障壁として有効かは不明です。
ベタニス®/Myrbetriq®(米国での商品名)/Betmiga®(欧州での商品名)の2023年3月期のグローバル売上は、 1,886億円であり、そのうち、日本での売上は335億円、米国での売上は965億円でした(アステラス製薬 2023年6月22日提出 2023年3月期(第18期)有価証券報告書)。
米国ではMyrbetriq®の後発医薬品の市場参入が、目前(2024年5月?)に迫っているかもしれない状況です(2023.06.12記事参照: アステラス製薬の過活動膀胱治療剤「Myrbetriq® 」米国デラウェア州連邦地方裁判所の判決について)。

アステラス製薬は、XTANDI®(イクスタンジ)のパテントクリフも2027年以降に迫る中、ベタニス®/Myrbetriq®/Betmiga®のクリフも迫っているとなると、非常に厳しい経営とならざるを得ませんね・・・。米国での訴訟も含めてどうなるのか見守りましょう。
- 2021.02.06記事参照: 前立腺がん治療剤XTANDI®(イクスタンジ)のパテントクリフ


コメント
Fiercepharma: The top 10 drugs losing US exclusivity in 2024
3. Myrbetriq (mirabegron)
https://www.fiercepharma.com/special-reports/top-10-drugs-losing-us-exclusivity-2024#c3c1b175-8624-4b57-a76f-836615f92cb3