 *Topics
*Topics 2017年、医薬系”特許的”な判決を振り返る。
(1) 先発医薬品メーカー同士の主導権争い2017年、日本においては、均等の成否の判断における第5要件(特段の事情)の判断基準について示された最高裁判決(2017.03.24 「マキサカルシトール事件(均等の第5要件)」 最高裁平成28年(受)1242)や延長された特許権の効力範囲とその類型が示された知財高裁大合議判決(2017.01.20 「デビオファーム v. 東和薬品」 知財高裁平成28年(...
 *Topics
*Topics  *Case2017
*Case2017 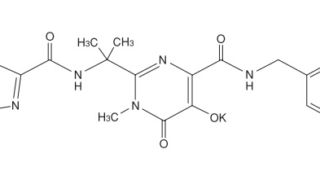 *Case2017
*Case2017 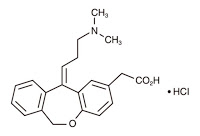 *Case2017
*Case2017  *Case2017
*Case2017 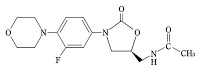 *Pharma/IP news
*Pharma/IP news  *Case2017
*Case2017 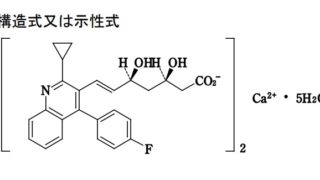 *Case2017
*Case2017 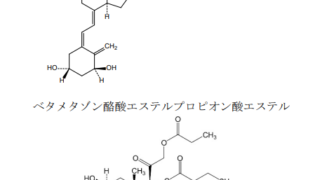 *Case2017
*Case2017  *Topics
*Topics  *Case2017
*Case2017 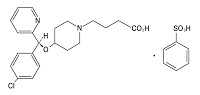 *Pharma/IP news
*Pharma/IP news  *Case2017
*Case2017  *Pharma/IP news
*Pharma/IP news  *Pharma/IP news
*Pharma/IP news  *Case2017
*Case2017 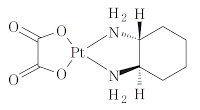 *Pharma/IP news
*Pharma/IP news 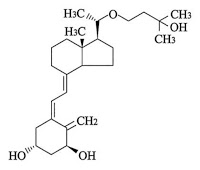 *Case2017
*Case2017  *Pharma/IP news
*Pharma/IP news 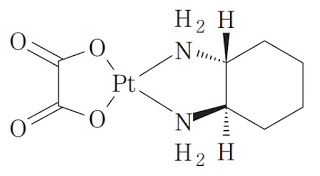 *Case2017
*Case2017 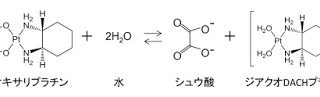 *Case2017
*Case2017  *Case2017
*Case2017  *Pharma/IP news
*Pharma/IP news  *Case2017
*Case2017 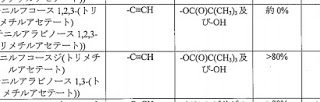 *Case2017
*Case2017  *Pharma/IP news
*Pharma/IP news  *Case2017
*Case2017  *Case2017
*Case2017  *Case2017
*Case2017  *Pharma/IP news
*Pharma/IP news  *Case2017
*Case2017  *Case2017
*Case2017  *Case2017
*Case2017  *Case2017
*Case2017  *Case2017
*Case2017  *Pharma/IP news
*Pharma/IP news  *Pharma/IP news
*Pharma/IP news  *Case2017
*Case2017 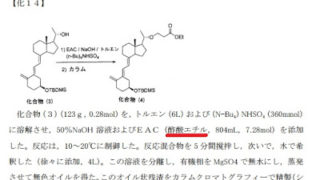 *Case2017
*Case2017  *Pharma/IP news
*Pharma/IP news  *Pharma/IP news
*Pharma/IP news 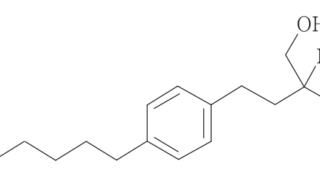 *Pharma/IP news
*Pharma/IP news  *Case2017
*Case2017  *Case2017
*Case2017  *Case2017
*Case2017  *Case2017
*Case2017  *Case2017
*Case2017  *Pharma/IP news
*Pharma/IP news  *Case2017
*Case2017  *Case2017
*Case2017