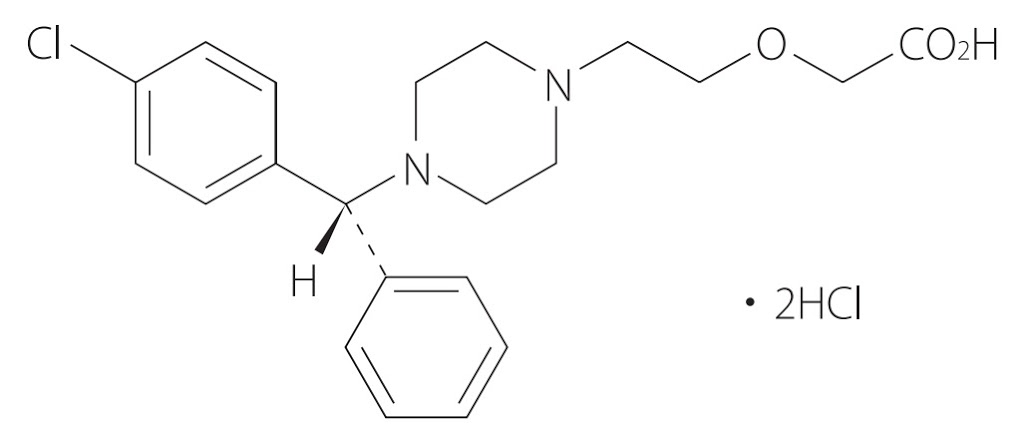
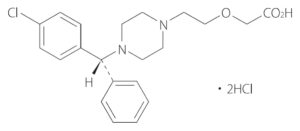
2020年2月17日に、持続性選択H1受容体拮抗・アレルギー性疾患治療剤ザイザル®(有効成分: レボセチリジン塩酸塩(levocetirizine hydrochloride))の後発医薬品(21社・43品目)が初承認となりました。そのうち、武田テバファーマ(株)がオーソライズド・ジェネリック(AG)の承認を取得しています(2020.02.17 武田テバファーマ press release)。
その約1か月前である2020年1月14日、UCB Farchim SAより「持続性選択H1受容体拮抗・アレルギー性疾患治療剤 (販売名 ザイザル®) に関する特許権について」の謹告文が掲載されました(日刊薬業website: 【謹告】持続性選択H1受容体拮抗・アレルギー性疾患治療剤 (販売名 ザイザル®) に関する特許権について)。この謹告文によると、UCB Farchim SAは、ザイザル®の有効成分であるレボセチリジン塩酸塩の製剤に関連する特許として、
- 特許第4724367号(マンニトールを含むことが必須の構成要件となっている経口医薬組成物に関する)・・・存続期間満了日は2023年1月14日
- 特許第4902875号(パラヒドロキシ安息香酸エステルを含むことが必須の構成要件となっている液体医薬組成物に関する)・・・存続期間満了日は2025年7月7日
- 特許第6506301号(固形水溶性ポリオールを含むことが必須の構成要件となっている固形形態の医薬組成物に関する)・・・存続期間満了日は2035年3月26日
を有しているとのことですが、いずれも有効成分以外の特定の製剤成分等を必須とする製剤特許であり、ひとつひとつ各後発品の製剤成分と特許発明とを対比確認しておりませんが、各後発医薬品製剤はそれら特許発明の技術的範囲を回避したものなのかもしれません。上記3つの特許に対して無効審判請求はされていないようです。
日本国内における独占的ライセンシー及び独占的販売会社であるグラクソ・スミスクライン(株)は、2010年10月27日にアレルギー性鼻炎、蕁麻疹、湿疹・皮膚炎、痒疹、皮膚そう痒症を適応症としてザイザル®錠5mgの承認を取得しました。その後、2014年1月17日にザイザル®シロップ0.05%、2020年2月17日にザイザル®OD錠2.5mg・5mgの承認を取得しました。再審査期間は、錠5mgが8年(2010年10月27日~2018年10月26日)、シロップ0.05%がザイザル錠の残余期間(2014年1月17日~2018年10月26日)、OD錠2.5mg・5mgは該当しない、となっており、終了しています。
レボセチリジンは、ラセミ体であるセチリジンのR-エナンチオマーです。セチリジン塩酸塩(cetirizine hydrochloride)を有効成分とするジルテック®錠/ドライシロップ(製造販売元ユーシービージャパン(株)、販売元グラクソ・スミスクライン(株))についての後発医薬品は、2007年7月6日に初薬価収載(28社・56品目)となり販売されています。
参考:
- 日刊薬業リンク 2020.01.14 「【謹告】持続性選択H1受容体拮抗・アレルギー性疾患治療剤 (販売名 ザイザル®) に関する特許権について」


コメント
【追記】
2020.06.18 武田テバファーマ press release: オーソライズド・ジェネリック3成分4品目薬価基準追補収載・・・ザイザル錠AG(レボセチリジン塩酸塩錠)発売
https://www.takeda-teva.com/public/news/detail?id=143
2020.06.19 GSK社 press release: 持続性選択H1受容体拮抗・アレルギー性疾患治療剤「ザイザル錠5mg」の剤形追加 口腔内崩壊錠「ザイザルOD錠2.5mg」、「ザイザルOD錠5mg」発売のお知らせ
https://jp.gsk.com/jp/media/press-releases/2020/20200619_xyzal_od_launch/
ザイザルOD錠は、UCB Biopharma SRLの協力のもと、GSKと全星薬品工業株式会社とで共同開発され、2020年2月17日に承認を取得。
令和3年7月 グラクソ・スミスクライン株式会社 「弊社製品の販売中止についてのお知らせ」
https://gskpro.com/content/dam/global/hcpportal/ja_JP/documents/news/Approved_Products_termination_Letter_for_HCP_July_2021.pdf
「ザイザルOD錠2.5mg」、「ザイザルOD錠5mg」は販売中止へ。