>関連判決③から続く
- 5-HT1A部分作動薬を双極性障害の「うつ病エピソード」の治療に使用できることが技術常識であるとはいえないとした本件審決の認定に誤りがあるから、その認定を前提として本件医薬用途特許の一部が実施可能要件・サポート要件違反であるとした無効審決は取り消された。
- 但し、双極性障害の「躁病エピソード」の治療に係る部分については、本件審決において実質的な判断が示されていないとして、その部分の実施可能要件・サポート要件の適否は判断されなかった。
- 本判決に対しては、上告・上告受理申立てがされている。しかし、上告棄却・上告不受理により本判決が確定し審判が再審理となれば、その判断の帰趨は、無効審決を受けてエビリファイ®ジェネリックに「双極性障害における躁症状」の効能追加承認を与えた厚生労働省の判断と、当該効能追加販売に踏み切った各ジェネリックメーカーの決断が、それぞれ正しいものだったのかという問いに答えを与えることになるだろう。
- 本事件含め当該特許の無効を争っている各ジェネリックメーカーを出し抜いた沢井製薬のジェネリック効能追加戦略が際立った状況となっている。
1.背景
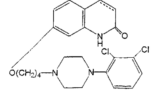
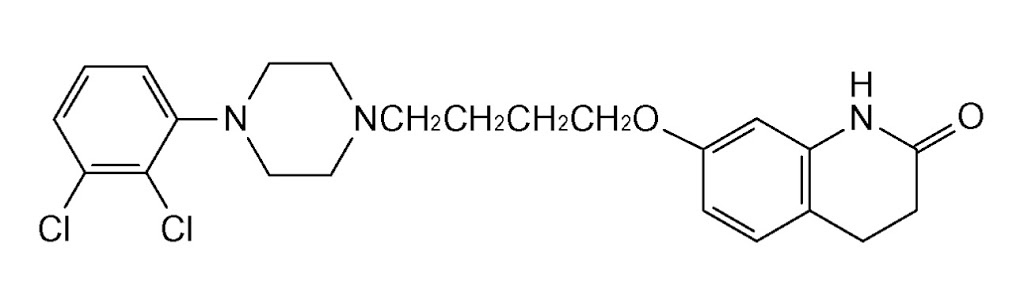
ジェネリックメーカー各社(共和薬品工業、ニプロ、東和薬品及びMeiji Seikaファルマ)が抗精神病薬エビリファイ®の医薬用途特許(第4178032号)に対して各々請求した特許無効審判事件において、特許庁は、エビリファイ®の「うつ病・うつ状態」の効能・効果を保護する請求項2に係る発明についての無効の主張を退けたが、エビリファイ®の「双極性障害における躁症状」の効能・効果を保護する請求項1、4及び5に係る発明についての無効の主張を認めるという一部無効審決をした。
本記事で紹介する判決は、特許庁がした上記審決を不服として提起された審決取消訴訟(令和2年(行ケ)10077, 10078, 10079, 10080, 10081, 10082, 10083)のうち、共和薬品工業が請求した特許無効審判事件の審決取消訴訟についてのものである。
本件訴訟(知財高裁令和2年(行ケ)10077)は、発明の名称を「5-HT1A受容体サブタイプ作動薬」とする原告(大塚製薬)の特許第4178032号について、被告(共和薬品工業、参加人として日医工)が特許無効審判を請求した事件(無効2018-800113号)において、特許庁が、原告の訂正を認めた上、請求項1、4及び5に係る発明についての特許を無効とし、請求項2に係る発明についての審判請求は成り立たないとする審決をしたため、原告が、被告両名を相手方として、本件審決のうち請求項1、4及び5に係る部分の取消しを求めた事案である。
| 本件発明 | 訂正後の請求項 | 審決の理由 | 審決 |
|---|---|---|---|
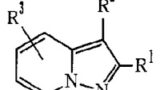
| 1 | 鬱病,最近のエピソードが軽い躁,躁,混合状態,鬱,又は特定できない症状の発現を有する双極性I型障害,エピソードが軽い躁症状の発現を伴った再発大鬱症状の発現及び循環型を有する双極性II型障害からなる群から選ばれた5-HT1A受容体サブタイプに関連した中枢神経系の障害を治療するための医薬組成物であって,式(1)・・・(省略)・・・のカルボスチリル化合物,及び医薬として許容されるその塩又は溶媒和物の治療有効量を含む医薬組成物。 | 実施可能要件違反 サポート要件違反 | 無効 |
| 2 | 5-HT1A受容体サブタイプに関連した中枢神経系の障害である鬱病を治療するための医薬組成物であって,式(1)・・・(省略)・・・のカルボスチリル化合物,及び医薬として許容されるその塩又は溶媒和物の治療有効量を含む医薬組成物。 | 実施可能要件違反及びサポート要件違反との主張は いずれも理由がない | 請求不成立 |
| 4 | 障害が,最近のエピソードが軽い躁,躁,混合状態,鬱,又は特定できない症状の発現を有する双極性I型障害である,請求項1記載の医薬組成物。 | 実施可能要件違反 サポート要件違反 | 無効 |
| 5 | 障害が,エピソードが軽い躁症状の発現を伴った再発大鬱症状の発現及び循環型を有する双極性II型障害である,請求項1記載の医薬組成物。 | 実施可能要件違反 サポート要件違反 | 無効 |
本件発明は、エビリファイ®の有効成分であるアリピプラゾールがドーパミンD2受容体に強い親和性で結合し、ドーパミンD3受容体及び5-HT7受容体に中等度の親和性で結合すること等が報告されていたところ、5-HT1A受容体サブタイプにおける作動活性を有することを発見したことに基づき、5-HT1A受容体サブタイプに関連した中枢神経系の障害に罹患した患者を治療する方法を提供するものである。
本件明細書には5-HT1A受容体におけるアリピプラゾールの結合親和性を評価する薬理学的試験(in vitro試験)の結果が記載されていた。
本事件のポイントは、エビリファイ®(アリピプラゾール)の「双極性障害における躁症状」の効能・効果を保護する請求項1、4及び5について実施可能要件・サポート要件の判断の前提となった、5-HT1A受容体部分作動薬と各疾患治療との結びつきに関する本件出願当時の技術常識の認定である。
より詳細な背景については、記事「2021.12.27 「大塚製薬 v. Meiji Seikaファルマ・大原薬品工業」 知財高裁令和2年(行ケ)10080; 10081・・・エビリファイ®用途特許一部無効審決を取り消す(判決①)」を参照。
2.要旨
裁判所は、「5-HT1A部分作動薬を双極性障害の「うつ病エピソード」の治療に使用できることが技術常識であるとはいえない」とした本件審決の認定には誤りがあるとして、その認定を前提として本件医薬用途特許の請求項1、4及び5について実施可能要件・サポート要件違反であるとした無効審決を取り消した。
但し、同請求項の双極性障害の「躁病エピソード」の治療に係る部分については、本件審決において実質的な判断が示されていないとして、その部分の実施可能要件・サポート要件の適否を判断しなかった。
判決の内容は以下の記事で取り上げた同日判決①②③とほとんどの部分で重複する。
参照:
- 2021.12.27 「大塚製薬 v. Meiji Seikaファルマ・大原薬品工業」 知財高裁令和2年(行ケ)10080; 10081・・・エビリファイ®用途特許一部無効審決を取り消す(判決①)
- 2021.12.27 「大塚製薬 v. ニプロ」 知財高裁令和2年(行ケ)10078; 10082・・・エビリファイ®用途特許一部無効審決を取り消す(判決②)
- 2021.12.27 「大塚製薬 v. 東和薬品」 知財高裁令和2年(行ケ)10079; 10083・・・エビリファイ®用途特許一部無効審決を取り消す(判決③)
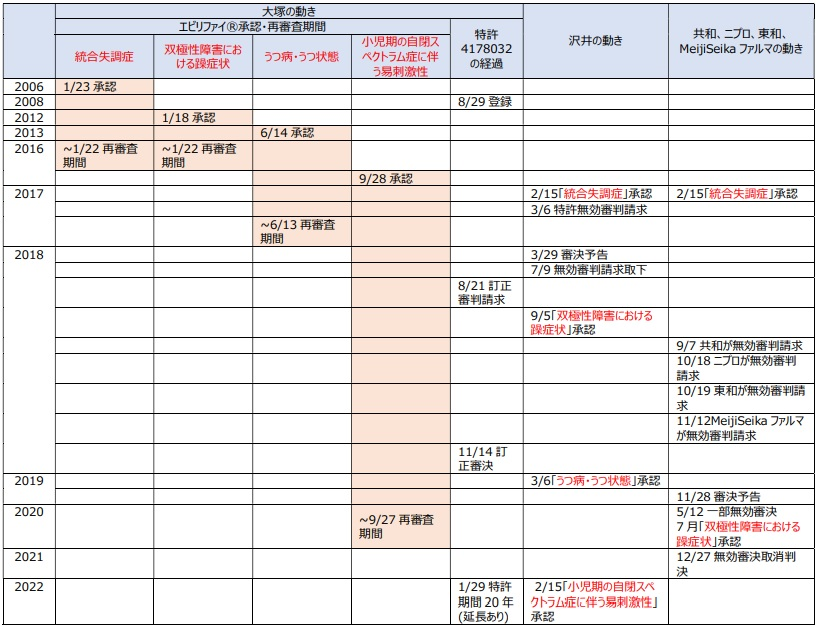
3.効能・効果追加で沢井製薬が新たな動き
エビリファイ®のジェネリックの効能・効果の攻防に関連して、以下に、本件事件及び関連事件の当事者(無効審判請求人)ではない沢井製薬のジェネリックの効能追加について紹介する。
(1)エビリファイ®ジェネリックが承認を取得している効能・効果
先発品エビリファイ®の効能・効果は以下のとおり。
- ①統合失調症
- ②双極性障害における躁症状
- ③うつ病・うつ状態(既存治療で十分な効果が認められていない場合に限る)
- ④小児期の自閉スペクトラム症に伴う易刺激性
エビリファイ®のジェネリック初参入時に承認された効能・効果は「①統合失調症」のみであった。
そして、「②双極性障害における躁症状」及び「③うつ病・うつ状態」については本件事件に関わる効能・効果である。
本件無効審判事件の当事者である各ジェネリックメーカーは「②双極性障害における躁症状」についての効能追加承認を取得(※1)しているが、「③うつ病・うつ状態」(※2)については取得していない。
※1 本判決で無効審決が取り消されたことにより、「②双極性障害における躁症状」の効能追加をジェネリックに承認した厚生労働省の判断は、「先発医薬品の特許が存在する効能・効果については承認しない」とのパテントリンケージの運用方針に事後的に反することになるかもしれない。最高裁への上訴等の今後の進展を見守る必要がある。このパテントリンケージの運用が抱える問題が顕在化する可能性については記事「2021.12.27 「大塚製薬 v. Meiji Seikaファルマ・大原薬品工業」 知財高裁令和2年(行ケ)10080; 10081・・・エビリファイ®用途特許一部無効審決を取り消す(判決①)」で言及したとおりである。

※2 沢井製薬は「③うつ病・うつ状態」の効能・効果を取得している。ジェネリックの中でいち早く「②双極性障害における躁症状」及び「③うつ病・うつ状態」の効能追加承認の取得に成功した沢井製薬の競争優位な状況についての考察は記事「エビリファイ®用途特許を巡るジェネリックメーカーの動き (2)」で言及したとおりである。
そして、残る「④小児期の自閉スペクトラム症に伴う易刺激性」についての効能追加承認を取得したジェネリックメーカーはこれまで無かった。
「③うつ病・うつ状態」及び「④小児期の自閉スペクトラム症に伴う易刺激性」についての効能・効果についての再審査期間はそれぞれ終了しているが、
がそれぞれ存在する。
※3 大塚製薬は、エビリファイ®の「④小児期の自閉スペクトラム症に伴う易刺激性」の効能・効果を保護する医薬用途特許4896831を保有している(当該効能・効果追加承認に基づく延長登録により存続期間満了日は2026年7月16日)。当該特許に対して、現在、東和薬品により無効審判が請求されている。
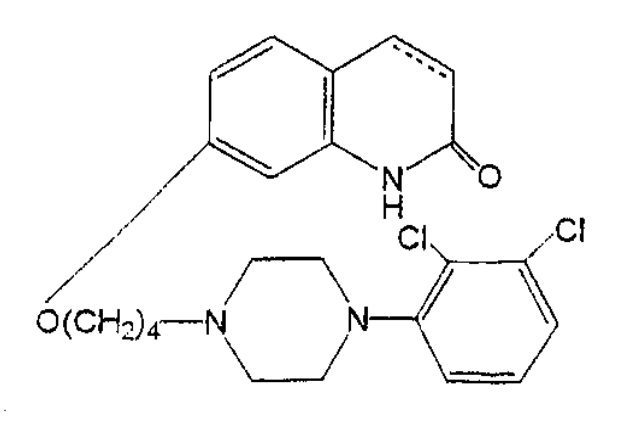
自閉症;ダウン症候群;注意欠陥多動障害(ADHD);アルツハイマー病又はパーキンソン病から選択される神経変性疾患;強迫性障害(OCD);睡眠障害;性的機能不全;アルコール及び薬物耽溺;嘔吐;乗物酔い;肥満;片頭痛;アルツハイマー病又はパーキンソン病から選択される神経変性疾患に起因する認知障害からなる群から選ばれた5-HT1A受容体サブタイプに関連した中枢神経系の障害を治療するための医薬組成物であって、式(1):
 (カルボスチリル骨格の3位及び4位の間の炭素-炭素結合は、単結合又は二重結合である);
(カルボスチリル骨格の3位及び4位の間の炭素-炭素結合は、単結合又は二重結合である);のカルボスチリル化合物、及び医薬として許容されるその塩又は溶媒和物の治療有効量を含む医薬組成物。
従って、パテントリンケージにより、原則、ジェネリックメーカーは、「③うつ病・うつ状態」及び「④小児期の自閉スペクトラム症に伴う易刺激性」について効能追加承認を取得することはできない状況(いわゆる虫食い)となっている。但し、沢井製薬の状況は異なる。
(2)沢井製薬が効能・効果を新たに追加、先発との不一致解消へ
2022年2月15日、沢井製薬は、エビリファイ®のジェネリックとしては新登場となる1mg製剤:
- アリピプラゾール錠1mg「サワイ」
- アリピプラゾール内用液1mg分包「サワイ」
の製造販売承認を取得したと発表した(2022.02.15 沢井製薬 press release: ジェネリック医薬品7成分14品目の製造販売承認を取得)。
先発品の同規格1mg製剤は「エビリファイ®錠1mg」及び「エビリファイ®内用液0.1%」であるが、特に、「エビリファイ®錠1mg」は、大塚製薬が、アリピプラゾールとして1日1mgを開始用量とする「④小児期の自閉スペクトラム症に伴う易刺激性」の効能追加承認を取得するために、ともに承認された規格であった(2016.11.18 大塚製薬 press release: 抗精神病薬「エビリファイ®錠1mg」国内で新発売)。
さて、PMDAウェブサイトにアップされた『アリピプラゾール錠1mg「サワイ」』及び『アリピプラゾール内用液1mg分包「サワイ」』の添付文書(2022年2月作成(第1版))の情報によると、沢井製薬は、上記1mg製剤の承認取得に伴って、新たに「④小児期の自閉スペクトラム症に伴う易刺激性」についての効能追加承認も取得したようである。
沢井製薬がこの効能追加承認を取得したということは、沢井製薬にとって上記医薬用途特許4896831の問題が解消されたと厚生労働省が判断してパテントリンケージを解除したことを意味する。
すなわち、沢井製薬は、医薬用途特許4896831についても、本件医薬用途特許4178032と同様に、大塚製薬から実施許諾を得ていると推測され(記事「エビリファイ®用途特許を巡るジェネリックメーカーの動き (2)」参照)、この「④小児期の自閉スペクトラム症に伴う易刺激性」の効能・効果が追加されることで、先発品エビリファイ®と沢井製薬のジェネリックとの間の効能・効果における不一致は解消されることになる。

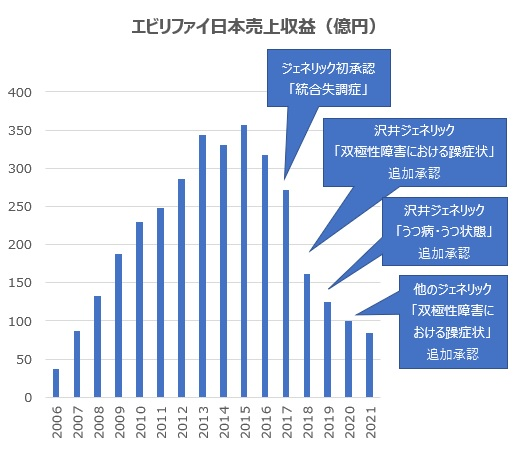
エビリファイ®について、日本で2017年2月にジェネリックが初承認され、エビリファイ®の売上は落ち込んでいるが、エビリファイ®とジェネリックとの間で、さらにジェネリックの中でも沢井製薬と他のジェネリックメーカーとの間で、効能・効果が異なる状況にある。
沢井製薬が「①統合失調症」に加え、他のジェネリックメーカーを出し抜いて早期に単独で「②双極性障害における躁症状」そして「③うつ病・うつ状態」の効能追加承認を得たこと、そして、さらに「④小児期の自閉スペクトラム症に伴う易刺激性」についての効能追加承認も得たとなれば、これらの沢井製薬の効能追加はジェネリックメーカー間での競争参入戦略として大変興味深い事例である。
実は、沢井製薬は、2017年に単独で本件医薬用途特許4178032に対して無効審判を請求しており(無効2017-800030)、2018年3月に本件特許を無効とする審決予告(※4)を得るにまで至ったが、同年7月に審判請求を取下げ、同年9月に「②双極性障害における躁症状」の効能追加承認を取得した。この期間中に、沢井製薬と大塚製薬との間にどのような交渉があったのかは不明だ。さらに沢井製薬は2019年には「③うつ病・うつ状態」の効能追加承認も取得した。
沢井製薬により審判請求が取下げられた時点で、本件特許は有効に存続していたことは明らかであり、本来なら、厚生労働省はパテントリンケージにより当該特許が保護するエビリファイ®の「②双極性障害における躁症状」や「③うつ病・うつ状態」の効能・効果についてジェネリックに承認を与えることはない。
しかし、2018年9月に厚生労働省がパテントリンケージを解除して沢井製薬のジェネリックだけに「②双極性障害における躁症状」、さらに「③うつ病・うつ状態」の効能追加も承認したことは、大塚製薬が、沢井製薬に、審判請求を取下げてもらうことと引き換えにそれらの効能追加の許諾を与えたということを意味すると想像される。
※4 沢井製薬が無効審判事件(無効2017-800030)で主張した無効理由1(特許法第36条第4項第1号違反(特許法第123条第1項第4号))において、「医薬用途発明について実施可能要件を満たすためには、発明特定事項として特定された医薬用途に用いた場合の有用性を直接に裏付ける実施例が必要」との主張を支持する裁判例を挙げているため、参考として以下に抜粋した。沢井製薬は、これら裁判例等における実施可能要件についての確立した解釈を前提にすれば、本件特許が実施可能要件を充足するには、本件医薬組成物が、本件特許発明において特定された医薬用途に用いた場合の有用性を直接に示す薬理データ等、合理的かつ客観的な根拠が示されることを要すると主張した。
「東京高判平成10年10月30日・LEX/DB28041692「嘔吐等に抗する医薬事件」は,「医薬についての用途発明においては,一般に,物質名,化学構造だけからその有用性を予測することは困難であり,明細書に有効量,投与方法,製剤化のための事項がある程度記載されている場合であっても,それだけでは当業者は当該医薬が実際にその用途において有用性があるか否かを知ることができないから,明細書に薬理データ又はそれと同視すべき程度の記載をしてその用途の有用性を裏付ける必要があり,それがされていない発明の詳細な説明の記載は,特許法36条3項に違反する」とする(東京高判平成14年10月1日・裁判所ウェブサイト「ピロリジン誘導体を有効成分とする薬剤組成物事件」,東京高判平成15年12月26日・裁判所ウェブサイト「タキキニン拮抗体の医学的新規用途事件」,知財高判平成17年8月30日・裁判所ウェブサイト「ビラゾロピリジン化合物の新規用途事件」等も同旨)。」
参考: 1998.10.30 「ショウガ根・イチョウの乾燥剤事件」 東京高裁平成8年(行ケ)201

参考: 2002.10.01 「ファイザー v. 特許庁長官」 東京高裁平成13年(行ケ)345
参考: 2003.12.26 「グラクソ v. 特許庁長官(タキキニン拮抗体事件)」 東京高裁平成15年(行ケ)104

参考: 2005.08.30 「アステラス(藤沢) v. 特許庁長官」 知財高裁平成17年(行ケ)10312
「また,知財高判平成21年4月23日・裁判所ウェブサイト「フルオロエーテル事件」は,「…(組成物の)発明において実施可能要件を満たすためには,発明の詳細な説明に,当該組成物がその所期する作用効果を奏することを裏付ける記載を要する」とする。」
参考: 2009.04.23 「バクスター v. アボット・セントラル硝子」 知財高裁平成18年(ネ)10075

「さらに,知財高判平成22年1月28日・判時2073号105頁「フリバンセリン事件」も,「…一般に,医薬品の用途発明が認められる我が国の特許法の下においては,『発明の詳細な説明』の記載に,用途の有用性を客観的に検証する過程が明らかにされることが,多くの場合に妥当すると解すべきであって,検証過程を明らかにするためには,医薬品と用途との関連性を示したデータによることが,最も有効,適切かつ合理的な方法であるといえるから,そのようなデータが記載されていないときには,その発明の実施をすることができる程度に明確かつ十分に記載されていないとされる場合は多い」とする。」
参考: 2010.01.28 「ベーリンガー インゲルハイム v. 特許庁長官」 知財高裁平成21年(行ケ)10033
「そして,知財高判平成24年6月28日・裁判所ウェブサイト「血管内皮増殖因子拮抗事件」は,これらの裁判例と同様の考え方を前提に,加齢性黄斑変性の原因である脈絡膜での血管新生につき,「VEGFが血管新生を促進する因子であることは示されているものの,血管新生にVEGFのみが関与している点は明らかでなく,結局,どの増殖因子が原因であるかは不明であることから,甲9から,hVEGF拮抗剤でVEGFの作用を抑制しさえすれば,脈絡膜における血管新生が抑制できることを合理的に理解することはできない。」とし,このような場合に,実施可能要件を充足するためには「本願発明(「加齢性黄斑変性の治療のための医薬の調製におけるhVEGF(ヒト血管内皮増殖因子)拮抗剤の使用。」)の内容が,本願明細書における実施例その他の説明により,「hVEGF(ヒト血管内皮増殖因子)拮抗剤」を使用することによって,加齢性黄斑変性に対する治療効果があることを,実施例等その他合理的な根拠に基づいた説明がされることが必要となる。」とした。その上で,「本願明細書には,hVEGF拮抗剤が加齢性黄斑変性に対し治療効果を有することを示した実施例等に基づく説明等は一切存在しない」ことを理由に,実施可能要件に違反すると判断しているところである。」
参考: 2012.06.28 「ジェネンテック v. 特許庁長官」 知財高裁平成23年(行ケ)10179

4.大塚は月1回製剤を投入、グローバル主力製品に成長
一方、大塚製薬のエビリファイ®のジェネリック対策としては、本件医薬用途特許の存在により、ジェネリックメーカー各社によるジェネリック初参入が「①統合失調症」だけの虫食いに留まらせることができたこと、また沢井製薬の効能追加承認を許したものの、他のジェネリックメーカーの効能追加を遅らせることはできた。
しかし、これら対応策を講じた結果として、エビリファイ®売上(日本)の急激な落ち込み(パテントクリフ)を少しは抑えることができたと言えるのかどうか、以下の売上収益の推移を見るとその評価は分かれるかもしれない。
 大塚製薬は、エビリファイ®(錠・散・内用液・OD 錠)に代わる新剤形として月1回投与によりコンプライアンスを向上させたアリピプラゾール持続性注射剤(月1回製剤)を開発し、2015年3月に日本でも「統合失調症」を効能・効果として承認を取得、販売を開始した。そして、2020年9月には「双極Ⅰ型障害における気分エピソードの再発・再燃抑制」の効能・効果を追加し、売上収益は堅調に推移している(2021年度日本売上は105億円、前年度比6.6%増)。
大塚製薬は、エビリファイ®(錠・散・内用液・OD 錠)に代わる新剤形として月1回投与によりコンプライアンスを向上させたアリピプラゾール持続性注射剤(月1回製剤)を開発し、2015年3月に日本でも「統合失調症」を効能・効果として承認を取得、販売を開始した。そして、2020年9月には「双極Ⅰ型障害における気分エピソードの再発・再燃抑制」の効能・効果を追加し、売上収益は堅調に推移している(2021年度日本売上は105億円、前年度比6.6%増)。
このアリピプラゾール持続性注射剤(月1回製剤)は、海外では商品名「ABILIFY MAINTENA」として販売されており、大塚製薬のグローバル主力製品に成長した(2021年度グローバル売上は1,303億円、前年度比12.3%増)。
 また、2018年1月、大塚製薬は、エビリファイの後継薬に当たる抗精神病薬レキサルティ®(一般名: ブレクスピプラゾール)の製造販売承認(効能・効果は「統合失調症」)を日本で取得した。レキサルティ®の2021年度での売上収益は、日本で130億円(前年度比9.9%増)、グローバルで1,211億円(前年度比15.7%増)に達しており、こちらも大塚製薬のグローバル主力製品に成長している。
また、2018年1月、大塚製薬は、エビリファイの後継薬に当たる抗精神病薬レキサルティ®(一般名: ブレクスピプラゾール)の製造販売承認(効能・効果は「統合失調症」)を日本で取得した。レキサルティ®の2021年度での売上収益は、日本で130億円(前年度比9.9%増)、グローバルで1,211億円(前年度比15.7%増)に達しており、こちらも大塚製薬のグローバル主力製品に成長している。
上記グラフのエビリファイ®日本売上の急激な落ち込みは、ジェネリック参入の影響だけでなく、これらアリピプラゾール月1回製剤や後継品レキサルティ®への置きかえによるものもある程度含まれているとポジティブに考えることができるかもしれない。
そして、エビリファイ®(アリピプラゾール)のパテントクリフに向けてのこのような大塚製薬による新製品の市場投入の経緯は、アリピプラゾールの新製剤や後継品という新たな価値を提供することで製品ライフサイクルにもつながった事例(パテントクリフの克服事例)として参考になるかもしれない。
5.その他
本件判決に対しては、既に上告・上告受理申立てがされている(上告提起事件番号: 令04行サ10009、上告受理申立事件番号: 令04行ノ10009)。
しかし、上告棄却・上告不受理により本判決が確定し審判が再審理となれば、その判断の帰趨は、無効審決を受けてエビリファイ®ジェネリックに「双極性障害における躁症状」の効能追加承認を与えた厚生労働省の判断と、当該効能追加販売に踏み切った各ジェネリックメーカーの決断が、それぞれ正しいものだったのか、という問いに答えを与えることになるだろう。
他の関連事件同日判決の上訴の行方と共に、今後の審理の進展に注目したい。
本件及び関連事件同日判決について、その他のコメントは、以下の記事を参照。
2021.12.27 「大塚製薬 v. Meiji Seikaファルマ・大原薬品工業」 知財高裁令和2年(行ケ)10080; 10081・・・エビリファイ®用途特許一部無効審決を取り消す(判決①)
- 当該医薬用途発明として有用であることが技術常識といえるに足るとは
- ジェネリック「うつ病・うつ状態」の効能追加承認はいつになるのか?
- 効能・効果「双極性障害における躁症状」の攻防は続きそう
2021.12.27 「大塚製薬 v. ニプロ」 知財高裁令和2年(行ケ)10078; 10082・・・エビリファイ®用途特許一部無効審決を取り消す(判決②)
- 治療効果を有することを理解するにはヒト臨床試験が必須か?
2021.12.27 「大塚製薬 v. 東和薬品」 知財高裁令和2年(行ケ)10079; 10083・・・エビリファイ®用途特許一部無効審決を取り消す(判決③)
- 薬理作用が非選択的であることは疾患とのつながりを阻害するか?

コメント
Kluwer Patent Blog
Japan: Problem of Japan’s patent linkage system comes to the surface by a set of IP High Court decisions
Naho Ebata, Mami Hino (Abe, Ikubo & Katayama)/May 10, 2022/
http://patentblog.kluweriplaw.com/2022/05/10/japan-problem-of-japans-patent-linkage-system-comes-to-the-surface-by-a-set-of-ip-high-court-decisions/
本件特許(第4178032号)に対する無効審判請求の再審理において、すべての無効審判請求は取下げという結末となったようです。