2024年5月7日、丸石製薬による「スガマデクスまたはその薬理学的に許容される塩含有液剤およびその製造方法に関する特許権について」の謹告文が掲載されました。
- 2024.05.07 日刊薬業: 【謹告】スガマデクスまたはその薬理学的に許容される塩含有液剤およびその製造方法に関する特許権について
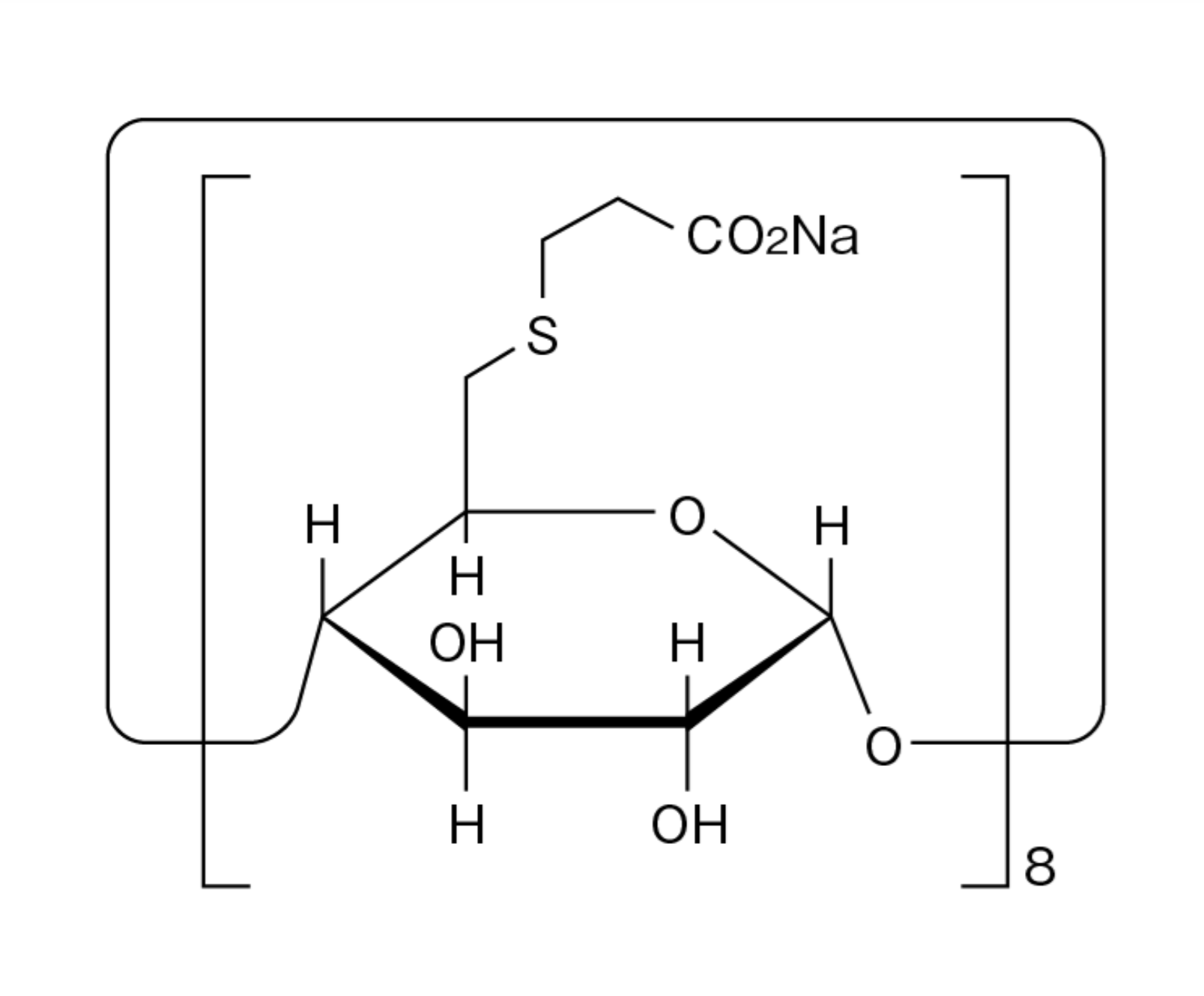
この謹告において、丸石製薬は、2021年9月28日に、日本特許第6950966号(発明の名称:スガマデクスまたはその薬理学的に許容される塩含有液剤およびその製造方法、請求項1を以下に示す)の登録を受け、その特許権を保有しており、滅菌工程において、ろ過滅菌のみを行うスガマデクスナトリウム含有液剤の製造、輸入または販売等を行っている、あるいは、今後予定・計画されている会社等に対して、当該特許権の侵害行為のないよう注意喚起しています。
滅菌工程において、ろ過滅菌のみを行うことを特徴とする、スガマデクス又はその薬理学的に許容される塩含有液剤の製造方法。
スガマデクスナトリウム(Sugammadex Sodium)は、「ロクロニウム臭化物又はベクロニウム臭化物による筋弛緩状態からの回復」を効能又は効果とするブリディオン®静注 200mg 及びブリディオン®静注 500mg (製造販売元: MSD 株式会社)の有効成分です。
2024年2月15日、複数の後発メーカーが、先発医薬品ブリディオン®静注にとって初めてとなる後発医薬品の承認を取得するに至りました(7社16品目)。
これら後発医薬品は、6月に薬価収載され発売される見込みです。
後発医薬品の承認を取得した一社が丸石製薬であり、そのスガマデクス静注液 200mg・500mg「マルイシ」については ブリディオン®静注 200mg・ 500mg のオーソライズド・ジェネリックとして承認を取得し、先発医薬品と原薬、添加剤、製法、製造場所、容器(バイアル・ゴム栓)が同じであるとのことで、また、スガマデクス静注液 200mg シリンジ「マルイシ」については、先発医薬品と同じ原薬を使用して製造しているとのことです(医薬品インタビューフォーム 2024年3月改訂(第 2 版)より)。
- 2024.02.15 丸石製薬 press release: 「筋弛緩回復剤スガマデクス静注液 200mg・500mg「マルイシ」 スガマデクス静注液 200mg シリンジ「マルイシ」製造販売承認取得のお知らせ」
ブリディオン®静注の審議結果報告書(平成21年10月27日 医薬食品局審査管理課)には、製剤の製造工程は、「高圧蒸気滅菌」を含む複数のステップが重要工程であると設定されている旨が記載されていることから、先発医薬品と製法が同じであるという丸石製薬のオーソライズド・ジェネリックは、その製剤の製造工程における滅菌工程は「ろ過滅菌のみを行うことを特徴とする」ものではない(その製法は当該特許権で保護されるものではない)と思われます。
そうであっても、特許第6950966号については、出願公開後、他人による出願審査請求、刊行物等提出、トーアエイヨーによる無効審判請求(数か月後に取下げ)を経ていることからすると、第三者から注目されている可能性があることがうかがえます。

もしかすると、ライバルとなる他の後発医薬品の中に、その滅菌工程が「ろ過滅菌のみ」のものがあるかも?
丸石製薬としては、当該特許権の存在を周知することにより、6月の薬価収載を前に、ライバルとなる他の後発医薬品の市場参入を抑えたいところです。
しかし、それは、他の後発医薬品のうち、その製造工程における滅菌工程が「ろ過滅菌のみ」であるものがあれば・・・の話ですが。
6月の後発医薬品の薬価収載・発売がどうなるか注目しましょう。
2024年2月15日に承認された他のスガマデクス後発医薬品:
- バクスター・ジャパン: 後発医薬品の製造販売承認取得のお知らせ(スガマデクス静注液200mg「バクスター」/スガマデクス静注液500mg「バクスター」)
- 富士製薬工業: ジェネリック医薬品の製造販売承認取得のお知らせ(スガマデクス静注液200mg「F」/スガマデクス静注液500mg「F」、スガマデクス静注液200mgシリンジ「F」)
- 沢井製薬: ジェネリック医薬品 3 成分 4 品目の製造販売承認を取得(スガマデクス静注液 200mg シリンジ「サワイ」)
- ヴィアトリス: ジェネリック医薬品 スガマデクス静注液200mg・500mg「VTRS」製造販売承認取得のご案内(スガマデクス静注液200mg「VTRS」/スガマデクス静注液500mg「VTRS」)
- ニプロ: ジェネリック医薬品 2 成分 5 品目の製造販売承認取得(スガマデクス静注液200mg「ニプロ」/スガマデクス静注液500mg「ニプロ」、スガマデクス静注液200mgシリンジ「ニプロ」)
- サンド: 2024年6月発売予定製品のご案内(スガマデクス静注液200mg「サンド」/スガマデクス静注液500mg「サンド」)

コメント
【情報追加】
新キット品の収載時期は5月と11月。
令和6年2月14日 産情発0214第2号/保発0214第2号「医療用医薬品の薬価基準収載等に係る取扱いについて」厚生労働省大臣官房医薬産業振興・医療情報審議官/厚生労働省保険局長
https://www.mhlw.go.jp/content/12404000/001218706.pdf
(2) 薬価基準収載の時期等
① 報告品目及び新キット製品
5月及び11月を標準とする。
② 後発医薬品
6月及び12月を標準とする。
新キット品となるスガマデクス静注液 200mg シリンジについては5月が薬価基準収載の時期となる。
2024年5月21日、スガマデクス静注液 200mg シリンジについて薬価基準への収載が官報告示されたのは、ニプロ、富士製薬工業、丸石製薬の製品。
https://kanpou.npb.go.jp/20240521/20240521g00120/20240521g001200007f.html
「スガマデクス静注液 200mg シリンジ「ニプロ」を、明日5月22日の薬価基準追補適用後に発売します」
https://www.nipro.co.jp/assets/document/newsrelease/240521.pdf
「ジェネリック医薬品(新キット製品)の薬価基準収載のお知らせ」
「本日、下記の通りジェネリック医薬品(新キット製品)1成分1品目について、薬価基準への収載が官報告示されたことをお知らせいたします。・・・『スガマデクス静注液 200mg シリンジ「F」』・・・」
https://www.fujipharma.jp/__upload/7466cb24121ff03636df929f7e63cdf379ebdda2.pdf
https://www.maruishi-pharm.co.jp/medical/products/891730/
【情報追加】
2024.05.27 丸石製薬 press release: NEW筋弛緩回復剤スガマデクス静注液200mgシリンジ「マルイシ」新発売のお知らせ
「丸石製薬株式会社(本社:大阪市鶴見区、代表取締役社長執行役員:井上勝人)は、筋弛緩回復剤、スガマデクス静注液 200mg シリンジ「マルイシ」(以下、本剤)を 2024年5月27日に新発売いたしました。・・・先発医薬品(ブリディオンⓇ静注 200mg・500mg)と同じ原薬を使用して製造いたします。本剤は、当社とテルモ株式会社が製品開発したものであり、テルモ株式会社に製造を委託いたします。」
https://www.maruishi-pharm.co.jp/media/20240527.pdf
2024.05.28 テルモ press release: テルモが丸石製薬と共同開発した筋弛緩回復剤のプレフィルドシリンジが、丸石製薬より発売
https://www.terumo.co.jp/newsrelease/detail/20240528/10331
【追加情報】
2024年6月13日、厚生労働省は、2024年6月14日に収載する後発品等の薬価基準追補収載を官報告示。
https://kanpou.npb.go.jp/20240613/20240613g00142/20240613g001420003f.html
初めて収載される後発品(投与経路別)は、筋弛緩回復剤・ブリディオン静注(一般名:スガマデクスナトリウム)の1成分のみで、ヴィアトリス・ヘルスケア、サンド、ニプロ、バクスター・ジャパン、富士製薬、丸石製薬の6社の後発品(全てバイアル製剤)。先発品にはないプレフィルドシリンジ製剤は5月22日に新キット製品として収載されている。
2024.06.13 ミクスOnline「後発品追補収載 初後発は1成分のみ、09年以降最も少なく AG先行発売のトレリーフに14社28品目」より
https://www.mixonline.jp/tabid55.html?artid=76696
これら後発品は、滅菌工程をろ過滅菌のみとする特許第6950966号に係る特許発明の技術的範囲から回避しているのかもしれません。