Summary
本件は、ジー.ディー.サール(被告)が保有する「セレコキシブ組成物」に関する特許に対する無効審判請求不成立審決を取り消す前訴判決の差戻し審判で、特許庁は、被告による本件訂正を認め、テバ、東和薬品、日医工、日本ケミファ、ヘキサル(原告ら)の主張する無効理由はいずれも理由がないとして審判請求は成り立たない旨の審決(本件審決)をしたため、原告らが審決の取消しを求めて提起した訴訟である。
知財高裁は、本件訂正後の特許請求の範囲を前提としたサポート要件の適合性について判断したものの、本件審決には「本件ピンミル構成」についての明確性要件に関する判断に誤りがあるとの原告らの主張には理由があるとして、他の取消事由について判断するまでもなく、本件審決中、本件特許の請求項1等に係る部分を取り消すと判決した。
この明確性要件に関する争点は、物自体の構造又は特性を直接特定することが難しい所望のプロダクトを、プロセスによって表現しようとすること(プロダクト・バイ・プロセス)の難しさを思い知らされる事例だったともいえるかもしれない。
本件について、特許庁に審理が差し戻されたら、被告は、明確性要件に適合するように当該部分をどのように訂正するのか、セレコックス®錠(有効成分: セレコキシブ)を保護する特許を保有する被告とその後発医薬品を製造販売するメーカーらとの間で起きている本件特許を巡る攻防の行方はまだまだ見守る必要がありそうだ。
1.背景
本件(知財高裁令和4年(行ケ)10127, 10128, 10129, 10130, 令和5年(行ケ)10027)は、ジー.ディー.サール(G.D. SEARLE LLC)(被告)が保有する「セレコキシブ組成物」に関する特許3563036号(本件特許)に対する無効審判の請求(無効2016-800112号事件)を不成立とした審決の取消しを求めて東和薬品(無効審判請求人)及び請求人側に参加したテバ、日医工、日本ケミファ、ヘキサル(あわせて「原告ら」)が提起した訴訟である。
(1)第1次審決の取消訴訟判決
第1次審決(請求不成立)の取消訴訟では、裁判所(知財高裁・第4部)が、
「本件明細書の発明の詳細な説明の記載及び本件優先日当時の技術常識から,当業者が,本件発明1に含まれる「粒子の最大長において,セレコキシブ粒子のD90が200μm未満」の数値範囲の全体にわたり本件発明1の課題を解決できると認識できるものと認められないから,本件発明1は,サポート要件に適合するものと認めることはできない。これと異なる本件審決の判断は誤りである。」
として、その余の取消事由について判断するまでもなく第1次審決を取り消す旨の判決(前訴判決)をした(ブログ記事「2019.11.14 「東和薬品・日本ケミファ・ヘキサル v. ジー.ディー.サール」 知財高裁平成30年(行ケ)10110; 10112; 10155」参照)ことにより、事件は再び特許庁に係属していた。
しかし、特許庁は、被告による本件訂正を認めた上、またしても原告らの主張する無効理由(サポート要件、明確性要件、実施可能要件、進歩性の欠如)はいずれも理由がないとして審判請求は成り立たない旨の審決(本件審決)をしたため、原告らが本件訴訟を提起していた。
(2)本件訂正前後の請求項1及び2
本件訂正前及び本件訂正後の請求項1及び2を以下に示す。
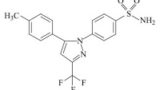
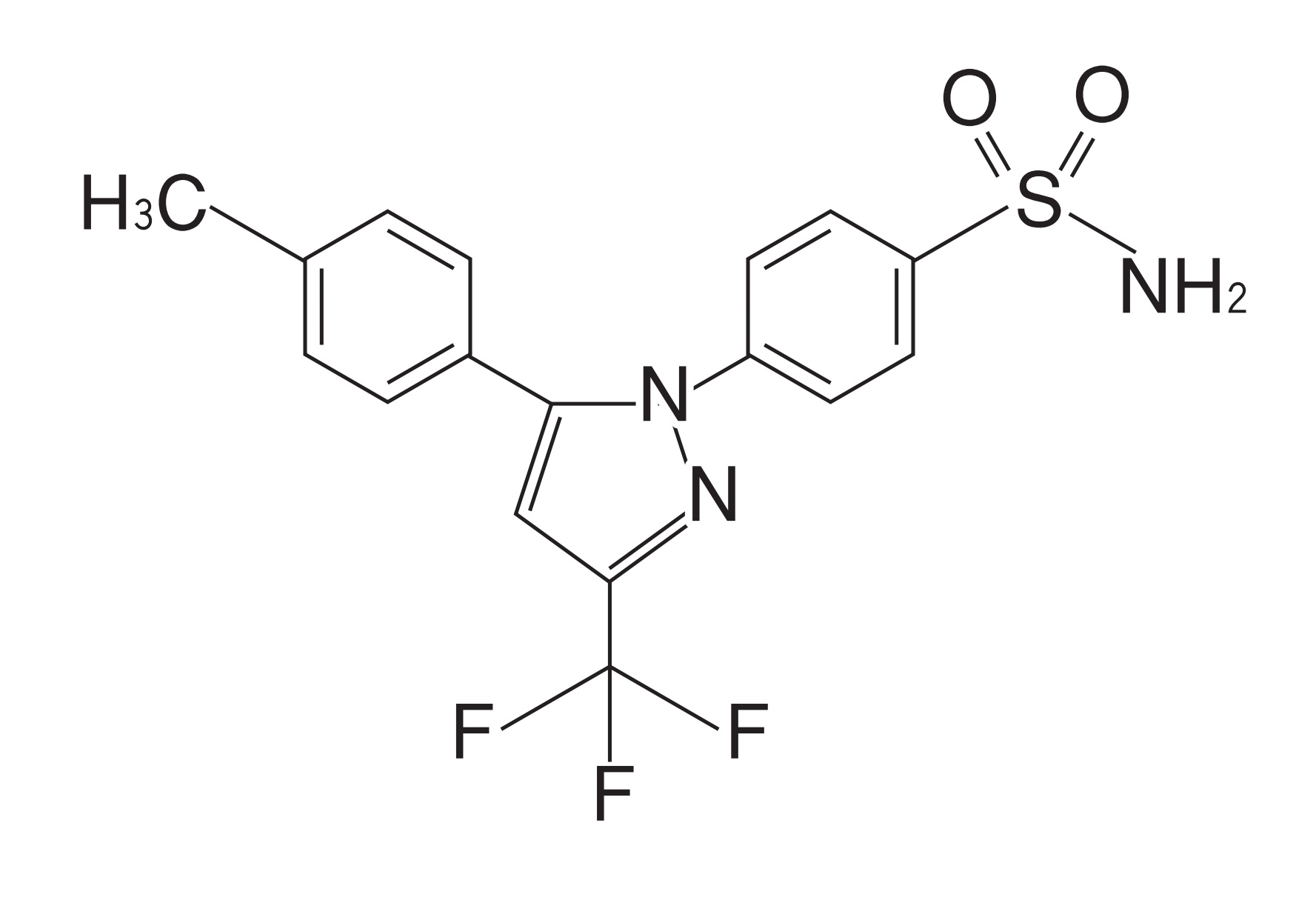
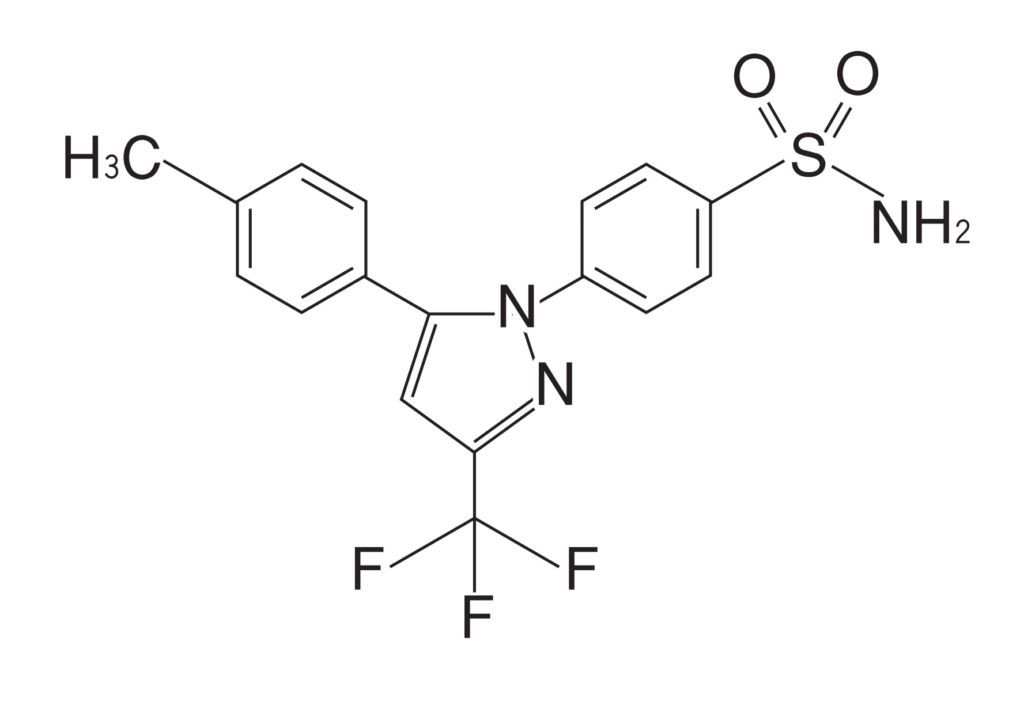
※「セレコキシブ粒子が、ピンミルのような衝撃式ミルで粉砕されたものであり、」との発明特定事項を、以下「本件ピンミル構成」ということがある。
(3)別件訴訟
なお、東和薬品による無効審判請求から遅れること約2年、2018年6月4日、日本ケミファ及びダイトも、本件特許に対して無効審判(無効2018-800071号)を請求した(テバ・ホールディングス合同会社も請求人側へ参加した)。
しかし、特許庁は、2019年9月3日、「審判請求は成り立たない」との審決を下したため、日本ケミファ及びダイトは、同年10月17日、本件特許に対する無効審判の請求不成立審決(進歩性欠如、サポート要件違反、実施可能要件違反の無効理由はいずれも理由なし)の取り消しを求めて訴訟を提起した。
裁判所(知財高裁・第4部)は、主引用例に接した当業者が、経口吸収性の改善及び薬効成分の含量均一性の改善のために、セレコキシブの粒子サイズを小さくすることに思い至ったとしても、「粒子の最大長において,セレコキシブ粒子のD90が200μm未満である粒子サイズの分布を有する」との構成を採用することについての動機付けがあるものと認めることはできないから、主引用例及び技術常識ないし周知技術に基づいて、当業者が上記構成を容易に想到することができたものと認めることはできない、と判断し、日本ケミファ及びダイトの請求を棄却(審決を維持)した(ブログ記事「2020.10.28 「日本ケミファ・ダイト v. ジー.ディー.サール」 知財高裁令和元年(行ケ)10137」参照)。
その後、上告棄却及び上告不受理の決定により別件審決は確定している。
2.裁判所の判断
知財高裁(第4部)(以下、「裁判所」と略す)は、取消事由3(明確性要件に関する判断の誤り)は理由があるから、取消事由4(実施可能要件に関する判断の誤り)、5(甲8発明に基づく本件訂正発明の進歩性の判断の誤り)について判断するまでもなく、本件審決中、本件特許の請求項1、2、4、5、7~13、15、17~19に係る部分を取り消すこととし、主文のとおり判決した。
1 特許庁が、無効2016-800112号事件について令和4年11月8日にした審決中、特許第3563036号の請求項1、2、4、5、7~13、15、17~19に係る部分を取り消す。
2 訴訟費用は被告の負担とする。
3 被告のため、この判決に対する上告及び上告受理の申立てのための付加期間を30日と定める。
以下に、取消事由1(訂正要件に関する判断の誤り)及び取消事由3(明確性要件に関する判断の誤り)についての裁判所の判断を紹介する。
なお、裁判所は、本件訂正後の特許請求の範囲を前提としたサポート要件の適合性の問題(取消事由2(サポート要件に関する判断の誤り))についての判断も示したので、その判断も紹介する。
(1)取消事由1(訂正要件に関する判断の誤り)について
裁判所は、本件訂正(原告らが訂正の適否を争っている部分)は、特許請求の範囲の減縮を目的とするものであって、実質上特許請求の範囲を拡張し、又は変更するものには該当せず、かつ、本件明細書等に記載した事項の範囲内においてするものであると認められるから、取消事由1は理由がない、と判断した。
「本件訂正の訂正事項・・・は、いずれも特許請求の範囲の減縮を目的とするものである。・・・本件明細書等には、セレコキシブ粒子をピンミルのような衝撃式ミルで粉砕し、D90を30μm(訂正事項2)又は30μm未満(訂正事項3)とすることが記載されていたといえる。 また、・・・本発明の製薬組成物は、好ましくは、キャリア材料として、加湿剤を含み、・・・特にラウリル硫酸ナトリウムを含むことが好ましいこと、・・・が記載されている。以上によれば、訂正事項2、3は、本件明細書等に記載した事項の範囲内においてするものである。」
(2)取消事由3(明確性要件に関する判断の誤り)について
裁判所は、明確性要件(特許法36条6項2号)の充足性の判断について以下のとおり説示した。
「特許法36条6項2号は、特許請求の範囲に記載された発明が明確でない場合には、権利者がどの範囲において独占権を有するのかについて予測可能性を奪うなど第三者の利益が不当に害されることがあり得ることから、特許を受けようとする発明が明確であることを求めるものである。その充足性の判断は、特許請求の範囲の記載だけではなく、願書に添付した明細書の記載及び図面を考慮し、また、当業者の出願当時における技術常識を基礎として、特許請求の範囲の記載が第三者の利益が不当に害されるほどに不明確であるか否かという観点から行うのが相当である。」
そして、裁判所は、本件訂正後の特許請求の範囲の請求項1及び2は、「本件ピンミル構成」を含むところ、本件ピンミル構成を巡っては、そのクレーム解釈という点で、(ア)いわゆるプロダクト・バイ・プロセスクレーム(以下「PBPクレーム」)といえるか否か、さらに(イ)「ピンミルのような」は衝撃式ミルの単なる例示か衝撃式ミルの一部に限定する構成か、そして、(ウ)当該クレーム解釈を前提とした明確性要件の適合性の議論が重層的に争われているので、以下のとおり、(ア)(イ)(ウ)を順次検討した。
ア 本件ピンミル構成を含む本件訂正発明はPBPクレームといえるか
まず、「本件ピンミル構成」を含む本件訂正発明がPBPクレームに当たるかについて、裁判所は、
「本件ピンミル構成に関する本件明細書の【0024】、【0190】の記載が、セレコキシブ粒子を粉砕する製造工程、製造方法を開示していることは明らかであり、したがって、本件訂正によって特許請求の範囲の発明特定事項とされるに至った本件ピンミル構成についても、「ピンミルのような衝撃式ミルで粉砕」するという製造方法をもって物の構造又は特性を特定しようとするもの(その意図が成功しているかどうかはともかく)と理解される。」
として、この限度では、被告が主張し、本件審決が判断を示しているとおり、本件訂正発明はPBPクレームに当たると判断した。
イ 「ピンミルのような」は衝撃式ミルの単なる例示か、衝撃式ミルの一部に限定する構成か
「ピンミルのような衝撃式ミル」とは、①ピンミルは単なる例示であって衝撃式ミル全般を意味するという理解、②衝撃式ミルに含まれるミルのうちピンミルと類似又は同等の特性を有する衝撃式ミルを意味するという理解、のいずれにも解する余地があり、特許請求の範囲の記載のみから一義的に確定することはできないことから、本件明細書の記載及び上記(ア)の本件訂正発明がPBPクレームに当たるとする解釈を併せて考えると、裁判所は、被告が主張するように、本件ピンミル構成については、
「本件訂正発明に係る薬剤組成物の含むセレコキシブ粒子が、ピンミルで粉砕されたセレコキシブ粒子に見られるのと同様の、長い針状からより均一な結晶形へと変質されて、凝集力が低下し、ブレンド均一性が向上した構造、特性を有するものであることを特定する構成であって、したがって、「ピンミルのような衝撃式ミル」とは、ピンミルに限定されるものではなく、上記のような構造、特性を有するセレコキシブ粒子が得られる衝撃式ミルがこれに含まれ得るものと理解するのが相当である」
と判断した。
ウ 上記クレーム解釈を前提とした明確性要件の適合性
裁判所は、上記(ア)(イ)のクレーム解釈を前提に、本件ピンミル構成を含む本件訂正発明の特許請求の範囲の記載が明確性要件を満たすかどうかを検討した結果、本件明細書等に加え本件出願日(明確性要件の判断の基準時)当時の技術常識を考慮しても、「ピンミルのような衝撃式ミル」の範囲が明らかでなく、「ピンミルのような衝撃式ミルで粉砕」するというセレコキシブ粒子の製造方法は、当業者が理解できるように本件明細書等に記載されているとはいえないから、本件訂正発明は明確であるとはいえない、と判断した。
「衝撃式粉砕機に分類される粉砕機としては、本件審決も認定しているとおり、多種多様なものがある(ハンマーミル、ケージミル、ピンミル、ディスインテグレータ、スクリーンミル等が知られており、ハンマーの形状によっても、ナイフ型、アブミ型、ブレード型、ピン型等がある。甲イ111、112、136)ところ、上記(4)で示したクレーム解釈によると、衝撃式粉砕機によって粉砕されたセレコキシブ粒子を含む薬剤組成物であっても、本件特許の技術的範囲に属するものと属しないものがあることになるが、本件明細書に接した当業者において、「ピンミルで粉砕されたセレコキシブ粒子に見られるのと同様の、長い針状からより均一な結晶形へと変質されて、凝集力が低下し、ブレンド均一性が向上した構造、特性を有するセレコキシブ粒子」を製造できる衝撃式粉砕機がいかなるものかを理解できるとは到底認められない。すなわち、一般に、明細書に製造方法の逐一が記載されていなくても、当業者であれば、明細書の開示に技術常識を参照して当該製造方法の意味するところを認識できる場合も少なくないと解されるが、本件の場合、本件明細書には、「ピンミルで粉砕されたセレコキシブ粒子」の凝集力の小ささ、改善されたというブレンド均一性が、ピンミルのいかなる作用によって実現されるものかの記載がないため、衝撃式ミル一般によって実現されるものなのか、衝撃式ミルのうち、ピンミルと何らかの特性を共通にするものについてのみ達成されるものなのかも明らかとなっていない。そのため、技術常識を適用しようとしても、いかなる特性に着目して、ある衝撃式ミルが本件ピンミル構成にいう「ピンミルのような衝撃式ミル」に当たるか否かを判断すればよいのかといった手掛かりさえない状況といわざるを得ない。」
裁判所は、本件においては、PBPクレームが明確性要件を充足するための不可能・非実際的事情を検討する以前の問題として、そもそも特許請求の範囲に記載された製造方法自体が明確性を欠くものであるとした。
また、裁判所は、「ピンミルのような」について、「いわゆる衝撃式粉砕機」のなかでも、さらに、「粉砕された粉体は、ジェットミルのような流体式(気流式)粉砕機とは異なる粒度分布の粉体を作製する」ことのできる装置であるとの意味づけを与えた本件審決の解釈は、本件明細書等の記載及び技術常識を考慮しても、無理があるものといわざるを得ない、と言及した。
以上より、裁判所は、不可能・非実際的事情の検討をするまでもなく、本件訂正後の請求項1、2、4、5、7~13、15、17~19の記載は明確性要件に違反するものであり、取消事由3は理由があると判断した。
(3)取消事由2(サポート要件に関する判断の誤り)について
取消事由3(明確性要件に関する判断の誤り)が認められる以上、本件審決は取消しを免れないものであるが、明確性要件違反の原因となった「本件ピンミル構成」は、前訴判決がサポート要件違反を肯定する判断をしたことを受けて、その瑕疵を回避するために特許請求の範囲に加えられたという本件の経過を踏まえると、本件訂正後の特許請求の範囲を前提としたサポート要件の適合性の問題(取消事由2(サポート要件に関する判断の誤り))についても、併せて判断を示すことが適切と考えられることから、裁判所は、取消事由2についての判断も示した。
ア 前訴判決の拘束力
まず、裁判所は、サポート要件違反を認めて第1次審決を取り消した前訴判決の拘束力がいかなる範囲に及ぶかが問題となっている点について、前訴判決の拘束力が生ずるのは、当業者が「D90が200μm未満」の数値範囲全体にわたり課題を解決できると認識できるものと認められないから本件訂正前の特許請求の範囲によって特定される発明はサポート要件に適合しないとした部分であり、本件訂正発明のサポート要件の適合性の問題は本件訂正前の特許請求の範囲を前提とする前訴判決と判断対象が異なるから、前訴判決の一部の説示を独立して取り上げて本件訂正発明についても前訴判決の拘束力が生じる(はずである)という原告らの主張は失当である、と判断した。
イ サポート要件の適合性
裁判所は、所定の数値範囲を発明特定事項に含む発明について、特許請求の範囲の記載がサポート要件に適合するか否かは、当業者が、発明の詳細な説明の記載及び出願時の技術常識から、当該発明に含まれる数値範囲の全体にわたり当該発明の課題を解決することができると認識できるか否かを検討して判断すべきものと解するのが相当であると判示したうえで、本件訂正発明の課題は、
「未調合のセレコキシブに対して生物学的利用能が改善された固体の経口運搬可能なセレコキシブ粒子を含む製薬組成物を提供することであり、取り分け、水溶液に溶解しにくいセレコキシブ粒子の特質から、混合中にセレコキシブ同士で凝集し、非均一なブレンド組成物になるとの問題の解決にある」
と認定し、本件訂正発明1は、本件明細書及び技術常識から、上記課題を解決できると当業者が認識できる範囲の発明であるといえると判断した。
「・・・例11-2では、犬モデルでの調合の相対的生物学的利用能の試験がされている。組成物A、Bは微粉化され、ラウリル硫酸ナトリウムが添加されている(【0173】、【0174】、表11-2A)。本件明細書の【0124】に「・・・例えば、例11に例示するように、出発材料のセレコキシブのD90粒子サイズを約60μmから約30μmに減少させると、組成物の生物学的利用能は非常に改善される。・・・」と記載されていることから、組成物A、BのD90粒子サイズは約30μmと認められる。他方、参考例である組成物Fは、未粉砕、未調合のセレコキシブである(【0172】)。生物学的利用能は、・・・D90粒子サイズを約30μmに減少させた組成物A、Bにおいて生物学的利用能が明らかに高い結果が示されている。
以上を総合すると、本件訂正発明1は、粒子の最大長においてD90が30μmであるセレコキシブ粒子、及び加湿剤としてのラウリル硫酸ナトリウムを含有することを特定するものであるところ、これは、①セレコキシブが長い針状の結晶形態を有することに対応するため、粉砕によって薬物の粒子径を小さくし、比表面積を増大させることにより、薬物の溶出を改善させるために、セレコキシブの粒子サイズを「D90が30μm」に減少させ、また、②セレコキシブのような難溶性薬物については、粒子径を小さくすると凝集が起こりやすくなり、有効表面積が小さくなる結果、溶解速度が遅くなるが、界面活性剤が存在すると、微粒子は凝集せずに均一に溶液中に分散され、粒子サイズが小さいほど溶出速度は大きくなることから、セレコキシブに、界面活性剤同様水に親和性を持たせる湿潤剤であるラウリル硫酸ナトリウムを含有させることとしたものである。そして、③具体的な実験結果においても、D90粒子サイズは約30μmとし、ラウリル硫酸ナトリウムを含有させたセレコキシブ組成物が、未粉砕、未調合のセレコキシブに対して優れた生物学的利用能を示しているのであるから(例11-2)、本件訂正発明1は、本件ピンミル構成を発明特定事項として考慮しなくても、本件明細書及び技術常識から、「未調合のセレコキシブに対して生物学的利用能が改善された固体の経口運搬可能なセレコキシブ粒子を含む製薬組成物を提供する」という課題を解決できると当業者が認識できる範囲の発明であるといえる。」
また、裁判所は、本件訂正発明2,4、5、7~13、15、17~19も、本件訂正発明1と同様に、本件明細書及び技術常識から、上記課題を解決できると当業者が認識できる範囲の発明であるといえると判断した。
3.コメント
(1)「ピンミルのような衝撃式ミルで粉砕」されたセレコキシブ粒子の明確性
前訴判決(ブログ記事「2019.11.14 「東和薬品・日本ケミファ・ヘキサル v. ジー.ディー.サール」 知財高裁平成30年(行ケ)10110; 10112; 10155」参照)では、本件発明1(訂正前)のサポート要件の適合性について、裁判所が、
「疎水性の難溶性物質であっても,界面活性剤が存在すると,微粒子は凝集せずに均一に溶液中に分散され,粒子サイズが小さいほど溶出速度は大きくなることは,本件優先日当時,周知又は技術常識であったこと・・・に照らすと,196μmカプセルに加湿剤として含まれるラウリル硫酸ナトリウムが,196μmカプセルの生物学的利用能の試験結果に影響した可能性が高いものと認められる。また,・・・ピンミルで粉砕し微小化しているが,前記(ア)で述べたように,本件発明1の「微粒子セレコキシブ」が「ピンミル」を利用して粉砕されたものに限定されるものではない。したがって,乙1の試験結果から,セレコキシブ粒子の最大長におけるD90が200μm未満である場合に生物学的利用能が改善されるメカニズムを認識することはできないから,被告の上記主張は採用することができない。」
と述べたことに照らして、被告は、本件訂正として、セレコキシブ粒子のD90を限定したほか、「セレコキシブ粒子が、ピンミルのような衝撃式ミルで粉砕されたものであり、」及び「ラウリル硫酸ナトリウムを含有する加湿剤を含む」という発明特定事項を付加することでサポート要件の適合性の問題の解消を図ったと思われる。
特に、「ピンミルで粉砕されたもの」と訂正することは、後発医薬品対策としては本件発明を狭く限定しすぎであろうから、「ピンミルのような衝撃式ミルで粉砕されたもの」との文言を本件訂正として採用したのだろう。
しかし、ピンミルを一例とするような衝撃式粉砕機に分類される粉砕機としては、ハンマーミル、ケージミル、ピンミル、ディスインテグレータ、スクリーンミル等が知られており、ハンマーの形状によっても、ナイフ型、アブミ型、ブレード型、ピン型等、多種多様なものがある。
このような技術常識の下、本件明細書には、ピンミルのいかなる作用によって所望のセレコキシブ粒子が実現されるものかの記載がないため、「ピンミルのような衝撃式ミルで粉砕」されたセレコキシブ粒子が、衝撃式ミル一般によって実現されるものなのか、衝撃式ミルのうち、ピンミルと何らかの特性を共通にするものについてのみ達成されるものなのか明らかとなっていないとされた。

「ピンミルのような衝撃式ミルで粉砕して所望のセレコキシブ粒子を作って!」と指示されても、指示が不明確で、どうしたら正解なのか迷うかもだな・・・

セレコキシブ粒子のD90が30μm以下であればどんなミルでもいいんじゃないの?

・・・
引用: 丙六4 粉体工学会編「粉体工学便覧第2版」日刊工業新聞社1998年3月30日発行、302頁
ところで、明確性要件について争われた過去の医薬系事件として例えば以下のような判決がある。
- 2010.11.17 「カプスゲル v. クオリカプス」 知財高裁平成21年(行ケ)10253: 「本件明細書における「#4000のポリエチレングリコール」については,明確性の要件を充足しているかなお疑問が残るものであり」
- 2012.02.29 「ジャンスー サイノーケム v. フレクシス」 知財高裁平成23年(行ケ)10108: 「調節された量のプロトン性物質」
- 2015.06.05 「テバ v. 東理」 最高裁平成24年(受)2658: 「物の発明についての特許に係る特許請求の範囲にその物の製造方法が記載されている場合において,当該特許請求の範囲の記載が特許法36条6項2号にいう「発明が明確であること」という要件に適合するといえるのは,出願時において当該物をその構造又は特性により直接特定することが不可能であるか,又はおよそ実際的でないという事情が存在するときに限られると解するのが相当である」
- 2015.06.05 「テバ v. 協和発酵キリン」 最高裁平成24年(受)1204: 「物の発明についての特許に係る特許請求の範囲にその物の製造方法が記載されている場合において,当該特許請求の範囲の記載が特許法36条6項2号にいう「発明が明確であること」という要件に適合するといえるのは,出願時において当該物をその構造又は特性により直接特定することが不可能であるか,又はおよそ実際的でないという事情が存在するときに限られると解するのが相当である。」
- 2016.03.09 「ホスピーラ v. デビオファーム」 知財高裁平成27年(行ケ)10105: 「からなり」
- 2017.01.18 「X v. ロート製薬」 知財高裁平成28年(行ケ)10005: 「平均分子量」
- 2018.06.27 「トライスター v. エーザイ」 知財高裁平成29年(行ケ)10178: 「上記条件が,「マーキングする際の任意の条件」として位置づけられ,発明特定事項として規定されていないからといって,発明の外縁が不明確になるものとは認められない」
- 2018.07.18 「日新製薬・日本ケミファ v. オリオン・ホスピーラ」 知財高裁平成29年(行ケ)10114: 「本質的に」
- 2018.09.06 「ロート製薬 v. Y」 知財高裁平成29年(行ケ)10210: 「平均分子量」
- 2019.02.06 「コスメディ製薬 v. バイオセレンタック」 知財高裁平成30年(行ケ)10100: 除くクレームと明確性
- 2019.03.19 「サン ファーマ v. ジェネンテック」 知財高裁平成30年(行ケ)10036: 「T細胞によるインターロイキン-17(IL-17)産生を阻害するための」・・・IL-17濃度の上昇が見られる患者に対して選択的に利用されるものであることを一義的に理解することができる
- 2019.04.12 「アーシャ ニュートリション サイエンシーズ v. 特許庁長官」 知財高裁平成30年(行ケ)10117: 「第三者の利益が不当に害されるほどに不明確であるということはできない」
- 2023.04.06 「グリーンクロス v. シャイアー」 知財高裁令和4年(行ケ)10010 - 医薬用途発明の優先権の効果が認められるには?/本件特許はイズロン酸-2-スルファターゼ脳室内投与製剤(ムコ多糖症II型治療剤ヒュンタラーゼ®)の障害となるのか? -: 「50mM以下の濃度のリン酸塩を含み」
- 2024.01.16 「ロシュ ダイアグノスティックス v. アボット」 知財高裁令和4年(行ケ)10082 ―「抗原Xに結合する抗体」をさらに「特異的に認識して結合する」特徴で特定する意義―: 「PIVKA-IIを特異的に認識して結合」
以上に挙げた過去の事件の中に、本件の「セレコキシブ粒子が、ピンミルのような衝撃式ミルで粉砕されたものであり」のように、プロダクト・バイ・プロセス(PBP)で表現された所望の物がどのような工程であれば得られる物なのかがはっきりせず、明確性要件の問題として争われた事例に当てはまるものはなさそうである。
特許・実用新案審査基準第 II 部 第2章第3節 明確性要件 「4.3 製造方法によって生産物を特定しようとする記載がある場合」には、製造方法によって生産物を特定しようとする記載がある場合において、発明が不明確となる類型として、「(1) 明細書及び図面の記載並びに出願時の技術常識を考慮しても、請求項に記載された事項に基づいて、製造方法(出発物、製造工程等)を当業者が理解できない結果、発明が不明確となる場合」が例示されている。本件の明確性要件の適合性はこの類型に当てはまるものかもしれない。
PBPクレームは、物自体の構造又は特性を直接特定することに代えて、物の製造方法を記載するものであり、そのような特許請求の範囲が明確性要件を充足するためには、不可能・非実際的事情の存在が要求されるのであるが(ブログ記事「2015.06.05 「テバ v. 東理」 最高裁平成24年(受)2658、2015.06.05 「テバ v. 協和発酵キリン」 最高裁平成24年(受)1204」参照)、本件においては、不可能・非実際的事情を検討する以前の問題として、そもそも特許請求の範囲に記載された「ピンミルのような衝撃式ミルで粉砕された」製造方法自体が明確性を欠くものであるとされた。
所望のプロダクトをやむを得ずプロセスで得られる物として表現する際には、そのプロセスが不明確であれば、結果として所望のプロダクトが得られるのか不明確となるため、そのプロセスの表現には疑義が生じないように注意する必要がある。

・・・と言うは易く行うは難し。
本件は、物自体の構造又は特性を直接特定することが難しい所望のプロダクトを、プロセスによる表現(プロダクト・バイ・プロセス)により試みようとすることの難しさを思い知らされる事例だったともいえそうだ。
「セレコキシブ粒子が、ピンミルのような衝撃式ミルで粉砕されたものであり」との発明特定事項を付加する訂正が必要だったのかどうかを検討することも一考の価値があるのかもしれない・・・。
さて、本件について、特許庁に審理が差し戻されたら、被告は、明確性要件に適合するようにこの部分をどのように訂正するのだろうか。
(2)サポート要件違反は数値範囲を限定する訂正により解消
取消事由3(明確性要件に関する判断の誤り)が認められる以上、本件審決は取消しを免れないものであるが、本件訂正後の特許請求の範囲を前提としたサポート要件の適合性の問題についても、併せて、裁判所は、判断を示した(サポート要件を満たすとした審決を容認)。
原告らは明確性要件の欠如という有利な判決を勝ち取ったが、サポート要件を満たすとした審決を取り消すことができず、また、他の取消事由も裁判所は判断しなかった。
なんだか消化不良な感じもするが、(最高裁への上告はあるかもしれないが)特許庁への差戻審理となり、被告はまた前述のとおり明確性要件に適合する訂正を試みることになるのだろう。
しばらく様子を見るほかない。
(3)欧米での特許状況
本件特許(特許3563036号)ファミリーである欧州特許や米国特許の状況は以下のとおりである。日本と同じように、「本件ピンミル構成」についての明確性要件やサポート要件が問題となっているのだろうか。
欧州
欧州特許 EP1049467Bは、追加事項の追加、開示不十分、新規性および進歩性の欠如に基づき特許の全部取消しを求めるTava社らによる異議申立てと、その特許無効の決定に対する審判を経て、最終的には特許は無効とされた(T 0696/05 (Celecoxib compositions/SEARLE) )。
当初の登録Claim 1は、以下のとおりであった。
新規性に問題があると主張されていたところ、特許権者は、Auxiliary requestにて”having a relative bioavailability of celecoxib not less than 50%, preferably not less than 70% by comparison with an orally delivered solution containing the same dose of celecoxib.”という構成を請求項1に付加する要求をしたが、審判部は、「相対的バイオアベイラビリティ」に関する定義を導入することは、達成されるべき結果として表現された条件が適用されるものにすぎず、当該特徴は、公知の医薬組成物に対する新規性を基礎づけることができる限定的特徴として認めることはできないと判断した。
異議申立ての後又は審判手続きにおいて、特許権者は、日本において問題となった「本件ピンミル構成」を付加する訂正を要求することはなかった。
米国
米国特許US9750756B2のClaim 1は以下のとおりである。日本において問題となった「本件ピンミル構成」はない。
1. A pharmaceutical composition comprising one or more orally deliverable dose units, each comprising particulate celecoxib in an amount of about 10 mg to about 1000 mg in intimate mixture with one or more pharmaceutically acceptable excipients, and having a distribution of celecoxib particle sizes such that D 90 of the particles is less than 200 µm; said composition exhibiting upon oral administration a relative bioavailability not less than about 50% by comparison with an orally delivered solution containing celecoxib at the same dosage rate, wherein said excipients include:
a. one or more pharmaceutically acceptable diluents in a total amount of about 5% to about 99% by weight of the composition;
b. one or more pharmaceutically acceptable disintegrants in a total amount of about 0.2% to about 30% by weight of the composition;
c. one or more pharmaceutically acceptable binding agents in a total amount of about 0.5% to about 25% by weight of the composition;
d. one or more pharmaceutically acceptable wetting agents in a total amount of about 0.25% to about 15% by weight of the composition; and
e. one or more pharmaceutically acceptable lubricants in a total amount of about 0.1% to about 10% by weight of the composition.
上記米国特許の登録は2017年9月5日と遅かったため、セレコキシブ(Celecoxib)を有効成分とする非ステロイド性消炎・鎮痛剤(COX-2選択的阻害剤)Celebrex®(米国での商品名)のOrange Bookに当該特許が収載されることはなかったようである(保護するかも不明)。
既に後発医薬品メーカーとのANDA訴訟が勃発しており、2014年4月17日、Celebrex®を保護する他の特許権についての侵害訴訟でPfizer社と争っていたTeva社は、Pfizer社との間で、Teva社のCelebrex®カプセルの後発医薬品に関する和解契約を締結した(2014.04.17 Teva社 press release: Teva Settles Patent Litigation with Pfizer on Celebrex®)。この和解に基づき、Teva社は2014年12月にその後発医薬品の発売を開始した(2014.12.10 Teva社 press release: Teva Announces Launch of First Generic Celebrex® Capsules in the United States)。
Celebrex®の後発医薬品を巡る米国特許訴訟に関する参考情報:
- Patent Docs: March 10, 2008 Pfizer, Inc. v. Teva Pharmaceuticals USA, Inc. (Fed. Cir. 2008)
- Patent Docs: June 24, 2015 G.D. Searle LLC v. Lupin Pharmaceuticals, Inc. (Fed. Cir. 2015)
- Orange Book Blog: March 10, 2008 Federal Circuit Invalidates Pfizer’s Latest-Expiring Patent on Celebrex, for Double Patenting
- Patently-O: March 10, 2028 Pharma Prosecution: CIP Breaks Priority for Restricted Claims
(4)セレコックス®錠と後発医薬品の日本市場参入
ア セレコックス®錠と後発医薬品の市場参入
本件特許(第3563036号)は、非ステロイド性消炎・鎮痛剤(COX-2選択的阻害剤)セレコックス®錠(有効成分: セレコキシブ(Celecoxib))を保護するものである(米国での商品名はCelebrex®)。
有効成分であるセレコキシブは、1992 年に米国サール(G.D.Searle)社(現 米国Pfizer社)で合成された。
日本では、1996 年4月から山之内製薬(現 アステラス製薬)と日本モンサント(現 Pfizer)が共同開発を実施し、2007年1月26日に「関節リウマチ、変形性関節症」を効能・効果としてアステラス製薬がセレコックス®錠の製造販売承認を取得した(販売提携 ファイザー)。
その後、2009年6月17日には「腰痛症、肩関節周囲炎、頸肩腕症候群、腱・腱鞘炎」、2011年12月22日には「手術後、外傷後並びに抜歯後の消炎・鎮痛」の効能・効果が追加承認された。
本件特許の20年の存続期間満了日は2019年11月30日であったが、存続期間の延長登録により、「関節リウマチ、変形性関節症」については2022年6月26日、「腰痛症、肩関節周囲炎、頸肩腕症候群、腱・腱鞘炎」及び「手術後、外傷後並びに抜歯後の消炎・鎮痛」については2024年11月30日が満了日となっている。
再審査期間は、「関節リウマチ、変形性関節症」については、2007年1月26日~2015年1月25日(8年間)、「腰痛症、肩関節周囲炎、頸肩腕症候群、腱・腱鞘」及び「手術後、外傷後並びに抜歯後の消炎・鎮痛」についても、「関節リウマチ、変形性関節症」の残余期間(2015年1月25日)までであったことから、再審査期間が終了した2015年以降、セレコックス®錠の市場独占性は物質特許(第3025017号)及び本件特許(第3563036号)によって守られていた。
セレコックス®錠を保護する物質特許に係る延長された特許権(5年間)が2019年11月14日に満了したことにより、2020年2月17日には、セレコックス®錠の後発医薬品(20社40品目)が初承認となった。
この40品目の後発医薬品には、本件原告であるテバ(武田テバ)、東和薬品、日医工、日本ケミファからの後発医薬品のほか、オーソライズド・ジェネリック(AG)であるセレコキシブ錠100mg「ファイザー」・同200mg「ファイザー」も含まれていた(2020.03.16 ファイザー株式会社 press release: 「ファイザー、セレコキシブ錠でAG市場に参入 先発医薬品と同一の品質を有する医薬品で治療する選択肢を提供し、増大するNCDの負担軽減に貢献」)。
多数の後発医薬品の市場参入に対抗して、他社後発医薬品発売と同時期の2020年6月、ファイザーはAGの販売に踏み切った(2020.06.19 ファイザー press release: 「セレコキシブ錠100mg「ファイザー」、同200mg「ファイザー」発売~ファイザー初のAGで社会と患者さんが負うNCDの負担軽減に貢献~」)。
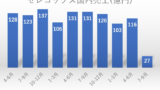
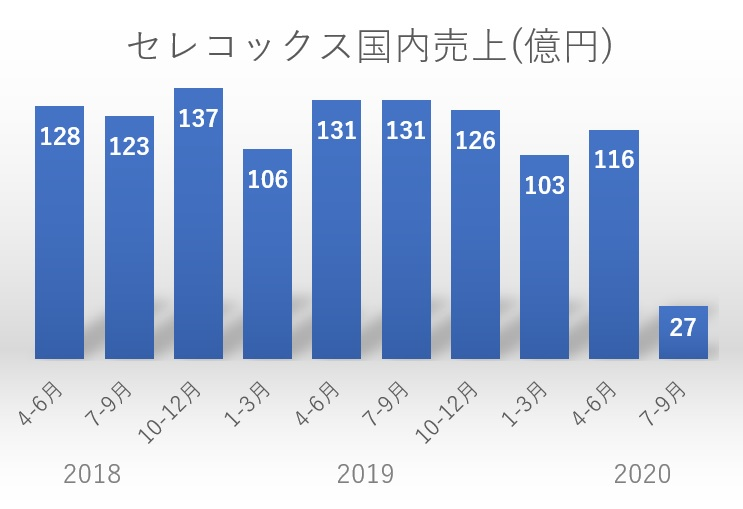
2019年3月期(2018年度)は494億円、2020年3月期(2019年度)は492億円であったアステラス製薬によるセレコックス®錠の国内売上は、上記グラフのとおり、後発医薬品の市場参入により大きな影響を受けた。
アステラス製薬は、2021年にセレコックス®錠の製造販売承認をヴィアトリス製薬に承継、同社に販売を移管した(2020.12.07 アステラス press release: 「セレコックス®錠」の共同販促終了、製造販売承認の承継および販売移管について)。
ファイザーから販売されたAGも、現在は、ヴィアトリス・ヘルスケア合同会社へと承継され、その名称は、セレコキシブ錠100mg「VTRS」、同200mg「VTRS」に変更されている。
イ 市場参入を果たした原告らの後発医薬品
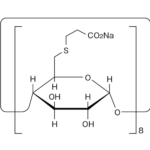
さて、こうして市場参入を果たした各後発医薬品の製剤の内容であるが、それらの医薬品インタビューフォームを見ると、例えば、武田テバが製造販売するセレコキシブ錠100mg「武田テバ」/セレコキシブ錠200mg「武田テバ」、東和薬品が製造販売するセレコキシブ錠100mg「トーワ」/セレコキシブ錠200mg「トーワ」、日本ケミファが製造販売するセレコキシブ錠100mg「ケミファ」/セレコキシブ錠200mg「ケミファ」には、添加剤として「ラウリル硫酸ナトリウム」が含まれていることがわかる。
また、これらセレコキシブ製剤について、武田テバでは中国にて原薬及び日医工にて製剤を、東和薬品では韓国またはインドにて原薬を、日本ケミファでは韓国又は中国にて原薬を及び生達化學製藥 にて製剤を、それぞれ製造していることが各社ホームページ上で公開されているが、セレコキシブ粒子がどのように粉砕されたものであるかやどのような粒子サイズの分布を有しているのかまでは明らかでない。

仮に、特許権侵害訴訟になった場合には、本件特許に係る請求項の各構成を実施しているのかどうか、証拠を収集するために、韓国、中国、インドの製造委託会社にまで査証で立ち入るわけにもいかないでしょうね。
原薬又は製剤製造国である韓国、中国、インドでも、本件特許のファミリー特許が存在すれば、それは後発医薬品メーカーの製造にとって脅威となりうるだろうから、当該ファミリー特許がこれら国にも存在する(存在した)か確認してみた。
韓国
韓国では、以下の請求項98等を有する特許第10-0501034号(出願番号10-2000-7008340)が登録されていたことが確認できたが、無効審判請求を受け、進歩性の欠如を理由として無効とする審決が下されている(2015당287 事件等多数: 審決日2015年5月14日)。
中国
また、中国では、特許第1154490号(出願番号99802185)が登録されたが、一部無効とする審決が下されたようである。
中国では、もうひとつ特許第1299683号(出願番号200410037522)が登録されたが、全部無効とする審決が下されたようである。
インド
インドでは、特許第221584号(出願番号IN/PCT/2000/106/KOL)が登録された。
上記、韓国、中国、インドの特許ファミリーは無効とされているか否かに関わらず、出願日(1999年11月30日)から20年の存続期間は満了している。
後発医薬品メーカーである原告らは、本件特許請求の範囲に包含される(特許発明の技術的範囲に属する)セレコックス®錠(セレコキシブ)の後発医薬品を販売しているのだろうか(だからこそ、本件無効審判を請求したのかもしれないはずだが)。
原告らによる2016年の無効審判請求は請求不成立審決となったものの審決取消訴訟(前訴判決)では原告らが勝訴した。しかし、特許庁での差戻審理では、訂正によりまたも請求不成立審決(本件審決)、そしてまた審決取消訴訟(本件判決)により、また特許庁での差戻審理となりそうだ。
これからの審理で訂正がどのようにされるのか、その訂正発明がどのような範囲に落ち着くのか・・・。
もし、今後の審理で、新たな訂正後の発明に係る特許が有効と判断され、販売中の後発医薬品がその発明の技術的範囲に属し且つ延長された特許権の効力が及ぶ範囲であると判断されるとなれば、2020年から現在に至るまで後発医薬品を販売し続けてきた行為は本件特許権を侵害していたこととなり、莫大な損害賠償金が膨らみつづけていることになる(存続期間の延長登録により存続期間満了日は最長で2024年11月30日である)。
原告らは、仮に、本件特許が有効となった場合であって販売中の後発医薬品がその発明の技術的範囲に属しているとしたら、被告(特許権者)から、現在まで膨らみ続けてきた損害賠償金を請求されるかもしれない・・・と、ずっと気にかかって心が落ち着かないでいる(?)かもしれない。



コメント